基于磁性纳米粒子的免疫荧光法测定 花生中的黄曲霉毒素B1
2021-09-14康雪梅赵雪峰曹静杰贾松涛李梦雨赵林萍
◎ 陶 燕,康雪梅,李 超,赵雪峰,曹静杰,贾松涛,李梦雨,赵林萍
(河南中标检测服务有限公司,河南 郑州 450001)
黄曲霉毒素(AFs)是自然界中黄曲霉和寄生曲霉属真菌产生的有毒代谢物。有一系列不同类型的AFs,AFB1和AFG1(黄曲霉毒素G1)毒性最强,食用受污染的谷物或动物产品可能影响人体健康。据报道,AFB1具有致癌作用,是一种免疫抑制剂,即对人体有致癌作用。因此,迫切需要一种高选择性的AFB1检测方法。
黄曲霉毒素分析方法有很多,有研究[1]对样品预处理和分析方法进行了分类,免疫亲和或多纯化柱是仪器分析常用的材料,如高效液相色谱、气相色谱和液相色谱。这些方法要求实验室设备完善,耗时且昂贵。AFB1的检测方法和商业试剂盒有很多,免疫化学方法已成功用于食品和饲料中AFB1的检测。YU等[2]发现AFB1酶联免疫吸附试验(ELISA)的检测限 (LOD)为10 pg·mL-1和90 pg·mL-1。ELISA可 能出现假阳性或阴性,常有基质干扰,且检测时间很长。近年来,纳米材料已广泛应用于免疫分析的开发。纳米颗粒已被用作固定化生物分子的支撑材料或作为示踪剂获得扩增检测。磁性微球具有良好的生物相容性,反应后易于从反应溶液中分离。目前,已经开发出利用金纳米颗粒对AFB1进行磁性比色免疫分析,WANG等[3]描述了一种检测AFB1的竞争性方法,在样品中的AFB1和涂上AFB1-BSA的磁性微球间进行竞争性结合,该方法已应用于玉米样品检测。但上述描述的方法都由许多组件和步骤组成,成本较高,且准备工作较长,当在分析中使用多组件时,会产生不正确结果的风险,因此,急需一种快速、简单的AFB1测定方法。
本文提出了一种快速、灵敏的基于MNP的AFB1免疫荧光检测方法,该方法仅由两种成分组成,即涂有MNPs的多克隆抗AFB1抗体和AFB1-BSA-FITC荧光偶联物。该方法满足了用户的3个主要要求:样本量小、AFB1检出限低、检测时间短。
1 材料与方法
1.1 材料
黄曲霉毒素B1、黄曲霉毒素B1-BSA偶联物、荧光素5(6)-异硫氰酸酯、二甲基甲酰胺、Sephadex G25培养基、2-氨基-2-(羟甲基)-1,3-丙二醇(Tris)、NaCl、(3-氨基丙基)三乙氧基硅烷(APTES)、兔分离抗血清产生的多克隆抗黄曲霉毒素B1抗体、戊二醛、牛血清白蛋白(BSA)、吐温80,均从德国Sigma Aldrich订购。实验用水经ELGA PURELAB Option纯化。
1.2 AFB1-BSA-FITC偶联物的获得与证明
AFB1-BSA的荧光偶联物的获得。荧光素5(6)-异硫氰酸酯(FITC)为荧光标记物,最大发射波长519 nm(绿色)。偶联方法是,1.5 mg AFB1-BSA加入到1 mL碳酸盐-碳酸氢盐缓冲液(pH=9.6),FITC溶于二甲基甲酰胺(1 mg·mL-1),然后,AFB1-BSA与0.24 mL FITC溶液混合在一个避光的玻璃瓶中。在4 ℃下反应过夜后,用Sephadex G25中性柱子(10×220 mm)过滤反应混合物,用Tris缓冲液(pH=8.2)洗脱。使用6900紫外/可见分光光度计测定各组分的吸光度,265 nm(AFB1)、280 nm(蛋白质)和495 nm(FITC),通过荧光分光光度分析(Perkin Elmer LS45荧光分光光度计)证实了所得到的荧光共轭物为AFB1-BSA-FITC。
1.3 APTES包覆MNPs及抗AFB1多克隆抗体的固定化
磁性纳米颗粒(MNPs)参照GABROVSKA等人[4]研究的制备方法获得。利用APTES修饰,使其在MNPs上形成氨基基团[5]。①经修饰的MNPs作为多克隆抗-AFB1抗体的固相载体,戊二醛活化纳米粒子用于抗体结合,APTES涂层的MNPs(10 mg)悬浮于2 mL 5%戊二醛的磷酸盐缓冲液(PB,50 mmol · L-1, pH为8.0),室温下在摇床上反应2 h,将活化的涂布APTES的MNPs用2 mL 50 mmol·L-1PB洗涤(pH 8.0),再用2 mL 10 mmol·L-1PB(pH 7.4)洗涤5次。 ②完全去除多余的戊二醛后,将多克隆抗-AFB1抗体(327 μg·mL-1)1.6 mL 10 mmol·L-1PB(pH 7.4)加入到纳米粒子中。悬浮液在4 ℃下反应过夜。抗-AFB1抗体被固定在活化的APTES涂层MNPs上(MNP-Ab),用10 mmol·L-1pH为7.4的PB进行3次洗涤,加入 2 mL阻断液(10 mmol·L-1PB,pH为7.4,含5% BSA和0.05% Tween 80),在室温下摇床上反应1 h;然后对MNP-Ab进行4次洗涤。③将MNP-Ab重新悬浮于10 mmol·L-1PB(pH=7.4)至终浓度为5 mg·mL-1。
检测固定化抗体活性。在聚苯乙烯微效板上对抗-AFB1抗体进行非特异性吸附,采用Bradford法 (100 μg)测定抗体吸附量。使用和MNP-Ab相同数量的抗体,3种浓度的AFB1-BSA-FITC荧光共轭物(30 μg·mL-1、50 μg·mL-1和100 μg·mL-1,10 mmol·L-1PB,pH为7.4,含10%甲醇)用于抗体活性测定。
1.4 MNP-Ab用量和荧光共轭浓度的优化
优化MNP-Ab的用量和AFB1-BSA-FITC的浓度。比较3种不同用量的MNP-Ab:0.125 mg、0.250 mg和0.375 mg,稀释缓冲液为10 mmol·L-1PB,pH为7.4,含10%甲醇。①几种不同浓度的200 μL AFB1样 品(0.25 pg·mL-1、1.00 pg·mL-1、12.50 pg·mL-1、 50.00 pg·mL-1和100.00 pg·mL-1)加入含MNP-Ab小瓶中,在37 ℃摇床中反应15 min。②每个样品中加入荧光偶联物AFB1-BSA-FITC 22 μL(28 μg·mL-1),这些混合物在37 ℃摇床进一步反应15 min。③用磁力分离器收集偶联AFB1的MNP-Ab和偶联AFB1-BSA-FITC的MNP-Ab。测定上清液中过量的AFB1-BSA-FITC荧光强度,荧光强度与AFB1与MNP-Ab结合呈线性正相关,荧光测量采用荧光分光光度计,得到的荧光数据归一化(NS,%),采用公式(1)计算:
式中:B0为初始AFB1-BSA-FITC偶联物溶液的荧光强度,b为含AFB1样品的荧光强度,Bx为不含AFB1样品的荧光强度。
归一化信号与样本中AFB1浓度呈线性负相关,NS越高,AFB1浓度越低。
优化AFB1-BSA-FITC偶联浓度。试验偶联物浓 度 分 别 为22 μg·mL-1、28 μg·mL-1和35 μg·mL-1, AFB1的使用浓度分别为0.25 pg·mL-1、1.00 pg·mL-1、12.50 pg·mL-1、50.00 pg·mL-1和100.00 pg·mL-1。①在小瓶中加入0.25 mg MNP-Ab。②加入200 μL AFB1溶液,在37 ℃摇床中反应15 min。③加入22 μL的偶联物,在相同条件下反应。④使用磁力分离器收集上清液中的过量的AFB1-BSA-FITC,按上述方法测定上清液的荧光强度,并将信号归一化。
1.5 花生中AFB1的测定
花生用研钵和杵磨成细粉,过筛。将所得的花生粉放入4个容器中(各1 g),3个样品,1种没有毒素只有甲醇的样品。加入溶于甲醇的AFB1使之达到 3个AFB1浓度水平(0.4 ng·g-1、1.0 ng·g-1、2.0 ng·g-1)。 样品分别在室温下干燥过夜提取。提取时甲醇/水的比例为80/20(5 mL)。进行下一步含量检测。①制备4瓶MNP-Ab(0.25 mg)。②加 入200 μL的 花生AFB1稀释提取物,悬浊液在摇床中37 ℃下反应 15 min。③加 入AFB1-BSA-FITC偶 联 物22 μL,浓度为28 μg·mL-1(稀释缓冲液为含有0.1% BSA的 PB-10%甲醇),在37 ℃的摇床中反应15 min后,按上述方法测定上清液的荧光强度。

2 结果与分析
2.1 AFB1-BSA-FITC偶联物的获得与证明
竞争性抗原-荧光染料的制备是竞争性免疫荧光分析的主要内容之一。在本研究中,使用商业上可获得的AFB1-BSA偶联物,可用于直接标记FITC。
所得AFB1-BSA-FITC偶联物经紫外可见光谱和荧光分光光度分析可证实。比较AFB1-BSA-FITC、游离的AFB1-BSA和游离的FITC的吸收光谱,该荧光偶联物对游离的AFB1-BSA的典型吸收最大值为265 nm和355 nm,对游离的FITC的吸收最大值为495 nm,这3个峰的存在是AFB1-BSA-FITC偶联形成的证据。在光谱中AFB1(自身荧光)在435 nm的特征发射峰可以观察到,在527 nm处还出现了另一个峰,这是FITC在偶联物中存在的证据。因此,AFB1-BSAFITC偶联物被成功制备。
2.2 APTES包覆MNPs及抗AFB1多克隆抗体的固定化
通过湿法合成的MNPs中含有羟基作为官能团,固定抗体较为困难,因此修饰MNPs是一个必要的步骤。通过APTES涂层在MNPs表面获得了氨基,经过APTES改性后,颗粒尺寸增大,涂覆后MNPs尺寸为8.2 nm,这种MNPs尺寸对于确保磁体完全分离是非常重要的。
APTES包被的MNPs作为多克隆抗AFB1抗体固定化的固体载体。通过戊二醛结合剂将APTES包覆的MNP表面上的氨基与抗体氨基偶联,偶联后进行Bradford检测,结果表明,每1 mg MNPs固定有40 μg抗-AFB1抗体。测定了固定在MNPs的抗体的活性,并与吸附在微孔板上的游离抗体的活性进行了比较,比较结果表明,两种抗体的活性非常相似,相对活性为92%,结果表明,固定在MNPs上的抗AFB1抗体活性不受化学结合剂的影响。
2.3 MNP-Ab用量的优化
MNP-Ab含量和荧光偶联物浓度的优化是建立单一免疫分析法的重要步骤。不同浓度的MNP-Ab分别在AFB1-BSA-FITC偶联物(28 μg·mL-1)和5种不同浓度的目标抗原(AFB1)下使用。图1显示了从5种 不 同 浓 度 的AFB1(0.25 pg·mL-1、1.00 pg·mL-1、 12.50 pg·mL-1、50.00 pg·mL-1和100.00 pg·mL-1) 和 3种不同数量的MNP-Ab中获得的归一化信号,归一化信号与样品中的AFB1浓度呈线性负相关。
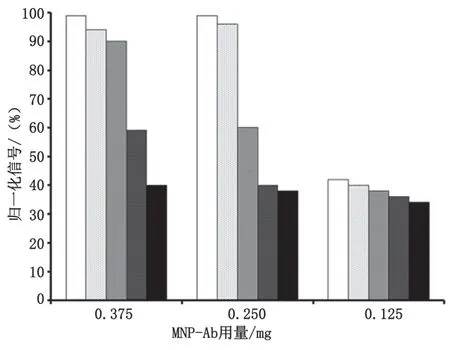
图1 MNP-Ab的用量优化图
结果表明,MNP-Ab的最佳用量为0.250 mg。这种情况下,上清液中游离的偶联物荧光强度足够高,不同AFB1添加浓度下上清液中荧光强度的变化也是最大的。显然,此浓度抗体提供的免疫分析分辨率较好。
2.4 荧光共轭物的优化浓度
对荧光共轭物的浓度进行优化,结果如图2所示。主要目标在不同的抗原浓度下获得足够强的荧光信号和良好的分辨率。在不同AFB1浓度下(0.25 pg·mL-1、 1.00 pg·mL-1、12.50 pg·mL-1、50.00 pg·mL-1和 100.00 pg·mL-1),AFB1-BSA-FITC偶联荧光信号变化最大时,浓度为28 μg·mL-1,信号归一化后可得到证实。因此,此共轭浓度被选择为最佳,以确保提高免疫分析分辨率。
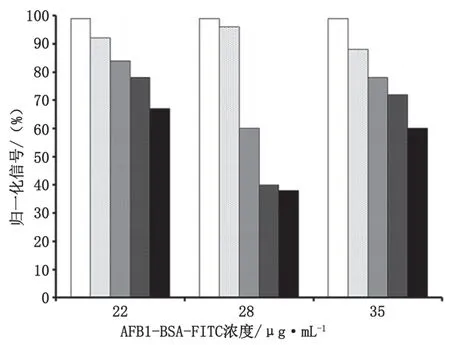
图2 优化的AFB1-BSA-FITC浓度随AFB1浓度变化图
2.5 花生中AFB1的测定
花生中加入溶于甲醇的AFB1以达到3种不同浓度(0.4 ng·g-1、1.0 ng·g-1、2.0 ng·g-1),同 时 选 一 个不含毒素只有甲醇的花生样本,样品干燥后,进行提取程序,提取后稀释提取液,计算相对标准偏差(RSD)和回收率,见表1,花生中AFB1浓度越低,其结果RSD越低,可接受的回收率为96%~120%。样品体积为40 μL,不提取情况下,检测时间不超过 35 min,同时获得的LOD足够低(0.9 pg·mL-1),因此,建立的免疫分析法可用于实际样品中AFB1的检测。所开发的检测方法能够在没有非特异性干扰的情况下测定低浓度的毒素。
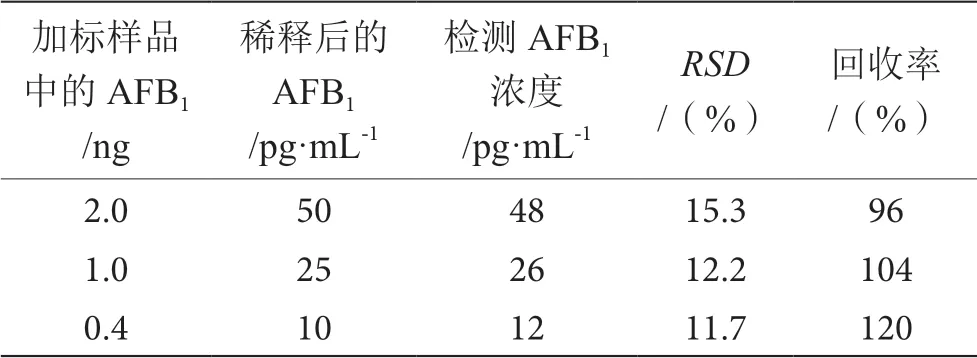
表1 添加花生样品中AFB1的检测结果及回收率表(n=3)
3 结论
建立了一种快速、灵敏的基于MNP的竞争性免疫荧光检测方法检测AFB1,检测线性范围为2~100 pg·mL-1, AFB1免疫检测的LOD较低,为0.9 pg·mL-1。获得的免疫测定时间小于35 min。在这种体系中,分析物到固定抗体的传质距离大大缩短,因此,与抗体固定在平面表面(如酶标板孔)相比,可更快实现抗体-抗原结合平衡。所得结果证实了所开发的基于磁性纳米颗粒的免疫荧光法在实际样品中测定AFB1的优势。
