微生物法测定婴幼儿乳粉中叶酸含量方法优化
2021-09-14张晓金杨丹妮邹雨虹鲍晗锋
◎ 张晓金,杨丹妮,邹雨虹,鲍晗锋
(常州市食品药品纤维质量监督检验中心,江苏 常州 213000)
叶酸是一种水溶性维生素,分子式是C19H19N7O6,它广泛存在于肉类、鲜果、蔬菜中,因绿叶中含量十分丰富而得名[1]。在自然界中有几种存在形式,其母体化合物是由喋啶、对氨基苯甲酸和谷氨酸3种成分结合而成[2]。叶酸作为人体必需的维生素之一,对于蛋白质的代谢、生理机能的维持起到重要的作用。我国建议成年人每日叶酸摄入量为200 µg,孕妇每日叶酸摄入量为400 µg。妊娠期的妇女服用叶酸不但能够有效促进胎儿身体器官的发育,而且对于降低胎儿神经管畸形发生率、改善贫血、预防早产[3]等都具有重要作用。研究表明,维持体内较好的叶酸水平,对降低抑郁症、脑卒中和肿瘤等疾病的发病概率具有积极作用。因此食品中叶酸含量的准确测定十分关键,对居民日常饮食、预防疾病具有重要意义。
目前对叶酸的定量检测方法有很多,如高效液相色谱法[4]、液质联用法[5]、酶联免疫法[6]等。但是微生物方法因其稳定性好、灵敏度高等优点成为叶酸检测的首选方法[7-9]。本研究通过对《食品安全国家标准 食品中叶酸的测定》(GB 5009.211—2014)[10]进行方法和细节优化,理顺整个实验的操作过程,改善标准中的接种液的制备、培养基的配制、样品的培养时间等关键控制点,为需要运用国标方法进行叶酸含量检测的工作者提供理论和操作的参考。
1 材料与方法
1.1 材料与试剂
鼠李糖乳杆菌菌种:广东省微生物菌种保藏中心;叶酸标准品(纯度≥97%):北京科量技术有限公司;叶酸测定用培养基、乳酸杆菌肉汤培养基、菌株储备用琼脂培养基:北京陆桥技术股份有限公司;氢氧化钠、乙醇、氯化钠:分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
SQ510C立式压力蒸汽灭菌锅:重庆雅马拓科技有限公司;MPR-710医用冷藏箱:松下冷链大连有限公司;UV-2600紫外-可见分光光度仪:岛津仪器苏州有限公司;3-18R台式高速冷冻离心机:上海托莫斯科学仪器;BHC-1300IIB2生物安全柜:苏洁医疗器械苏州有限公司;SB25-12DTD超声波振荡器:宁波新芝生物科技股份有限公司;BD115恒温培养箱:德国宾德公司;Lab dancer涡旋混匀器:艾卡广州仪器设备有限公司。
1.3 实验方法
1.3.1 玻璃器皿的清洗
将实验所需玻璃器皿洗刷干净,沸水浴30 min,沥干后放入盐酸浸泡液中浸泡2 h,蒸馏水清洗,经170 ℃度烘干3 h后备用。
1.3.2 菌种的制备
将鼠李糖乳杆菌转种于菌株储备用琼脂培养基,36 ℃培养20 h。连续传种3代后接种于乳酸杆菌肉汤培养基中,于36 ℃培养20 h后的菌悬液接种于磁珠保藏管内,-70 ℃作为工作菌株保存。临实验前一天将磁珠保存的鼠李糖乳杆菌接入乳酸杆菌肉汤培养基中,36 ℃培养20 h进行活化。活化后放入冷藏冰箱备用,用于接种液的制备。
1.3.3 叶酸标准储备液的制备
精确称取20.6 mg叶酸标准品,用氢氧化钠乙醇溶液(0.01 mol·L-1)溶解并转入1 000 mL容量瓶中,定容至刻度。
1.3.4 叶酸标准储备液的标定
吸取20 mL标准储备液至100 mL容量瓶,用氢氧化钠溶液(1 mol·L-1)定容至刻度。吸取20 mL氢氧化钠乙醇溶液于100 mL容量瓶中,用氢氧化钠溶液定容至刻度作为调零管。用1 cm比色杯在256 nm下,测3次吸光度,取平均值计算,见表1。标定好的叶酸标准储备液置于棕色瓶中。
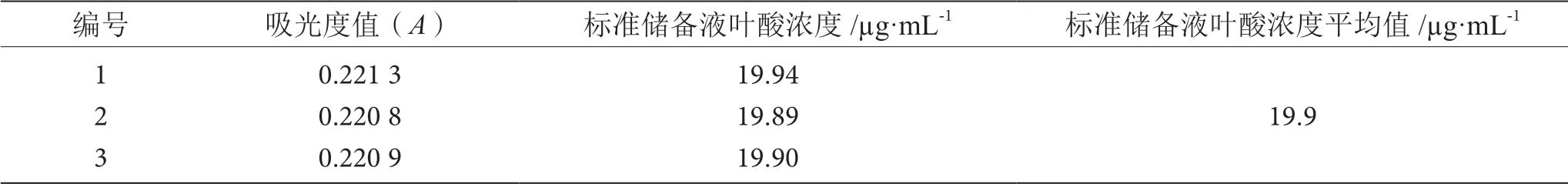
表1 叶酸标准储备液浓度标定表
1.3.5 叶酸标准中间液的制备
准确吸取5 mL叶酸标准储备液于500 mL棕色容量瓶,用氢氧化钠乙醇溶液稀释定容。
1.3.6 培养基的制备
按产品要求配制实验所需用量的叶酸测定用培养液,加热煮沸至完全溶解,待培养液冷却后过滤,放入冰箱待用。
1.3.7 叶酸标准工作液的制备
吸取1 mL叶酸标准中间液于1 000 mL容量瓶,用水定容至刻度(现配现用)。
1.3.8 种子培养液的制备
取4 mL叶酸标准工作液和8 mL叶酸测定用培养液混匀,分装至2支10 mL离心管中,并分别标注为A管和B管(A管为实验管,B管为备用管)。另取1支仅含5 mL叶酸测定用培养液的离心管标注为C管。将A、B、C管于121 ℃灭菌5 min。将活化的菌株用接种环转接于冷却后的A管和B管中,36 ℃培养20 h,培养后的A管和B管离心弃去上层液体,再用0.85%无菌生理盐水重复清洗3次。在无菌操作下吸取0.5 mL A管菌悬液转种于仅含5 mL叶酸测定用培养液的C管,36 ℃培养6 h,即为接种液。
1.3.9 样品的制备
准确称取0.1~0.5 g,精确至0.001 g样品于100 mL 锥形瓶中,另取100 mL锥形瓶做空白。加入80 mL氢氧化钠乙醇溶液,具塞,超声4 h,转入100 mL容量瓶中用水定容至刻度,过滤。根据试样中叶酸的含量,用水对提取液进行稀释,使得稀释后的叶酸含量在0.2~0.6 ng·mL-1的范围内。
1.3.10 标准系列管的制备
取系列管S1~S10分别加入叶酸标准工作液、实验室用水和叶酸测定用培养基,见表2。为保证曲线的线性关系,需配置3套系列管。

表2 标准系列管的制备表
1.3.11 样品系列管的制备
取3支试管分别加入样液0.5 mL、1.0 mL、2.0 mL,然后加入实验室用水和叶酸测定用培养液,混匀,见表3。
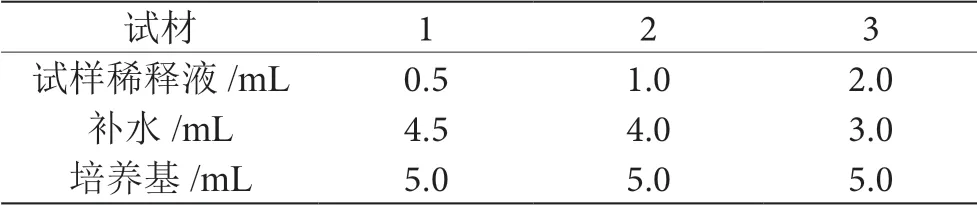
表3 样品系列管的制备表
1.3.12 灭菌及接种培养
将所有标准系列管和试样管塞好对应的塞子,于121 ℃高压灭菌5 min,灭菌完成后为防止培养液颜色加深,应立即将系列管放入冷藏冰箱冷却降温。冷却完成后,在无菌条件下向除0对照管外的系列管中各加入50 µL的接种液[11],塞好对应塞子,涡旋混匀,于36 ℃培养30 h。
1.3.13 标准系列管和样品的测定
将培养好的标准系列管和试样管用1 cm厚的比色皿,于540 nm处,将0对照管调节吸光度为0,测定系列管和试样管并记录对应的吸光度值。在每支需测定反应管的吸光度值前用涡旋器混匀10 s,混匀后立即倒入1 cm比色皿中,放入卡槽,5 s后读数并记录相应的吸光度值。因菌悬液的沉淀,所以需要相同时间上机读数,以确保系列管的线性和试样测定结果的准确性。
2 结果与分析
2.1 培养液制备的优化
国家标准中未对叶酸测定用培养液的制备有详细的表述,通过实验发现煮沸溶解而未经过滤的培养液会有少许的沉淀现象出现,而这些沉淀容易造成标准曲线基线不稳定的情况。因此经过煮沸且过滤的培养液,可以有效保证标准曲线的线性关系。
2.2 菌悬液接种量和培养时间的优化
国家标准中菌悬液的接种量为20 µL,培养时间为20~40 h。由于微生物生长的特异性,接种量过少,培养时间过长,容易导致叶酸含量少的基点读数偏高;接种量少,培养时间过短,容易导致叶酸含量多的基点读数偏低。经过多次实验对比发现接种量为50 µL,培养时间30 h最为适宜,其标准曲线相对比较稳定。
2.3 灭菌时间的优化
国家标准中对培养液、系列管和试样管的灭菌要求都是121 ℃、15 min。但经过实验发现,过长的灭菌时间会导致培养液的自身颜色加深,从而影响整体的准确性。而121 ℃、5 min也能达到有效的灭菌效果,其颜色对标准曲线的影响也能降到最低。
2.4 叶酸标准曲线绘制
以标准系列管中叶酸含量为横坐标,以3套标准管每个标准点吸光度值的平均值为纵坐标,绘制标准曲线为Y=-0.564 7X2+1.491X+0.237 4,其中标准曲线相关系数r2=0.997 6,见图1。由于微生物生长分为:迟缓期、对数期、稳定期、衰亡期4个时期[12],所以标准曲线需要应用多变量方程来计算。
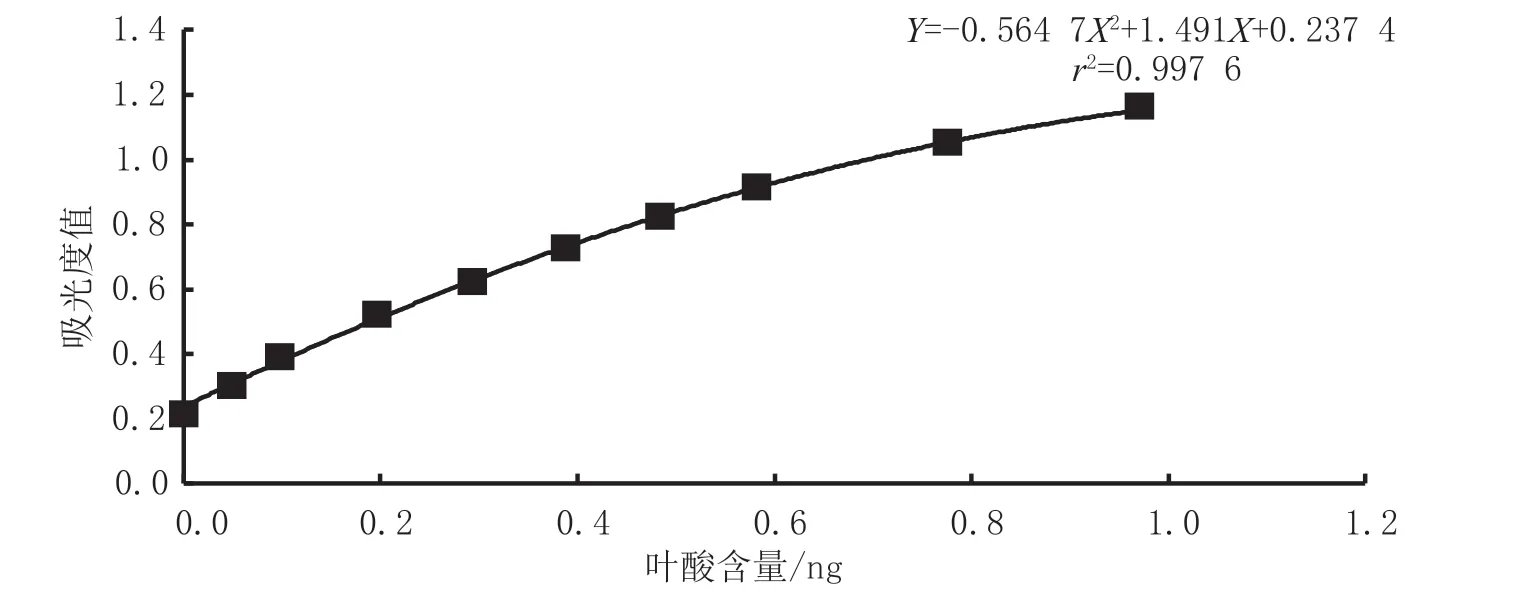
图1 婴幼儿乳粉中叶酸含量标准曲线图
2.5 重复性实验
用以上方法对同批次的婴幼儿乳粉中的叶酸进行取样测定6次,实验结果较为满意,见表4。
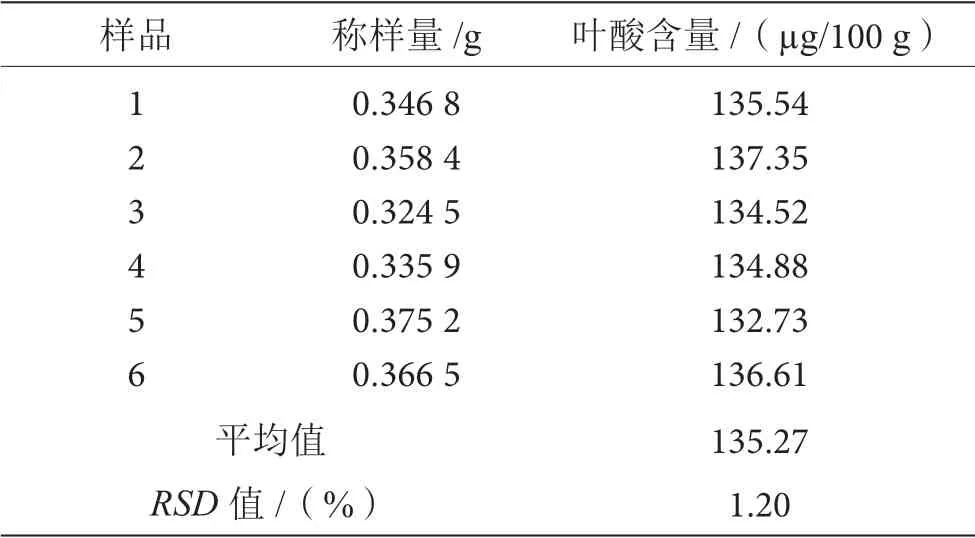
表4 重复性实验表
2.6 回收率实验
称取已测试的婴幼儿乳粉样品6份,分别加入叶酸标准储备液0.5 mL、0.5 mL、1.0 mL、1.0 mL、 2.0 mL和2.0 mL。经实验测定其回收率分别为92.3%、 91.6%、94.2%、95.1%、102.8%和99.3%,平均回收率为95.9%,从而可以看出此优化方法可以满足检测需求。
3 结论
本研究方法在培养基配制时,通过对培养基加热煮沸后增加过滤的步骤,以此来减少培养基中杂质对标准曲线的影响;在灭菌时相对于国标中的灭菌时间15 min,此方法优化成5 min,以此来减少培养基因长时间的高温加热而引起颜色加深对标准曲线的影响;对于国标中的20~40 h的培养时间,通过对接种量和培养时间的多次对比情况,培养时间优化为30 h左右的标准曲线相关线性较为满意。微生物法测定乳粉中叶酸的含量,其因受到人员、设备、实验环境、实验方法等多方面的影响,所以对实验室和实验人员的素质都有较高的要求。而经过优化的方法,通过对各检验步骤的详细整理和阐述,能够为初次运用微生物法进行叶酸检测检验人员提供可靠的理论和操 作参考。
