灵芝子实体不同提取物对小鼠睡眠改善作用的比较
2021-09-14叶辉宇李强明张玉英杨思林罗建平
叶辉宇,李强明,张玉英,杨思林,刘 健,罗建平,*
(1.合肥工业大学食品与生物工程学院,安徽合肥 230601;2.安徽省华信生物药业股份有限公司,安徽界首 236500)
睡眠障碍是影响人体身心健康的严重问题,据调查,我国约有16.8%的人患有失眠症状[1]。长期失眠不仅影响生活质量,使患者健忘、注意力不能集中等,而且会导致认知功能障碍[2−3],增加心血管疾病和抑郁症的患病风险[4−6]。当前临床治疗睡眠障碍的药物主要为苯二氮卓受体激动剂,但长时间服用会产生药物成瘾、认知功能损伤等危害[7−9]。传统中药具有副作用小的特点,利用中药改善睡眠在我国已有数千年历史,如酸枣仁汤、归脾汤等[10]。但中药化学成分复杂多样,改善睡眠的有效成分及药理作用途径不明确,因此限制了对中药改善睡眠效果的改进及相关产品开发。随着药食同源理念逐渐深入人心,从传统中药中开发改善睡眠相关的功能性食品的研究愈加受到关注。灵芝(Ganoderma lucidumKarst)为多孔菌科灵芝属真菌,药用历史悠久,具有安神宁心功效,常用于失眠的改善和治疗。《神农本草经》记载灵芝可“补肝气,安精魂”[11]。《中华人民共和国药典》2020 版记载灵芝具有“补气安神”功效,主治“心神不宁,失眠心悸”[12]。目前国内以灵芝为主要原料的保健食品已达到1270 余种[13],但以改善睡眠为主要功效的种类较少,且灵芝中改善睡眠的有效成分尚不明确,因此,明确灵芝中改善睡眠的有效成分对于开发改善睡眠的功能性食品具有重要意义。
灵芝富含三萜、多糖等活性化学成分[14]。现代药理研究表明,灵芝具有抗氧化、抗肿瘤、抗衰老和降血脂等功能[15−16]。近年来研究发现灵芝水提物可通过增加小鼠脑内GABA、5-HT 的含量来发挥镇静催眠作用[17],以灵芝为原料制成的中成药——灵芝糖浆能改善神经衰弱造成的失眠,有良好的养心安神功效[18]。灵芝提取溶剂不同,则提取物中化学成分不同,且已有研究因动物模型、使用的生药剂量及提取物剂量等的差异,难以对灵芝不同提取物的改善睡眠功效进行科学评价。本研究将采用相同动物模型,使用相同的生药剂量评价灵芝醇提物、水提物和多糖的改善睡眠作用,以期为合理开发灵芝改善睡眠的功能性食品提供依据。
1 材料与方法
1.1 材料与仪器
灵芝子实体 金寨县利民生物科技股份有限公司;SPF 级雄性ICR 小鼠(240 只,(18±2) g) 济南朋悦实验动物繁育有限公司提供,许可证号SCXK(鲁)2014-0007;罗通定片 四川迪菲特药业有限公司;戊巴比妥钠、巴比妥钠 北京华业寰宇化工有限公司;BCA 蛋白浓度测定试剂盒 北京兰杰柯科技有限公司公司;γ-氨基丁酸(γ-aminobutyric acid, GABA)、5-羟色胺(5-hydroxytryptamine, 5-HT)、多巴胺(Dopamine, DA)、酶联免疫吸附(enzyme-linked immunosorbent assay, Elisa)试剂盒上海泽叶生物科技有限公司;羧甲基纤维素钠、95%乙醇 国药集团化学试剂有限公司。
W501 升降恒温水浴锅 申胜生物技术有限公司;DGF30/7-I 电热鼓风干燥箱 南京实验仪器厂;Hei-VAP Advantage 旋转蒸发仪 德国Heidolph 公司;FD-1A-50 冷冻干燥机 北京博医康实验仪器有限公司;CT15RT 高速冷冻离心机 上海天美科学仪器有限公司;AL104 分析天平 美国梅特勒托利多公司;MDF-U73V 超低温冰箱 日本SANYO 公司;MLS-3750 高压蒸汽灭菌锅 日本三洋电器株式会社。
1.2 实验方法
1.2.1 灵芝子实体提取物的制备
1.2.1.1 灵芝子实体水提物的制备 称取灵芝子实体干粉适量,按照料液比1:30(g/mL)加入去离子水,90 ℃水浴浸提2 h,浸提2 次后将滤液65 ℃减压浓缩至一定体积后冷冻干燥得到灵芝子实体水提物(提取率为5.14%)[19]。
1.2.1.2 灵芝子实体醇提物的制备 称取灵芝子实体干粉适量,按照料液比1:30(g/mL)加入95%乙醇,60 ℃水浴浸提2 h,浸提2 次,药渣置于烘箱60℃干燥备用,醇提液65 ℃减压浓缩至一定体积后烘干得到灵芝子实体醇提物(提取率为4.18%)[20]。
1.2.1.3 灵芝子实体多糖的制备 称取制备灵芝子实体醇提物后干药渣适量,按照料液比1:30(g/mL)加入去离子水,90 ℃水浴浸提2 h,浸提2 次后将滤液65 ℃减压浓缩至一定体积,用终浓度为80%的乙醇进行醇沉,4 ℃下静置24 h 后抽滤,沉淀冷冻干燥得到灵芝子实体多糖(提取率为1.06%)[21]。
1.2.2 动物分组 240 只ICR 小鼠饲养于SPF 级动物房(温度(24±20) ℃,相对湿度50%~60%,明暗交替12 h),适应性饲养1 周后随机分为3 个批次(n=80),第1 批进行直接睡眠实验和延长戊巴比妥钠睡眠实验,第2 批进行戊巴比妥钠阈下剂量催眠实验,第3 批进行巴比妥钠睡眠潜伏期实验。每批小鼠分为8 组(n=10),分别为正常对照组、阳性对照组、灵芝子实体水提物高剂量组(GLW-H)和低剂量组(GLW-L)、灵芝子实体醇提物高剂量组(GLE-H)和低剂量组(GLE-L)以及灵芝子实体多糖高剂量组(GLP-H)和低剂量组(GLP-L)。以《中华人民共和国药典》2020 版中灵芝子实体的人体(60 kg)推荐摄入量(6~12 g/d)中值(9 g/d)的10 倍、20 倍为依据[15],结合灵芝子实体不同提取物的提取率,确定灵芝子实体水提物低、高剂量组给药浓度为77.1 mg/kg和154.2 mg/kg,醇提物低、高剂量组给药浓度为62.7 mg/kg 和125.4 mg/kg,多糖低、高剂量组给药浓度为15.9 mg/kg 和31.8 mg/kg。灵芝子实体不同提取物和阳性对照组药物(罗通定片,15 mg/kg)溶剂为0.5%羧甲基纤维素钠溶液[22],按照10 mL/kg 剂量灌胃小鼠,正常对照组每日灌胃等量0.5%羧甲基纤维素钠溶液,连续灌胃30 d。
1.2.3 小鼠体重增长、脏器指数测定 第1 批小鼠实验开始和结束时称量小鼠体重,观察各组小鼠实验前后体重变化。体重增长计算公式:体重增长=小鼠灌胃第30 d 体重-小鼠灌胃第1 d 体重;第1 批小鼠实验结束后,二氧化碳处死小鼠(处死前1 d 禁食不禁水),取小鼠肝、肺、脾、肾和胸腺并称重。小鼠脏器指数计算公式:脏器指数=脏器重量(mg)/小鼠体重(g)。
1.2.4 直接睡眠实验 灌胃1 h 内观察小鼠睡眠情况,以小鼠翻正反射消失1 min 为入睡指标,记录各组入睡动物数及睡眠时间,观察受试物对小鼠是否有直接睡眠作用[23]。
1.2.5 延长戊巴比妥钠睡眠时间实验 预实验确定小鼠戊巴比妥钠注射剂量为38 mg/kg。末次灌胃30 min 后,给小鼠腹腔注射戊巴比妥钠(剂量为38 mg/kg,注射量为0.2 mL/只小鼠),观察受试物能否延长小鼠睡眠时间以及各组小鼠睡眠时间的差异[23]。
1.2.6 戊巴比妥钠阈下剂量催眠实验 预实验确定小鼠戊巴比妥钠阈下剂量催眠剂量为24 mg/kg。末次灌胃 30 min 后,给各组小鼠腹腔注射戊巴比妥钠(剂量为24 mg/kg,注射量为0.2 mL/只小鼠),记录30 min 内各组入睡小鼠数量[23]。
1.2.7 巴比妥钠睡眠潜伏期实验 预实验确定小鼠巴比妥钠注射剂量为240 mg/kg。末次灌胃 30 min后,给各组小鼠腹腔注射巴比妥钠(剂量为240 mg/kg,注射量为0.2 mL/只小鼠),观察受试物能否缩短小鼠的睡眠潜伏期,比较各组小鼠入睡时间的差异[23]。
1.2.8 小鼠脑组织中GABA、5-HT 和DA 含量测定
第1 批小鼠实验结束后,二氧化碳处死小鼠(处死前1 d 禁食不禁水),迅速取出脑组织,称取一定脑组织于冰浴条件下用生理盐水制备10%脑组织匀浆液,离心后取上清液,用BCA 试剂盒进行蛋白质定量,然后按照ELISA 试剂盒说明书检测小鼠脑组织中GABA、5-HT 和DA 的含量。
1.3 数据处理
实验数据用SPSS20.0 软件统计分析,以均数±标准差(±sD)表示,应用LSD 检验各组实验数据间的显著性差异,采用Origin 2019 软件制图。
2 结果与分析
2.1 灵芝子实体不同提取物对小鼠体重和脏器指数的影响
由表1 可知,给药组小鼠与正常对照组小鼠体重增长无显著性差异(P>0.05),即灵芝子实体提取物对小鼠的体重无影响;给药组小鼠与正常对照组小鼠肝、肺、脾、肾和胸腺的脏器指数均无统计学差异(P>0.05),表明灵芝子实体提取物对小鼠脏器无毒害作用。
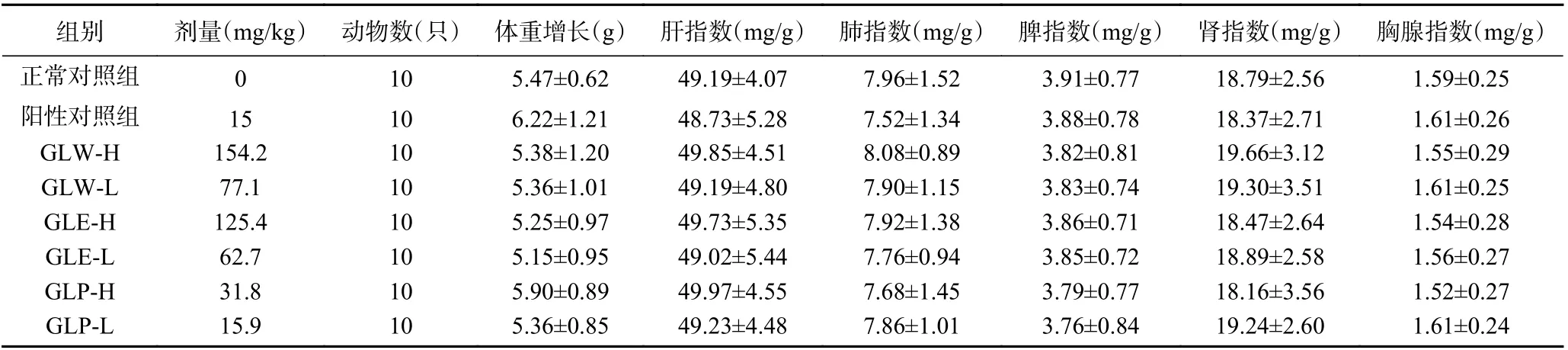
表1 灵芝子实体不同提取物对小鼠体重和脏器指数的影响Table 1 Effects of different extracts from Ganoderma lucidum fruit bodies on body weight and viscera index of mice
2.2 灵芝子实体不同提取物对小鼠直接睡眠的影响
观察各组小鼠灌胃60 min 内的活动情况。由表2 可知,各组小鼠活动正常,均无出现翻正消失,即灵芝子实体提取物对小鼠无直接催眠作用。
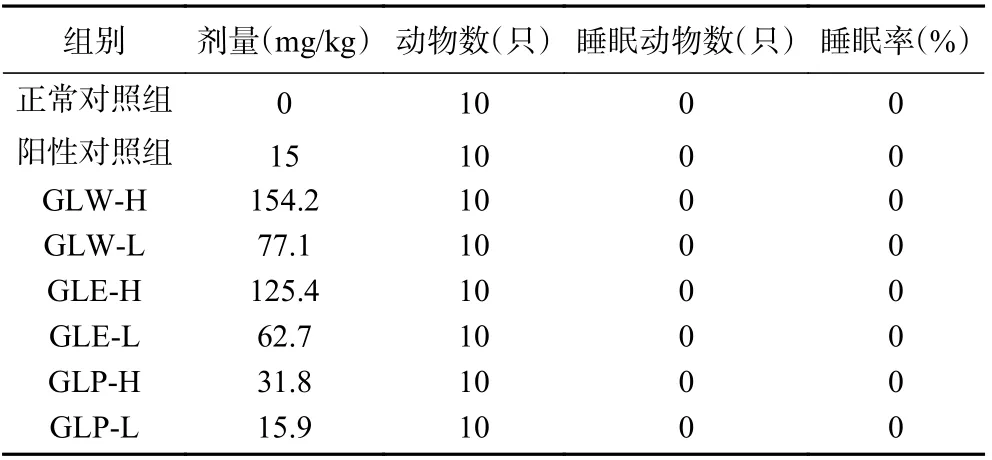
表2 灵芝子实体不同提取物对小鼠直接睡眠作用Table 2 Effects of different extracts from Ganoderma lucidum fruit bodies on the direct sleep of mice
2.3 灵芝子实体不同提取物对小鼠戊巴比妥钠睡眠时间的影响
末次灌胃30 min 后,各组小鼠腹腔注射戊巴比妥钠(剂量为38 mg/kg,注射量为0.2 mL/只小鼠),观察小鼠睡眠状态。由图1 可知,阳性对照组较正

图1 灵芝子实体不同提取物对小鼠延长戊巴比妥钠睡眠时间的影响Fig.1 Effects of different extracts from Ganoderma lucidum fruit bodies on duration of sodium pentobarbital-induced sleep of mice
常对照组能显著延长小鼠睡眠时间(P<0.05),睡眠时间延长了56.02%。灵芝子实体水提物、醇提物、多糖均能不同程度的延长小鼠睡眠时间,且睡眠延长时间与剂量呈正相关;与正常对照组比较,GLW-H、GLW-L、GLE-H、GLE-L、GLP-H 组均能显著延长小鼠睡眠时间(P<0.05),分别延长了29.01%、18.96%、44.57%、23.90%和21.51%。三种提取物高剂量组之间小鼠睡眠时间比较:GLE-H 组较GLW-H 与GLP-H 组睡眠时间显著提高(P<0.05);GLW-H 与GLP-H 虽无显著性差异(P>0.05),但GLW-H 组小鼠睡眠时间整体上较GLP-H 组有延长的趋势。
2.4 灵芝子实体不同提取物对小鼠戊巴比妥钠阈下剂量催眠的影响
末次灌胃30 min 后,各组小鼠腹腔注射戊巴比妥钠(剂量为24 mg/kg,注射量为0.2 mL/只小鼠),观察30 min 内各组入睡小鼠的数量。由表3 可知,阳性对照组睡眠率为70%,较正常对照组有显著提高(P<0.05);与正常对照组比较,GLE-H 组睡眠率为60%,能显著提高小鼠睡眠率(P<0.05),虽GLWH、GLW-L、GLE-L、GLP-H 组均能提高小鼠的睡眠率,但是并不具有显著性差异(P>0.05)。
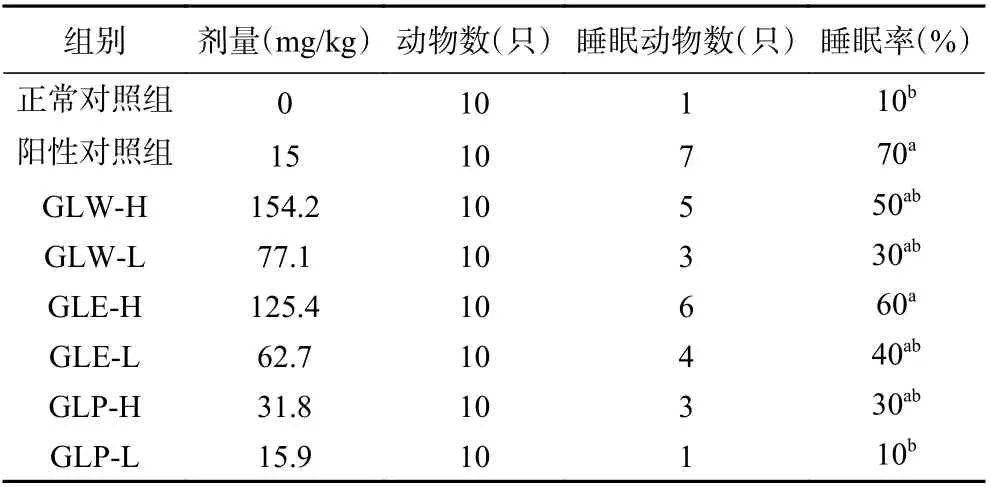
表3 灵芝不同提取物对小鼠戊巴比妥钠阈下剂量催眠实验睡眠发生率的影响Table 3 Effects of different extracts from Ganoderma lucidum fruit bodies on the sleep rate of pentobarbital sodium subthreshold hypnotic experiment of mice
2.5 灵芝子实体不同提取物对小鼠巴比妥钠睡眠潜伏期的影响
末次灌胃30 min 后,各组小鼠腹腔注射巴比妥钠(剂量为240 mg/kg,注射量为0.2 mL/只小鼠),观察小鼠的入睡时间。由图2 可知,阳性对照组较正常对照组小鼠睡眠潜伏期显著缩短了45.03%(P<0.05),灵芝子实体水提物、醇提物、多糖均能不同程度的缩短小鼠睡眠潜伏期,且有一定的量效关系;与正常对照组比较,GLW-H、GLW-L、GLE-H、GLE-L、GLP-H 组均能显著缩短小鼠睡眠潜伏期(P<0.05),分别缩短了24.87%、12.82%、31.92%、20.25%和17.67%。三种提取物高剂量组间小鼠睡眠潜伏期相比较:GLE-H 组小鼠睡眠潜伏期显著短于 GLP-H 组(P<0.05) ; GLW-H 组 较 GLE-H 与GLP-H 组睡眠潜伏期均无显著性差异(P>0.05),但通过比较睡眠潜伏期长短,发现降低小鼠巴比妥钠睡眠潜伏期的趋势为:GLE-H>GLW-H>GLP-H。

图2 灵芝子实体不同提取物对小鼠巴比妥钠睡眠潜伏期的影响Fig.2 Effects of different extracts from Ganoderma lucidum fruit bodies on latency of barbital sodium-induced sleep of mice
2.6 灵芝子实体不同提取物对小鼠脑组织中GABA、5-HT 和DA 含量的影响
由图3 可知,阳性对照组较正常对照组小鼠脑组织中GABA、5-HT 含量显著升高(P<0.05),分别增加了60.11%和51.48%;GLW-H、GLE-H、GLEL、GLP-H 组小鼠脑组织中GABA、5-HT 含量均有不同程度增加升高(P<0.05)。与正常对照组比较,GLW-H、GLE-H、GLE-L、GLP-H 组小鼠脑组织中GABA 含量分别增加了27.82%、41.53%、24.22%和21.54%,5-HT 含量分别增加了24.14%、33.11%、16.87%和16.77%。阳性对照组较正常对照组小鼠脑组织中DA 含量显著下降(P<0.05),但灵芝子实体提取物各组与正常对照组小鼠脑组织中的DA 含量均无显著性差异(P>0.05)。三种提取物高剂量组小鼠脑组织中GABA、5-HT 含量相比较:GLE-H 组较GLP-H 组显著升高(P<0.05);GLW-H 较GLEH 与GLP-H 无显著性差异(P>0.05),但通过比较GABA、5-HT 含量,发现提升小鼠脑内GLW-H 组小鼠脑内GABA、5-HT 含量的趋势为:GLE-H>GLW-H>GLP-H。

图3 灵芝子实体不同提取物对小鼠脑组织中GABA、5-HT 和DA 含量的影响Fig.3 Effects of different extracts from Ganoderma lucidum fruit bodies on contents of GABA, 5-HT and DA in brain tissue of mice
3 讨论与结论
近年来探讨中药对睡眠的研究越来越受到人们的重视,如五味子、黄精、巴戟天通过调节脑中GABA、5-HT 含量改善小鼠睡眠[24−26]。灵芝多糖可能通过上调大鼠血清和脑组织中TNF-α含量从而增加了非快速眼动睡眠时长[27],灵芝孢子粉和三萜和多糖也有一定的改善睡眠作用[28−29],但是并没有对灵芝子实体不同提取物在同一生药剂量下进行系统性评价。
研究发现,神经递质与睡眠的关系密不可分。GABA 是中枢神经系统中的抑制性神经递质,通过与受体GABAA、GABAB受体结合起到镇静、抗焦虑的作用,是临床上用于治疗失眠症的部分药物的目标靶点[30−31]。哺乳动物脑组织中5-HT 主要存在于中缝背核中,可调节睡眠-觉醒电路,其含量增加可抑制中枢神经系统兴奋,起到促进睡眠的作用[32−33]。DA 在人体中起着情绪调节、睡眠觉醒等作用[34−35],现代临床常用DA 受体拮抗剂作为镇静剂[36]。因此脑组织中GABA、5-HT 和DA 含量的变化对睡眠具有重要影响。
本实验结果表明灵芝子实体不同提取物对小鼠体重增长、脏器指数无明显影响,且无直接睡眠作用(P>0.05)。因灵芝子实体不同提取物的主要成分不同,故对小鼠改善睡眠的效果不一致。从延长戊巴比妥钠睡眠时间实验、降低巴比妥钠睡眠潜伏期实验结果 发现GLW-H、GLW-L、GLE-H、GLE-L 与GLP-H 都呈阳性,但具有一定差异,其改善睡眠功效总体趋势为: GLE-H>GLW-H>GLE-L>GLP-H>GLW-L。可见,灵芝子实体提取物的高剂量组改善睡眠效果均优于相同提取物的低剂量组,且在相同生药剂量下改善睡眠功效总体趋势为灵芝子实体醇提物最佳,水提物次之,随后是灵芝子实体多糖。本研究中灵芝子实体醇提物主要成分为灵芝三萜,水提物中包含灵芝多糖和灵芝酸等成分,灵芝酸属于灵芝三萜类物质,预计灵芝三萜发挥主要的改善睡眠功效。灵芝三萜在体外实验中被证明与GABAA受体具有一定强度亲和力,可能通过GABAA受体增强GABA 能神经元从而改善睡眠[37]。俞盈等[38]研究结果表明,100 mg/kg 的灵芝三萜酸促睡眠效果强于阳性药地西泮(2.5 mg /kg),说明灵芝三萜酸具有显著的改善睡眠的作用。为了探究灵芝子实体提取物改善睡眠的作用机制,检测了小鼠脑组织中GABA、5-HT 与DA 的含量,发现GLW-H、GLE-H、GLE-L和GLP-H 组对小鼠脑内DA 含量无显著影响(P>0.05),但能显著提升GABA、5-HT 含量(P<0.05),其中GLE-H 对小鼠脑内GABA 和5-HT 含量提升效果最佳。
综上所述,灵芝子实体水提物、醇提物和多糖均具有一定的改善睡眠作用,在相同生药剂量下总体趋势为:灵芝子实体醇提物>灵芝子实体水提物>灵芝子实体多糖,其改善睡眠作用可能与上调小鼠脑内GABA、5-HT 含量有关。有研究表明灵芝多糖可过增强大鼠脑内GABA 能神经元和5-HT 能神经元,增加了非快速眼动睡眠期间δ波时长起到改善睡眠的作用[39]。本研究中灵芝子实体多糖对小鼠睡眠的改善同样具有一定的统计学意义,未来将对灵芝三萜和灵芝子实体多糖关于改善睡眠是否具有协同作用进行深入研究。
