兔颈动脉血流灌注减少促进血管内皮细胞炎性反应
2021-09-13李秀毛黄仁杰
生 燕,李秀毛,郭 欣,谢 仟,黄仁杰,生 欣
(遵义医科大学 基础医学院 1.形态学实验室; 3.生物化学教研室,贵州 遵义 563000;2.遵义医科大学附属医院 胸心外科, 贵州 遵义 563000)
动脉粥样硬化(atherosclerosis,AS)是一种慢性炎性疾病,炎性反应在其发生、发展过程中发挥重要作用[1]。大量研究显示血流灌注减少导致的血液流速降低能够重排内皮细胞骨架进而诱发内皮细胞炎性反应[2-3]。然而,其调控机制还不清楚。平面细胞极性信号通路是调节细胞极性的重要通路[4],不仅与内皮细胞的炎性密切相关[5],且其核心蛋白凡客蛋白(Van Gogh protein, VANGL2)和蓬乱蛋白(dishevelled,DVL2)等还能够介导微管等细胞骨架动力学变化。然而,这两种蛋白是否参与了血流灌注减少诱导的内皮细胞骨架重排还未见报道。本课题组在细胞水平的研究显示两者在不同流速的血流作用下差异表达,本研究进一步在动物水平上探索其与内皮细胞炎性反应以及细胞骨架重排之间的关系,为探究血流灌注改变导致血管炎性反应的机制提供新的资料。
1 材料与方法
1.1 材料
1.1.1 动物:SPF级的新西兰兔15只,2月龄,体质量(2.0±0.2)kg(重庆医科大学实验动物中心[许可证号:SCXK(渝)2018-2003])。
1.1.2 试剂:GAPDH 抗体、DVL2 抗体、γ-tubulin抗体、MCP-1 抗体、BBS8 抗体、 VANGL2 抗体以及羊抗兔二抗、兔抗小鼠二抗和兔抗羊二抗等(Proteintech公司);BCA定量试剂盒、蛋白上样缓冲液、Tween-20、PMSF(100 mmol/L)(上海碧云天生物技术有限公司);PBS干粉、SDS-PAGE配胶试剂盒、高效Ripa组织/细胞快速裂解液、glycine/SDS/Tris(SoLarbio公司);PCR引物(上海生工生物工程公司合成);CLarityTMWestern ECL Substrate(Bio-Rad公司)。
1.2 方法
1.2.1 兔的分组及处理:将兔分为对照组、套管组(参考文献[5]的方法行左侧颈动脉套管术建立兔颈动脉狭窄模型,喂以正常饲料)、高脂组(喂以高脂饲料,成分为:5%猪大油、1%白糖、2%胆固醇、0.12%丙基硫氧嘧啶、1%维生素D、0.125%硫酸亚铁)。
1.2.2 组织的取材:普通饲料适应性饲养1周,以手术后为时间起点,继续喂养9周后,取套管远侧颈总动脉血管,置于-80 ℃备用。
1.2.3 HE染色检测内膜:组织经4%多聚甲醛固定后,常规石蜡包埋,4 μm切片;二甲苯与梯度乙醇脱蜡。苏木精染色5 min,自来水冲洗;盐酸乙醇分化30 s后自来水浸泡15 min;伊红液染色2 min;梯度乙醇与二甲苯脱水,透明,中性树胶封片。
1.2.4 免疫组化观察目的蛋白的定位:参照免疫组化试剂盒说明,切片分别置于二甲苯与梯度乙醇进行脱蜡,在柠檬酸溶液中高压煮沸两次,6 min/次。冷却后, TBST溶液冲洗3次,每次3 min。3%的H2O2溶液中避光封闭过氧化物酶15 min。PBS溶液冲洗3次,每次3 min。100 μL的小鼠免疫蛋白A封闭10 min后甩干。一抗(1∶1 000)10 μL 4 ℃过夜孵育。室温复温20 min后, TBST溶液冲洗5 min 3次。试剂B 100 μL 37 ℃孵育20 min,PBS冲洗3次,每次3 min。试剂C 100 μL 37 ℃ 酶联孵育10 min。PBS冲洗3次,每次3 min。DAB显色试剂孵育10 min,纯水冲洗5 min。苏木精复染1 min后水冲5 min。1%盐酸乙醇分化数秒后水冲3 min,梯度乙醇与二甲苯脱水,中性材料树胶封片。
1.2.5 实时荧光定量PCR检测目的基因的表达:于液氮中磨碎颈总动脉,加入1 mL Trizol裂解液,形成匀浆,参照试剂盒说明进行总RNA提取,微量核酸蛋白定量仪检测RNA浓度与纯度,-20 ℃储存用于荧光定量PCR实验。按照反转录试剂盒说明进行反转录,获得的cDNA加入至20 μL反应体系中, 以GAPDH做内参。反转录反应条件为:37 ℃ 15 min,85 ℃ 5 s,4 ℃;荧光定量反应条件为:95 ℃ 3 min,95 ℃ 10 s,60 ℃ 30 s,40个循环;65 ℃ 5 s,95 ℃ 5 min。目的基因的相对表达量通过公式2-△△Ct进行相对定量分析计算。目的基因引物设计(表1)。

表1 Real-time PCR所用引物的序列Table 1 Sequence of primers used in real-time PCR
1.2.6 Western blot检测目的蛋白的表达:组织于液氮中研磨至粉末状,分装离心管内并做好标记。加入100 μL裂解液后,振荡30 min,5 min/次,4 ℃,1 200 r/min离心20 min,取上清液,16倍稀释后BCA法测蛋白浓度,按照浓度补加裂解液,再以1∶4比例加入上样缓冲液(×5),沸水浴10 min后做好标记置于-2 ℃储存。
制备凝胶,Marker(蛋白标准)上样量4 μg,蛋白样品上样量10 μg,上样顺序从左至右分别为Marker、正常样品、高脂组样品、套管组样品、Marker。SDS-PAGE电泳后,低温200 mA电转120 min,PVDF膜常温下封闭2 h,TBST洗涤6次,每次5 min。一抗4 ℃过夜孵育,其中,GAPDH 抗体(1∶5 000),DVL2 抗体(1∶1 000),γ-tubulin抗体(1∶1 000),MCP-1 抗体(1∶1 000), BBS8 抗体(1∶1 000),VANGL2 抗体(1∶1 000)。TBST洗涤6次,每次5 min。二抗常温下孵育2 h,其中,羊抗兔IgG(1∶1 000);羊抗小鼠IgG(1∶1 000);兔抗羊IgG(1∶1 000)。TBST洗涤6次,每次5 min。ECL曝光显影,采用Image LabTM软件对蛋白显影图像吸光度值进行分析。目的蛋白相对表达量=目的蛋白吸光度值/内参蛋白GAPDH吸光度值。
1.3 统计学分析
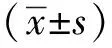
2 结果
2.1 组织形态学观察和平面细胞极性信号通路核心蛋白DVL2与VANGL2的表达定位
与对照组相比(图1A)高脂组胞质分布散在,血管壁完整且轻微增厚,内膜边界清晰(图1B);而套管组胞质分布不均匀,血管壁完整且明显增厚,内膜增生更为严重(图1C),与对照组相比,套管组内膜与中膜的比值I/M显著增加(图1D)。DVL2,VANGL2蛋白的阳性产物主要定位于内膜,对照组无棕黄阳性颗粒(图2A,A’),而高脂组与套管组胞质均有棕黄阳性颗粒,且两组阳性颗粒均主要定位于内膜增生处(图2B,C,B’,C’)。更为重要的是,套管组内膜增生处的阳性颗粒远远多于高脂组。相比,VANGL2来说,DVL2的表达量更多(图2C,C’,D)。
A-C. HE staining; D.area of intima-to-media; I/M.(intima-to-media ratio) between each group; *P<0.01 compared with control group; scale bar=200 μm; the arrows indicate intimal hyperplasia

A-C.histological localization of DVL2; A’-C’.histological localization of VANGL2; D.DVL2 and VANGL2 expression in each group;bar=200 μm; *P<0.01 compared with high-fat group; #P<0.01 compared with VANGL2 in cannula
2.2 Real-time PCR检测VANGL2、DVL2、γ-tubulin、MCP-1 mRNA表达
高脂组MCP-1 mRNA表达与对照组无明显差异,高脂组γ-tubulin与VANGL2 mRNA的表达较对照组上调(P<0.05),而套管组DVL2、VANGL2、γ-tubulin、MCP-1 mRNA的表达较对照组明显上调(P<0.01)(图3,表1)。
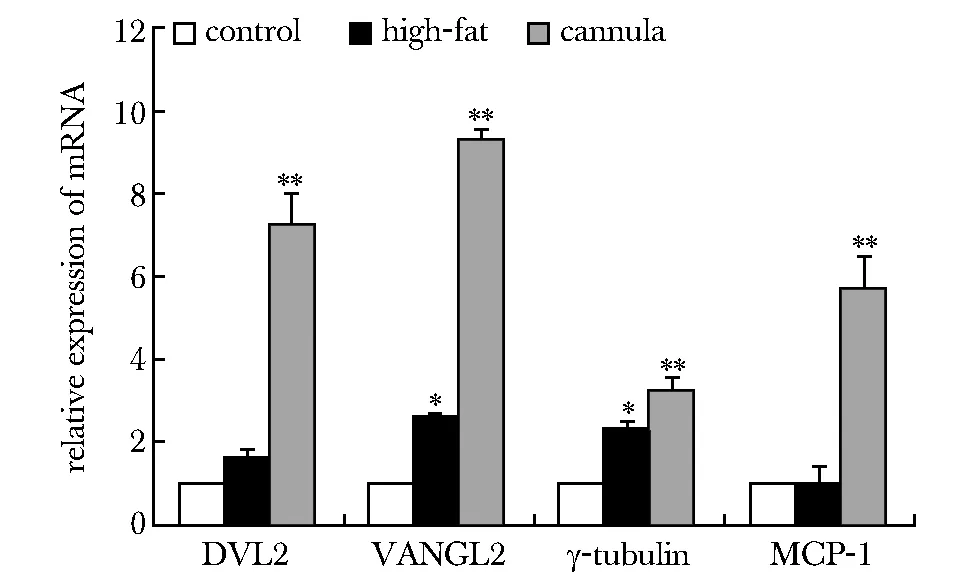
*P<0.05, **P<0.01 compared with control group图3 各组蛋白 mRNA的相对表达量Fig 3 Relative expression of mRNA in each group
2.3 Western blot检测各组血管中DVL2、VANGL2、BBS8、γ-tubulin与 MCP-1的蛋白表达的影响
高脂和套管组的组织中的MCP-1蛋白表达均高于对照组(P<0.05),且呈递增趋势。此外,平面细胞极性信号通路核心蛋白DVL2与VANGL2,微管组织中心蛋白BBS8,γ-tubulin在套管组的表达也较对照组上调,与MCP-1呈现同步改变(图4)。
3 讨论
在心血管系统中,血管分支和弯曲等部位由于血流灌注减少导致血液流速降低,成为AS发生的高风险区域,即AS发生具有局灶性特征[6]。尽管血流灌注减少作为AS发生的风险因素已经受到了广泛的认同,但其导致AS血管重建的分子机制仍未阐明。课题组前期对不同流速的血流加载的血管内皮细胞进行转录组测序和GO富集分析发现差异表达的基因主要富集到炎性反应等通路, 提示血流灌注减少能够导致血管内皮细胞炎性反应。在本研究中,通过构建兔颈动脉狭窄模型导致血流灌注减少,结果显示,高脂饮食和颈动脉狭窄模型动脉中MCP-1表达均高于正常动脉,且动脉狭窄模型中表达最高,表明MCP-1在两种不同因素导致AS过程中均发挥了作用,且其对于血液流速变化更为敏感。鉴于大量的研究证实MCP-1可通过多种途径直接参与或影响动脉粥样硬化慢性炎性反应的多个病理过程[7-9],因此推测MCP-1参与了动脉狭窄导致的血管炎性反应。
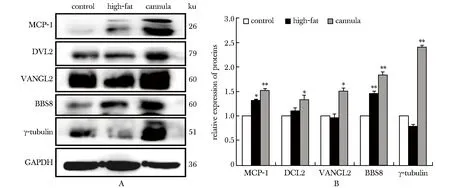
A.immunoblotting images of proteins in each group; B.relative expression of proteins in each group; *P<0.05,**P<0.01 compared with control group
研究显示血流灌注减少导致的血液流速降低能够导致内皮细胞呈现梭型,并发生微丝与微管的重排[10-11]。本研究结果发现作为微管组织中心蛋白的BBS8、γ-tubulin在套管导致的狭窄血管中高表达,且较高脂组和对照组均差异显著。表明血流灌注减少变化通过调控微管组织中心蛋白改变微管的重排,从而调控细胞结构的变化,最终参与了AS的发生过程,因此,也可能参与了血管灌注减少诱导的血管重建过程。由于平面细胞极性信号通路与AS的发生相关[12]。本研究显示血液流速的改变不但会导致血管内膜增厚,还会影响该通路的核心蛋白DVL2和VANGL2的表达。形态学与分子生物学检测均显示DVL2及VANGL2的在套管组中显著上调,表明平面细胞极性信号通路通过其核心蛋白DVL2和VANGL2参与了血流灌注减少导致的AS发生。此外,越来越多的研究显示,细胞骨架的重排与平面细胞极性信号通路密切相关[13-14],而课题组前期结果显示在细胞水平上分别干扰DVL2和VANGL2的表达能够抑制低切应力上调的BBS8和γ-tubulin的表达[15],表明血流灌注减少通过DVL2和VANGL2调控微管骨架的重排。
此外,尽管血流灌注变化与高脂血症均是导致AS发生的风险因素,但两者在AS发生过程中的主次要作用关系还未见报道。在本研究中,尽管高脂组各项指标较对照组有所增加,但较套管组,其变化甚微。可能的原因在于,相比血流灌注减少导致的血管内皮细胞急性炎性反应,高脂血症在此过程中的作用可能为长期的慢性的炎性反应过程,因此,在AS发生早期,血流灌注改变导致的炎性反应更为明显。
综上所述,低切应力作用能够通过诱导血管MCP-1的上调参与AS早期发生发展,并通过DVL2与VANGL2微管组织中心蛋白BBS8和γ-tubulin调控微管类细胞骨架的重排。
