异化铁还原菌介导的硝酸盐还原亚铁氧化过程
2021-09-10张相杰陈国俊李涵李芳柏刘同旭
张相杰 陈国俊 李涵 李芳柏 刘同旭

摘 要:中性厌氧的富铁环境中,微生物驱动硝酸盐还原亚铁氧化(NRFO)过程和异化铁还原过程,然而异化铁还原菌能否介导NRFO仍未知。选取异化铁还原菌(Klebsiella pneumoniae L17、Shewanella oneidensis MR-1、Shewanella putrefaciens strain CN32)、亚铁和硝酸盐,构建厌氧NRFO体系。结果表明:亚铁氧化、硝酸盐还原同步发生,主要是因为硝酸盐还原产物亚硝酸盐可以直接氧化亚铁;亚铁抑制了硝酸盐还原,且该抑制作用随亚铁浓度升高而增强;亚铁对亚硝酸盐的竞争性还原导致了铵根大量减少;亚铁氧化生成的次生矿物沉淀在细胞表面,阻碍硝酸盐进入细胞进行还原。在低浓度亚铁条件下,亚铁的毒害和氧化成矿作用抑制L17还原硝酸盐;亚铁氧化成矿作用是抑制CN32还原硝酸盐的主要原因;而亞铁的毒害是抑制MR-1还原硝酸盐的主要原因。在高浓度亚铁条件下,亚铁氧化导致细胞结壳是抑制微生物硝酸盐还原的主要原因。
关键词:硝酸盐还原亚铁氧化;铁还原微生物;亚铁氧化成矿;细胞结壳
Abstract: Microbially-mediated nitrate-reducing Fe(Ⅱ) oxidation (NRFO)process and alienated iron reduction process are ubiquitous under neutral anaerobic iron-rich environments. However, it is still unknown whether NRFO can be mediated by dissimilatory iron reducing bacteria. In this study, anaerobic NRFO system is constructed by selecting dissimilatory iron-reducing bacteria(Klebsiella pneumoniae L17, Shewanella oneidensis MR-1, and Shewanella putrefaciens strain CN32), ferrous and nitrate. The results show that nitrate reduction and Fe(Ⅱ) oxidation occurred simultaneously. The intermediate product nitrite during nitrate reduction is considered the dominant contributor to the overall Fe(Ⅱ) oxidation. The presence of Fe(Ⅱ) inhibited microbial nitrate reduction, and the inhibitory effect of Fe(Ⅱ) was more significant with the higher Fe(Ⅱ) concentration.Competitive reduction of nitrite by Fe(Ⅱ)resulted in the decrease of ammonium production. Fe(Ⅱ) oxidized secondary minerals precipitated on the cell surface,hindering nitrate from entering the cell for reduction. The toxicity and oxidation-mineralization of Fe(Ⅱ) inhibited nitrate reduction by L17 with low Fe(Ⅱ) concentration. Nitrate reduction by CN32 was inhibited by Fe(Ⅱ) oxidation-mineralization, while the inhibition of nitrate reduction by MR-1 was attributed to toxicity of Fe(Ⅱ).Under high Fe(Ⅱ) concentration, microbial nitrate reduction was inhibited by cell encrustation.
Keywords: nitrate-reducing Fe(Ⅱ) oxidation; iron-reducing bacteria; Fe(Ⅱ) oxidation-mineralization; cell encrustation
铁是地壳中第四丰富的元素,也是生物圈中最普遍存在的氧化还原活性金属[1]。铁长期以来被认为是生命所必须的,铁氧化菌(FeOB)与铁还原菌(FeRB)驱动了铁的生物地球化学循环。铁循环过程控制着土壤有机物矿化、甲烷排放、重金属的吸附固定、反硝化等环境过程,是连接土壤养分循环与污染物转化的纽带,是推动物质循环与能量代谢的重要引擎[2-6]。氮是核苷酸和氨基酸的基本组成元素,是构成生命的基本元素,从根本上影响着大多数生态系统的结构和功能[7]。硝酸盐作为氮循环网络的关键节点,在自然界氮循环过程中起着至关重要的作用。在农业生产中,氮素的输入至关重要,而微生物的反硝化作用会导致氮素的大量流失[8]。微生物通过反硝化过程、异化硝酸盐还原成铵、厌氧氨氧化竞争性还原硝酸盐[9]。硝酸盐还原的产物N2O作为重要的温室气体,超过60%的排放来自农业土壤,而土壤中超过2/3的N2O排放可归因于细菌和真菌生物与非生物反硝化过程共同作用的结果[10-11]。因此,微生物驱动的硝酸盐还原过程对元素地球化学循环、农业生产、温室气体排放等方面具有重要意义。
在厌氧环境中,微生物通过生物与非生物作用耦合铁氮循环普遍存在,是铁、氮氧化还原反应中的重要过程[12]。1996年首次报道微生物介导的硝酸盐还原亚铁氧化过程(NRFO)[13],在此后的二十多年里,人们证明了NRFO过程在土壤中、海洋、温泉、地下水、深海、湿地沉积物和海底热液喷口等环境中普遍存在[14-19];甚至在火星也可能存在潜在的NRFO过程[20]。在厌氧条件下,NRFO微生物将硝酸盐作为电子受体,将Fe(Ⅱ)作为唯一或者辅助电子供体进行生命代谢活动,同时硝酸盐还原的中间产物亚硝酸盐通过化学反硝化作用氧化Fe(Ⅱ)[12, 21-22]。
由于中性厌氧环境微生物活动的复杂性、物质循环活动的广泛性以及元素之间的耦合过程,单独的微生物种群进行完全的反硝化过程不普遍,大量微生物种群只参与一个或者几个NO-X还原反应,这些微生物通常缺乏将硝酸盐还原为氮气的完整途径基因组[8, 23]。目前主要是通过NRFO微生物这种模式菌研究硝酸盐还原亚铁氧化过程,例如Pseudogulbenkiania sp. strain 2002、Acidovorax sp. strain BoFeN1[21, 24-26]。实际上,很多微生物具备将硝酸盐还原为亚硝酸盐,进而非生物氧化Fe(Ⅱ)的能力。因此,反硝化微生物(非模式菌)能够驱动NRFO过程[27]。大量铁还原微生物具有参与硝酸盐还原过程的酶,并能够进行硝酸盐还原,铁还原微生物是氮循环的重要参与者[28]。目前,研究者陆续从多种环境中分离出大量铁还原微生物,如深海沉积物、铜矿、海底热泉、森林沉积物和油田等环境,这些微生物能够利用硝酸盐作为电子受体进行硝酸盐还原。
[29-33]。目前的研究表明,Fe(Ⅲ)和硝酸盐能够作为铁还原微生物的电子受体进行竞争性还原,而且硝酸盐的浓度影响微生物铁还原速率[34-37]。然而,对于铁还原微生物驱动的硝酸盐还原亚铁氧化过程需要进一步研究。
铁还原微生物驱动NRFO过程中,亚硝酸盐和亚铁发生化学反硝化生成N2O排放到大气中,并造成厌氧环境中的氮损耗。因此,铁还原菌驱动的NRFO过程对于研究微观尺度温室气体排放具有重要的意义[38-41]。以往对模式菌驱动NRFO过程的研究表明,亚铁的存在促进了Acidovorax sp. BoFeN1硝酸盐还原,但抑制了Pseudogulbenkiania sp. strain 2002硝酸盐还原,不同微生物生成的次生矿物类型也存在差别,说明不同的NRFO微生物对亚铁的响应不同[42]。因此,不同铁还原微生物驱动的硝酸盐还原亚铁氧化过程反应动力学和矿物学有可能也存在明显区别。不同铁还原微生物硝酸盐还原过程相关酶促反应不同。研究表明,Shewanella loihica strain PV-4硝酸盐还原过程中,能够通过亚硝酸盐还原酶NirK将亚硝酸盐还原为N2O,也能够通过亚硝酸盐异化还原成铵酶NrfA,将亚硝酸盐还原为NH+4[43]。Shewanella putrefaciens MR-1硝酸盐还原过程中,通过硝酸盐还原酶Nap将硝酸盐还原为亚硝酸盐,然后通过亚硝酸盐异化还原为铵酶NrfA将亚硝酸盐还原为NH+4[44-45]。说明不同希瓦氏菌,其硝酸盐代谢酶促反应途径不同,有可能导致硝酸盐还原亚铁氧化动力学和矿物学的区别。
笔者选取发酵型和呼吸型两种铁还原菌作为模式菌株,研究其驱动NRFO过程。设置不同铁还原微生物驱动NRFO过程的对照实验,对反应物和生成物反應动力学进行分析,对不同处理组的次生矿物进行对比,研究目的包括:探究不同类型铁还原菌、硝酸盐还原菌的NRFO过程动力学和矿物学差异,揭示铁还原菌驱动的NRFO过程的反应机制和影响因素。该研究可拓展NRFO过程的微生物范畴,揭示厌氧环境微生物驱动的NRFO过程中的微生物功能与贡献。
1 实验
1.1 实验材料
实验采用的微生物为发酵型兼性厌氧铁还原菌Klebsiella pneumoniae L17[46]、呼吸型兼性厌氧铁还原菌Shewanella oneidensis MR-1[47],来自海洋微生物菌种保藏管理中心(Marine Culture Collection of China, MCCC);呼吸型兼性厌氧铁还原菌Shewanella putrefaciens strain CN32[48],来自广东省微生物菌种保藏中心(Guangdong Microbial Culture Collection Center, GDMCC)。好氧培养基成分为NaCl 5 g/L、牛肉浸膏5 g/L、蛋白胨10 g/L,pH值调至7.0,并对培养基进行高温高压灭菌处理。将-80 ℃冰箱中保存的微生物(1 mL)取出解冻后,在超净工作台倒入好氧培养基中,在恒温震荡培养箱中活化培养14 h (30 ℃,180 r/min),然后放置在超净工作台,取1 mL菌液转接到好氧培养基中,在恒温震荡培养箱中继续培养14 h (30 ℃,180 r/min)。对100 mL西林瓶、纯水用100% N2充气30 min排氧,并高温高压灭菌,然后在厌氧工作站中配制亚铁母液(FeSO4 1 mol/L),用橡胶塞压紧并用铝盖进一步密封,平衡24 h后,用0.22 μm滤头过滤并进行避光保存。配制葡萄糖母液(1 mol/L)、乳酸盐母液(1 mol/L),并用0.22 μm滤头过滤,然后用100% N2充气30 min排氧。微量元素储备液SL14和维生素储备液V10的具体配方参考文献[49],用0.22 μm滤头过滤之后,再用100% N2充气30 min排氧。配制30 mmol/L的哌嗪-1,4-二乙磺酸(PIPES)作为洗菌和实验体系的缓冲液(pH=7.0)。
1.2 实验方案及测试方法
1.2.1 实验方案 在体系厌氧培养实验前,对要用到的所有的容器耗材和溶液进行高温高压灭菌。在超净工作台上取微生物悬液,经8 000 r/min于4 ℃离心8 min后,用30 mmol/L PIPES(pH=7.0)缓冲液洗涤重悬浮,重复3次后,配成菌悬液(OD600=1.0),在超净工作台上用100% N2充气30 min,排氧,用橡胶塞压紧并迅速用铝盖密封待用。30 mmol/L PIPES、5 mmol/L NaNO3分装于100 mL西林瓶中,100% N2充气30 min,排氧后进行高温高压灭菌,冷却至室温后转移到厌氧工作站中,根据不同处理组(处理组见表1)配制反应体系,反应体系溶液总体积为80 mL,包括:4 mL已制备的菌悬液、5 mmol/L NO-3、10 mmol/L碳源、微量元素10 mL/L、维生素10 mL/L、5 mmol/L (1 mmol/L)FeSO4、30 mmol/L PIPES。反应体系在生化培养箱中(30±0.5 ℃) 避光静置培养,每隔一段时间进行取样,并测定反应物、生成物浓度。
1.2.2 测试分析方法
实验采取连续性取样,每次取样1.5 mL,迅速进行Fe(Ⅱ)的测定。采用邻菲罗啉显色法进行亚铁的测定,使用酶标仪测定在波长510 nm处吸光值。然后将样品充氧气15 min,充分氧化样品中的Fe(Ⅱ),用0.22 μm滤头过滤保存于-20 ℃。取样完成后,用配备离子色谱柱(IonPacAS14A 4×250 mm)的离子色谱仪(Dionex ICS-90)测定其中的NO-3、NO-2浓度,采用连续流动分析仪测定NH+4。使用X射线衍射仪(D2 phaser)(Co靶、衍射角10°~80°、扫描速度0.2 (°)/min)测定生成矿物晶体结构,使用扫描电子显微镜观察微生物和矿物形貌。
2 实验结果与讨论
2.1 硝酸盐还原动力学
不同亚铁浓度条件下,3种异化铁还原菌的硝酸盐还原动力学曲线见图1,3种异化铁还原菌的硝酸盐还原准一级速率常数见表2。结果表明,不加亚铁情况下,L17和CN32体系的硝酸盐在1.6 d时被完全还原,硝酸盐还原的准一级速率常数分别为1.772、1.672/d(表2),说明L17和CN32的硝酸还原能力接近。MR-1体系与L17和CN32不同,在0~16 h硝酸盐迅速还原,在16~64 h硝酸盐还原速率变慢,在第3天,硝酸盐被完全还原。硝酸盐还原准一级速率常数0.674/d,显著低于L17和CN32。分别在体系中添加1、5 mmol/L亚铁,结果显示,硝酸盐的还原均受到显著抑制。亚铁为1 mmol/L条件下,微生物硝酸盐还原速率明显高于高浓度亚铁条件,反应在第7天已达到稳定,L17菌在第7天将硝酸盐完全还原;CN32体系的硝酸盐在第4天基本被还原;说明低浓度亚铁抑制了L17、CN-32硝酸盐还原速率,但硝酸盐最终能被完全还原。在MR-1体系,初始阶段硝酸盐还原速率较快,之后迅速达到平衡,硝酸盐被还原30%,说明低浓度亚铁显著的抑制了MR-1硝酸盐还原过程。综上所述,在低濃度亚铁条件下,微生物硝酸盐还原速率为CN32(0.563/d)>L17 (0.179/d)>MR-1 (0.034/d)。在高浓度5 mmol/L亚铁条件下,L17处理组仅仅有0.7 mmol/L硝酸盐被还原,CN32处理组在反应12 d后,1 mmol/L硝酸盐被还原,MR-1处理组在反应12 d后,1.6 mmol/L硝酸盐被还原,其准一级速率常数分别为0.010/d、0.014/d、0.010/d,显著低于1 mmol/L亚铁处理以及不加亚铁的处理。3种菌在高浓度亚铁条件下,反应前期少量的硝酸盐被还原,之后硝酸盐还原过程停滞,表明了高浓度亚铁对微生物硝酸盐还原具有显著的抑制作用。综上所述,亚铁的添加抑制了微生物硝酸盐还原过程,而随着亚铁浓度的升高,对微生物还原硝酸盐的抑制作用增强,亚铁对不同类型铁还原微生物硝酸盐还原的抑制程度存在差异。
2.2 亚硝酸盐和铵根生成动力学
实验选取的铁还原微生物硝酸盐代谢途径存在差异,亚硝酸盐是铁还原微生物还原硝酸盐的次级产物。L17不仅能将硝酸盐还原为N2O和NO,也能够还原为NH+4[30]。CN32还原硝酸盐的产物为N2O和NO,MR-1还原硝酸盐的产物为NH+4[45]。亚硝酸盐、铵根的生成动力学结果如图2所示。对于生物处理组cell+NO-3,L17在第1.5天的亚硝酸盐积累达到4.8 mmol/L,随后被持续还原,在第12天亚硝酸盐剩余1.7 mmol/L。铵根作为L17还原亚硝酸盐的产物,在第0~5天生成速率较慢,在第12天积累量为1.4 mmol/L。对于cell+NO-3+ Fe2+处理组,加入1 mmol/L亚铁后,亚硝酸盐持续生成并在第7天积累量为4 mmol/L。添加5 mmol/L亚铁条件下,亚硝酸盐在第2.6天积累量达到最大0.74 mmol/L;亚铁的添加抑制了铵根的生成,在1 mmol/L亚铁条件下铵根的最高生成量仅仅0.09 mmol/L,而5 mmol/L亚铁条件下未发现铵根的生成。图2(b)结果表明,CN32生物处理组在反应第2天亚硝酸盐生成量达到最高,之后还原速率减慢,亚硝酸盐在第12天仅仅被还原9.8%,说明CN32硝酸盐还原速率显著高于亚硝酸盐还原速率。低浓度亚铁条件下,CN32亚硝酸盐在第4天生成量达到最高4.6 mmol/L,之后亚硝酸盐被持续还原。而高浓度亚铁浓度显著的抑制了CN32亚硝酸盐的生成,其亚硝酸盐最高生成量为0.91 mmol/L。CN32处理组未发现铵根的生成。图2(c)结果表明,MR-1迅速还原硝酸盐,导致了亚硝酸盐大量积累,在16 h亚硝酸盐积累量达到3.98 mmol/L,之后被持续还原。研究表明,亚硝酸盐的添加抑制了MR-1的生长,证明亚硝酸盐对MR-1代谢活动的抑制作用[44]。因此,高浓度的亚硝酸盐积累抑制了MR-1的硝酸盐还原过程。铵根在第12天积累量达到3.97 mmol/L,表明亚硝酸盐基本上被异化还原为铵。而含有亚铁的处理组中,亚硝酸盐的积累量为1 mmol/L左右。在低浓度亚铁条件下,铵根的最大生成量为0.23 mmol/L;而在高浓度亚铁条件下,没有发现铵根的生成,说明亚铁显著抑制了亚硝酸盐异化还原为铵。上述结果表明,3种微生物处理组中,亚铁的添加减少了亚硝酸的积累,一方面是因为亚铁抑制了微生物硝酸盐还原成亚硝酸盐,另一方面是因为亚铁与亚硝酸盐化学反硝化作用消耗了一部分亚硝酸盐[38, 42, 50]。亚铁抑制了L17和MR-1铵根的生成,随着亚铁浓度的升高,微生物硝酸盐异化还原为铵越少,原因是NRFO过程中,亚硝酸盐一方面被微生物还原,另一方面被亚铁化学反硝化过程还原。相比于亚硝酸盐的生物还原过程,亚硝酸盐和亚铁之间化学反应相对较快[51]。这导致了亚铁添加条件下铵根生成量远远小于生物处理组铵根生成量。
2.3 亚铁氧化动力学
亚铁氧化动力学如图3所示。在未添加硝酸盐的条件下,L17、CN32和MR-1均不能生物氧化亚铁;而加入硝酸盐后,在1、5 mmol/L Fe2+的体系中均发生了氧化,在厌氧无催化剂存在的条件下,亚铁和硝酸盐不能直接发生化学反应[31, 51]。说明铁还原条件下的亚铁氧化是由硝酸盐还原导致的。对于1 mmol/L Fe2+,在L17体系中,亚铁在第4天接近完全氧化; CN32体系亚铁完全氧化耗时6 d;MR-1体系中,直到第7天亚铁仅氧化14.4%。其准一级速率常数分别为L17 (0.066/d)、CN32 (0.051/d)、MR-1 (0.034/d) (表2)。在5 mmol/L Fe2+条件下,第12天L17、CN32、MR-1体系中分别有57.1%、51.4%、34.1%的亚铁发生氧化,其准一级速率常数分别为L17 (0.066/d)、CN32 (0.051/d)、MR-1 (0.034/d)。上述结果表明,3种铁还原菌的亚铁氧化速率为L17>CN32>MR-1,亚铁氧化速率不同的原因是,不同微生物的硝酸盐还原速率的差异以及代谢途径的不同。在L17和CN32体系中,高浓度亚铁不完全氧化,但低浓度亚铁可以完全氧化;MR-1在不同的亚铁浓度下均表现为亚铁的不完全氧化。
2.4 次生矿物表征
亚硝酸盐与亚铁化学反硝化作用生成的次生矿物分为3部分,一部分沉淀于细胞周围环境(绿色箭头所示),一部分粘附在细胞表面但结合并不紧密(蓝色箭头所示);一部分沉淀生成在细胞表面或者外膜,形成细胞结壳(红色箭头所示)。如图4所示。
在Fe2+浓度为5 mmol/L的条件下,次生矿物大量附着在细胞表面,3种微生物均发生了明显的细胞结壳,导致在高浓度亚铁条件下硝酸盐还原速率远远低于低浓度亚铁浓度。在Fe2+浓度为1 mmol/L条件下,如图5所示。
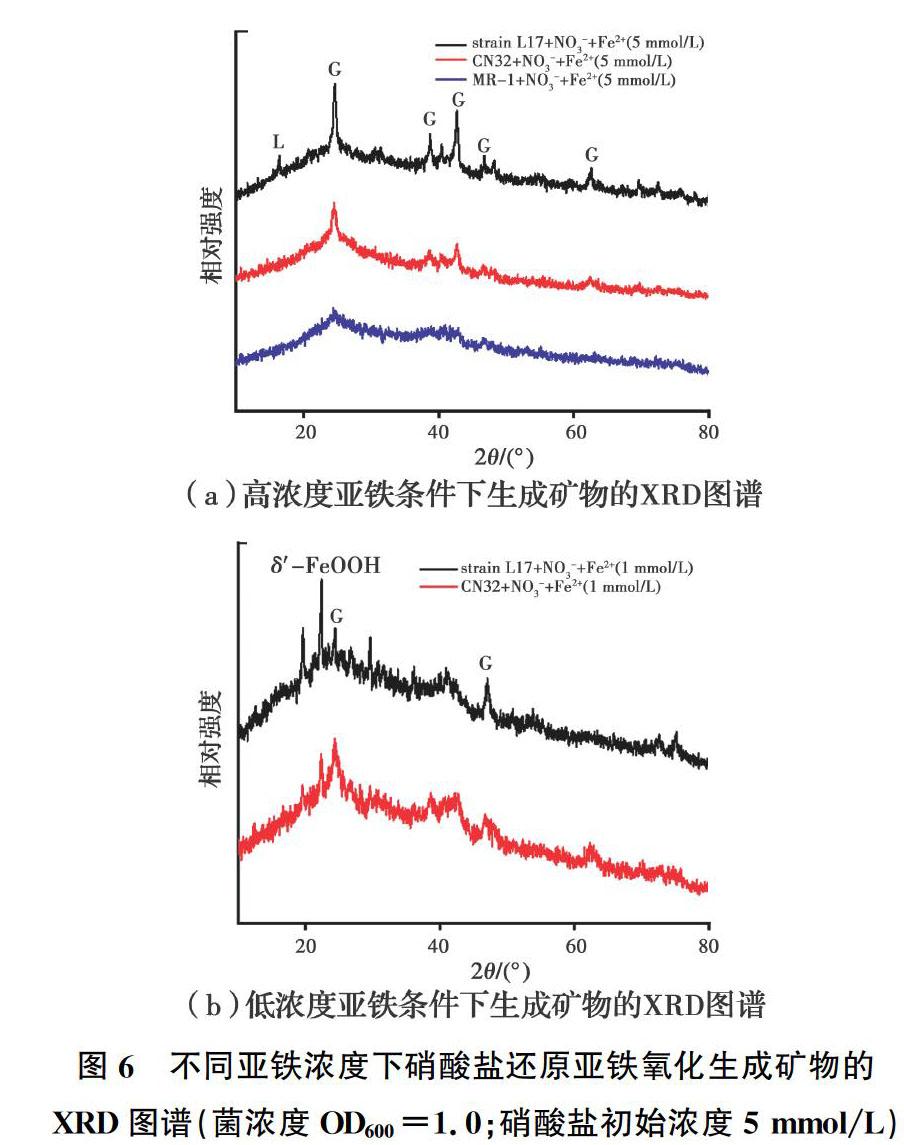
L17和CN32亚铁氧化生成铁氧化物并沉淀在细胞表面,会阻碍硝酸盐进入细胞周质进行还原。然而,大部分微生物没有结壳,所以,在反应后期,硝酸盐仍然能被完全还原;而且L17细胞表面沉淀的次生矿物明显多于CN32,导致L17硝酸盐还原速率明显低于CN32。低浓度亚铁条件下,MR-1處理组亚铁几乎没有被氧化,所以,未收集到次生矿物,这可能是因为亚铁的添加导致了细胞活性降低,从而抑制了硝酸盐还原过程。同时,对次生矿物类型进行了XRD表征,如图6所示,结果表明,在高浓度亚铁条件下,3种铁还原微生物处理组生成的结晶态矿物主要为针铁矿。亚铁与亚硝酸盐化学反应生成的铁氧化物主要为针铁矿和纤铁矿[50]。在低浓度亚铁条件下,生成的铁氧化物除了针铁矿之外,还生成了结晶度较差的水铁矿,说明亚铁氧化成矿的结晶度与亚铁浓度正相关。
综上所述,亚铁氧化成矿并附着在细胞表面,能影响微生物硝酸盐还原。随着亚铁浓度的提高,细胞结壳逐渐增加,次生矿物结晶度提高,阻碍硝酸盐进入细胞周质进行还原,导致了硝酸盐还原速率明显降低甚至完全停滞,从而抑制了微生物的代谢活动[52]。
2.5 反应机制与环境意义
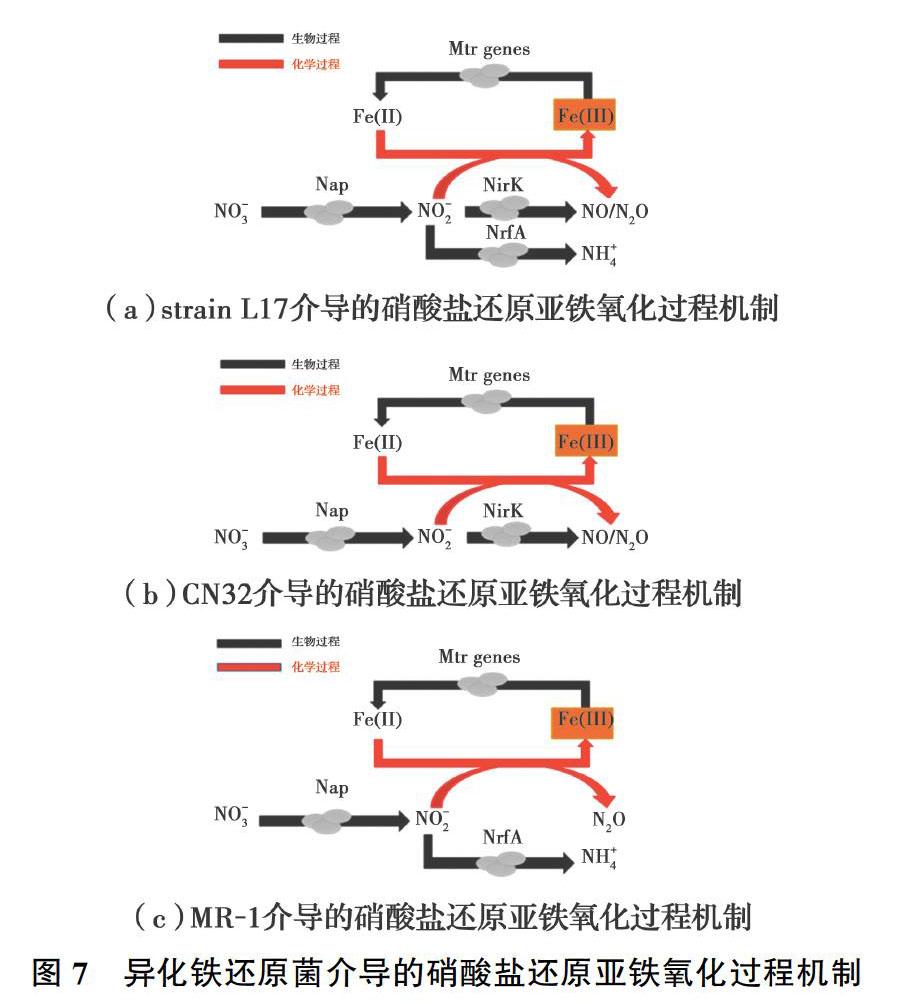
大量的异化铁还原菌具有还原硝酸盐的功能[31, 34, 43, 53-55]。在厌氧富铁环境中,微生物还原硝酸盐的中间产物NO-2一方面与亚铁发生化学反硝化,另一方面亚硝酸盐被微生物还原,亚硝酸盐还原产物为NO和N2O,亚铁氧化形成铁氧化物并沉淀在细胞表面[36, 56]。然而,微生物不能将亚铁作为电子供体进行氧化。不同异化铁还原菌介导的硝酸盐还原-亚铁氧化过程机制存在差异,由动力学结果和矿物学表征的结果分析得到3种异化铁还原菌的反应机制,如图7所示。L17菌介导的硝酸盐还原亚铁氧化过程机制如图7(a)所示,硝酸盐进入细胞周质被硝酸盐还原酶(Nap)还原为亚硝酸盐,亚硝酸盐有3种代谢途径,一方面能够被亚硝酸盐还原酶(NirK和NrfA)还原为N2O和NH+4,另一方面被亚铁化学还原。CN32菌介导的硝酸盐还原亚铁氧化过程机制如图7(b)所示,硝酸盐进入细胞周质被硝酸盐还原酶(Nap)还原为亚硝酸盐,亚硝酸盐有两种代谢途径,一方面能够被亚硝酸盐还原酶(NirK)还原,另一方面被亚铁化学还原。MR-1菌介导的硝酸盐还原亚铁氧化过程机制如图7(c)所示,硝酸盐进入细胞周质被硝酸盐还原酶(Nap)还原为亚硝酸盐,亚硝酸盐通过生物与非生物共同作用被还原,微生物还原亚硝酸盐(NrfA途径)的产物只有NH+4,另一方面亚硝酸盐被化学还原为N2O。亚铁氧化生成铁氧化物,铁氧化物能够被铁还原菌还原。以往研究表明,即使是较小浓度亚铁也会抑制微生物的NO-X还原[36]。所以,铁还原菌硝酸盐还原途径和对亚铁毒害响应的差异,导致了硝酸盐还原和亚铁氧化速率的明显差异。亚铁竞争性还原亚硝酸盐抑制了NH+4的生成,促进了N2O的生成。亚铁氧化形成的铁氧化物沉淀在细胞表面,阻碍了硝酸盐进入细胞被还原,抑制了微生物硝酸盐还原过程,亚硝酸盐生成的减少进一步影响了亚铁氧化速率。随着亚铁浓度的提高,亚铁氧化速率升高并导致细胞结壳,硝酸盐无法进入细胞被还原,导致硝酸盐还原亚铁氧化过程停滞。亚铁氧化主要生成的是针铁矿,随着亚铁浓度的提高,铁矿的结晶度也越高。
铁还原菌还原铁主要通过3种途径:铁还原菌与铁氧化物直接接触;细胞分泌胞外螯合物提高铁矿物溶解性,促进铁还原过程;细胞分泌或者利用周围环境的电子穿梭体,通过胞外电子传递过程进行铁还原[57]。铁还原菌介导的Fe-N循环已有报道,铁氧化物作为电子受体被微生物还原为亚铁,亚铁被亚硝酸盐化学氧化,生成的铁氧化物仍然能够作为铁还原菌的电子受体被还原,实现铁的氧化还原循环。对于亚硝酸盐来说,一方面被亚铁化学还原,另一方面能够作为微生物的电子受体,被生物还原[58-59]。说明铁还原菌介导的铁氧化还原循环和硝酸盐的持续还原理论上可行。但研究当中没有发现明显的铁还原过程,其主要原因可能是:1)细胞结壳一方面限制微生物的运动、生长和营养物的摄入,导致微生物铁还原相关酶活性的降低,阻碍铁还原菌胞外电子传递。另一方面微生物不能有效地利用细胞表面铁氧化物作为电子受体[36, 60]。2)硝酸盐还原过程抑制了铁还原过程。目前的研究表明,细胞色素CymA能够参与多种电子受体的还原过程,微生物更倾向于利用硝酸盐作为电子受体,所以硝酸盐还原CymA的电子传递过程可能导致铁还原速率的减慢,表现为硝酸盐和铁的竞争性还原[44, 61]。3)由于较高浓度亚硝酸盐的存在,导致铁还原生成亚铁发生再氧化。4)体系残留的亚铁吸附在铁氧化物表面,导致铁活性的降低,微生物无法进行生物铁还原过程。
研究表明,厭氧环境中多种微生物群落参与NRFO过程[62]。本研究强调了在厌氧富铁环境中非模式菌驱动的NRFO过程,表明在厌氧环境中NRFO过程并不是单一微生物驱动的,非亚铁氧化功能菌也能够驱动NRFO过程。在低氮肥施加水稻土和厌氧沉积物中,微生物硝酸盐异化还原为铵(DNRA)在硝酸盐代谢途径中占有主导地位[63-64]。铁还原菌DNRA生成铵根,然后被植物或者其他微生物吸收利用,有利于厌氧环境氮沉积和再循环。厌氧富铁环境中亚铁显著抑制微生物DNRA过程,亚铁竞争性还原亚硝酸盐导致微生物产铵的大量减少,生成的NO和N2O释放到大气中,造成厌氧环境中氮损耗[39]。细胞结壳阻碍硝酸盐等电子受体进入细胞还原,导致硝酸盐的不完全还原,同时限制微生物的运动、生长、营养物质摄入[60]。该研究表明,细胞结壳抑制了异化铁还原菌介导的NRFO过程,细胞结壳对不同铁还原菌的抑制机制不同。本工作丰富了硝酸盐还原亚铁氧化的研究思路,加深了对微生物驱动的NRFO反应机制的理解。
3 结论
铁还原菌能够通过硝酸盐还原的中间产物亚硝酸盐与亚铁的化学反硝化作用实现亚铁氧化过程。亚铁抑制了微生物硝酸盐还原、亚硝酸盐和铵根的生成。低浓度亚铁条件下,亚铁降低了L17和CN32硝酸盐还原速率,而亚铁完全抑制了MR-1硝酸盐还原,其抑制顺序为MR-1>L17>CN32。亚铁严重抑制了硝酸盐异化还原成铵过程。在高浓度亚铁条件下,亚铁氧化成矿明显抑制了微生物硝酸盐还原过程。在低浓度亚铁条件下,对于L17和CN32来说,亚铁氧化生成的铁氧化物抑制了微生物的硝酸盐还原,但大部分微生物没有完全结壳,所以,硝酸盐最终能被完全还原,且CN32硝酸盐还原速率明显高于L17。亚铁毒害作用抑制了L17硝酸盐还原过程,也是影响MR-1硝酸盐还原的主要原因。随着亚铁浓度的升高,微生物细胞结壳程度越高,细胞的完全结壳是硝酸盐还原停滞的主要原因。本研究拓展了硝酸盐还原亚铁氧化过程的微生物类型,加深了对微生物介导的硝酸盐还原亚铁氧化的理解,对研究微生物介导的铁-氮循环过程具有重要的意义。
参考文献:
[1] KAPPLER A. Geomicrobiological cycling of iron [J]. Reviews in Mineralogy and Geochemistry, 2005, 59(1): 85-108.
[2] BORCH T, KRETZSCHMAR R, KAPPLER A, et al. Biogeochemical redox processes and their impact on contaminant dynamics [J]. Environmental Science & Technology, 2010, 44(1): 15-23.
[3] RODEN E E, WETZEL R G. Kinetics of microbial Fe(Ⅲ) oxide reduction in freshwater wetland sediments [J]. Limnology and Oceanography, 2002, 47(1): 198-211.
[4] WEBER K A, ACHENBACH L A, COATES J D. Microorganisms pumping iron: Anaerobic microbial iron oxidation and reduction [J]. Nature Reviews Microbiology, 2006, 4(10): 752-764.
[5] KENDALL B, ANBAR A D, KAPPLER A, et al. The global iron cycle[M]//Fundamentals of Geobiology. Chichester, UK: John Wiley & Sons, Ltd, 2012: 65-92.
[6] 胡敏, 李芳柏. 土壤微生物铁循环及其环境意义[J]. 土壤学报, 2014, 51(4): 683-698.
HU M, LI F B. Soil microbe mediated iron cycling and its environmental implication [J]. Acta Pedologica Sinica, 2014, 51(4): 683-698. (in Chinese)
[7] ROBERTSON G P, VITOUSEK P M. Nitrogen in agriculture: Balancing the cost of an essential resource [J]. Annual Review of Environment and Resources, 2009, 34(1): 97-125.
[8] KUYPERS M M M, MARCHANT H K, KARTAL B. The microbial nitrogen-cycling network [J]. Nature Reviews Microbiology, 2018, 16(5): 263-276.
[9] KRAFT B, STROUS M, TEGETMEYER H E. Microbial nitrate respiration-Genes, enzymes and environmental distribution [J]. Journal of Biotechnology, 2011, 155(1): 104-117.
[10] TORRES M J, SIMON J, ROWLEY G, et al. Nitrous oxide metabolism in nitrate-reducing bacteria: Physiology and regulatory mechanisms [J]. Advances in Microbial Physiology, 2016, 68: 353-432.
[11] ZHU-BARKER X, CAVAZOS A R, OSTROM N E, et al. The importance of abiotic reactions for nitrous oxide production [J]. Biogeochemistry, 2015, 126(3): 251-267.
[12] WANG X N, SUN G X, ZHU Y G. Thermodynamic energy of anaerobic microbial redox reactions couples elemental biogeochemical cycles [J]. Journal of Soils and Sediments, 2017, 17(12): 2831-2846.
[13] STRAUB K L, BENZ M, SCHINK B, et al. Anaerobic, nitrate-dependent microbial oxidation of ferrous iron [J]. Applied and Environmental Microbiology, 1996, 62(4): 1458-1460.
[14] LI X M, ZHANG W, LIU T X, et al. Changes in the composition and diversity of microbial communities during anaerobic nitrate reduction and Fe(Ⅱ) oxidation at circumneutral pH in paddy soil [J]. Soil Biology and Biochemistry, 2016, 94: 70-79.
[15] HAFENBRADL D, KELLER M, DIRMEIER R, et al.Ferroglobus placidus gen. nov., sp. nov., a novel hyperthermophilic archaeum that oxidizes Fe2+ at neutral pH under anoxic conditions [J]. Archives of Microbiology, 1996, 166(5): 308-314.
[16] EMERSON D. Biogeochemistry and microbiology of microaerobic Fe(Ⅱ) oxidation [J]. Biochemical Society Transactions, 2012, 40(6): 1211-1216.
[17] SOROKINA A Y, CHERNOUSOVA E Y, DUBININA G A.Hoeflea siderophila sp. nov., a new neutrophilic iron-oxidizing bacterium [J]. Microbiology, 2012, 81(1): 59-66.
[18] MICHIELS C C, DARCHAMBEAU F, ROLAND F A E, et al. Iron-dependent nitrogen cycling in a ferruginous lake and the nutrient status of proterozoic oceans [J]. Nature Geoscience, 2017, 10(3): 217-221.
[19] WANG H B, HU C, HAN L C, et al. Effects of microbial cycling of Fe(Ⅱ)/Fe(Ⅲ) and Fe/N on cast iron corrosion in simulated drinking water distribution systems [J]. Corrosion Science, 2015, 100: 599-606.
[20] PRICE A, PEARSON V K, SCHWENZER S P, et al. Nitrate-dependent iron oxidation: A potential Mars metabolism [J]. Frontiers in Microbiology, 2018, 9: 513.
[21] CHEN D D, LIU T X, LI X M, et al. Biological and chemical processes of microbially mediated nitrate-reducing Fe(Ⅱ) oxidation by Pseudogulbenkiania sp. strain 2002 [J]. Chemical Geology, 2018, 476: 59-69.
[22] BRYCE C, BLACKWELL N, SCHMIDT C, et al. Microbial anaerobic Fe(Ⅱ) oxidation-Ecology, mechanisms and environmental implications [J]. Environmental Microbiology, 2018, 20(10): 3462-3483.
[23] ZHU Y G, DUAN G L, CHEN B D, et al. Mineral weathering and element cycling in soil-microorganism-plant system [J]. Science China Earth Sciences, 2014, 57(5): 888-896.
[24] ZHAO L D, DONG H L, KUKKADAPU R, et al. Biological oxidation of Fe(Ⅱ) in reduced nontronite coupled with nitrate reduction by Pseudogulbenkiania sp. Strain 2002 [J]. Geochimica et Cosmochimica Acta, 2013, 119: 231-247.
[25] PANTKE C, OBST M, BENZERARA K, et al. Green rust formation during Fe(Ⅱ) oxidation by the nitrate-reducing Acidovorax sp. strain BoFeN1 [J]. Environmental Science & Technology, 2012, 46(3): 1439-1446.
[26] KAPPLER A, SCHINK B, NEWMAN D K. Fe(Ⅲ) mineral formation and cell encrustation by the nitrate-dependent Fe(Ⅱ)-oxidizer strain BoFeN1 [J]. Geobiology, 2005, 3(4): 235-245.
[27] LIU T X, CHEN D D, LI X M, et al. Microbially mediated coupling of nitrate reduction and Fe(Ⅱ) oxidation under anoxic conditions [J]. FEMS Microbiology Ecology, 2019, 95(4): fiz030.
[28] 黎慧娟, 彭靜静. 异化Fe(Ⅲ)还原微生物研究进展[J]. 生态学报, 2012, 32(5): 1633-1642.
LI H J, PENG J J. Recent advances in studies on dissimilatory Fe(Ⅲ)-reducing microorganisms [J]. Acta Ecologica Sinica, 2012, 32(5): 1633-1642. (in Chinese)
[29] DEMEY L M, MILLER C R, MANZELLA M P, et al. The draft genome of the hyperthermophilic archaeon Pyrodictium delaneyi strain hulk, an iron and nitrate reducer, reveals the capacity for sulfate reduction [J]. Standards in Genomic Sciences, 2017, 12: 47.
[30] LIU T X, LI X M, ZHANG W, et al. Fe(Ⅲ) oxides accelerate microbial nitrate reduction and electricity generation by Klebsiella pneumoniae L17 [J]. Journal of Colloid and Interface Science, 2014, 423: 25-32.
[31] ZHANG W, LI X M, LIU T X, et al. Competitive reduction of nitrate and iron oxides by Shewanella putrefaciens 200 under anoxic conditions [J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2014, 445: 97-104.
[32] CHEN Y, WANG F, XU J, et al. Physiological and evolutionary studies of NAP systems in Shewanella piezotolerans WP3 [J]. The ISME Journal, 2011, 5(5): 843-855.
[33] YAO D F, ZHANG X, WANG G W, et al. A novel parameter for evaluating the influence of iron oxide on themethanogenic process [J]. Biochemical Engineering Journal, 2017, 125: 144-150.
[34] LI B B, CHENG Y Y, WU C, et al. Interaction between ferrihydrite and nitrate respirations by Shewanella oneidensis MR-1 [J]. Process Biochemistry, 2015, 50(11): 1942-1946.
[35] ZHOU Z M, JING G H, ZHENG X J. Reduction of Fe(Ⅲ) EDTA by Klebsiella sp. strain FD-3 in NOx scrubber solutions [J]. Bioresource Technology, 2013, 132: 210-216.
[36] COBY A J, PICARDAL F W. Inhibition of NO-3 and NO-2 reduction by microbial Fe(Ⅲ) reduction: Evidence of a reaction between NO-2 and cell surface-bound Fe2+ [J]. Applied and Environmental Microbiology, 2005, 71(9): 5267-5274.
[37] LIU T X, ZHANG W, LI X M, et al. Kinetics of competitive reduction of nitrate and iron oxides by Aeromonas hydrophila HS01 [J]. Soil Science Society of America Journal, 2014, 78(6): 1903-1912.
[38] DHAKAL P. Abiotic nitrate and nitrite reactivity with iron oxide minerals [D]. South Limestone, Lexington: University of Kentucky, 2013.
[39] SAMARKIN V A, MADIGAN M T, BOWLES M W, et al. Abiotic nitrous oxide emission from the hypersaline Don Juan Pond in Antarctica [J]. Nature Geoscience, 2010, 3(5): 341-344.
[40] CHANGE I C. The physical science basis [M]. Cambridge University Press, 2007.
[41] LU Y S, HUANG X E, XU L, et al. Elucidation of the nitrogen-transformation mechanism for nitrite removal using a microbial-mediated iron redox cycling system [J]. Journal of Water Process Engineering, 2020, 33: 101016.
[42] LIU T X, CHEN D D, LUO X B, et al. Microbially mediated nitrate-reducing Fe(Ⅱ) oxidation: Quantification of chemodenitrification and biological reactions [J]. Geochimica et Cosmochimica Acta, 2019, 256: 97-115.
[43] YOON S, CRUZ-GARCA C, SANFORD R, et al. Denitrification versus respiratory ammonification: Environmental controls of two competing dissimilatory NO-3/NO-2 reduction pathways in Shewanella loihica strain PV-4 [J]. The ISME Journal, 2015, 9(5): 1093-1104.
[44] GAO H, YANG Z K, BARUA S, et al. Reduction of nitrate in Shewanella oneidensis depends on atypical NAP and NRF systems with NapB as a preferred electron transport protein from CymA to NapA [J]. The ISME Journal, 2009, 3(8): 966-976.
[45] CRUZ-GARCA C, MURRAY A E, KLAPPENBACH J A, et al. Respiratory nitrate ammonification by Shewanella oneidensis MR-1 [J]. Journal of Bacteriology, 2007, 189(2): 656-662.
[46] LI X M, ZHOU S G, LI F B, et al. Fe(Ⅲ) oxide reduction and carbon tetrachloride dechlorination by a newly isolated Klebsiella pneumoniae strain L17 [J]. Journal of Applied Microbiology, 2009, 106(1): 130-139.
[47] BELIAEV A S, KLINGEMAN D M, KLAPPENBACH J A, et al. Global transcriptome analysis of Shewanella oneidensis MR-1 exposed to different terminal electron acceptors [J]. Journal of Bacteriology, 2005, 187(20): 7138-7145.
[48] STONE J J, BURGOS W D, ROYER R A, et al. Impact of zinc on biological Fe(Ⅲ) and nitrate reduction by Shewanella putrefaciens CN32 [J]. Environmental Engineering Science, 2006, 23(4): 691-704.
[49] WEBER K A, HEDRICK D B, PEACOCK A D, et al. Physiological and taxonomic description of the novel autotrophic, metal oxidizing bacterium,Pseudogulbenkiania sp. strain 2002 [J]. Applied Microbiology and Biotechnology, 2009, 83(3): 555-565.
[50] JONES L C, PETERS B, LEZAMA PACHECO J S, et al. Stable isotopes and iron oxide mineral products as markers of chemodenitrification [J]. Environmental Science & Technology, 2015, 49(6): 3444-3452.
[51] PICARDAL F. Abiotic and microbial interactions during anaerobic transformations of Fe(Ⅱ) and NO-x [J]. Frontiers in Microbilogy, 2012, 3: 112.
[52] HU M, CHEN P C, SUN W M, et al. A novel organotrophic nitrate-reducing Fe(Ⅱ)-oxidizing bacterium isolated from paddy soil and draft genome sequencing indicate its metabolic versatility [J]. RSC Advances, 2017, 7(89): 56611-56620.
[53] ZHANG W, LI X M, LIU T X, et al. Enhanced nitrate reduction and current generation by Bacillus sp. in the presence of iron oxides [J]. Journal of Soils and Sediments, 2012, 12(3): 354-365.
[54] WANG G W, CHEN T H, YUE Z B, et al. Isolation and characterization of Pseudomonas stutzeri capable of reducing Fe(Ⅲ) and nitrate from skarn-type copper mine tailings [J]. Geomicrobiology Journal, 2014, 31(6): 509-518.
[55] LI X M, LIU T X, LI F B, et al. Reduction of structural Fe(Ⅲ) in oxyhydroxides by Shewanella decolorationis S12 and characterization of the surface properties of iron minerals [J]. Journal of Soils and Sediments, 2012, 12(2): 217-227.
[56] COOPER D C, PICARDAL F W, SCHIMMELMANN A, et al. Chemical and biological interactions during nitrate and goethite reduction by Shewanella putrefaciens 200 [J]. Applied and Environmental Microbiology, 2003, 69(6): 3517-3525.
[57] HERNANDEZ M E, NEWMAN D K. Extracellular electron transfer [J]. Cellular and Molecular Life Sciences CMLS, 2001, 58(11): 1562-1571.
[58] ZHAO L D, DONG H L, KUKKADAPU R K, et al. Biological redox cycling of iron in nontronite and its potential application in nitrate removal [J]. Environmental Science & Technology, 2015, 49(9): 5493-5501.
[59] LU Y S, XU L, SHU W K, et al. Microbial mediated iron redox cycling in Fe (hydr)oxides for nitrite removal [J]. Bioresource Technology, 2017, 224: 34-40.
[60] MUEHE E M, GERHARDT S, SCHINK B, et al. Ecophysiology and the energetic benefit of mixotrophic Fe(Ⅱ) oxidation by various strains of nitrate-reducing bacteria [J]. FEMS Microbiology Ecology, 2009, 70(3): 335-343.
[61] MURPHY J N, SALTIKOV C W. The cymA gene, encoding a tetraheme c-type cytochrome, is required for arsenate respiration in Shewanella species [J]. Journal of Bacteriology, 2007, 189(6): 2283-2290.
[62] NELSON M B, MARTINY A C, MARTINY J B. Global biogeography of microbial nitrogen-cycling traits in soil [J]. Proceedings of the National Academy of Sciences, 2016, 113(29): 8033-8040.
[63] PANDEY A, SUTER H, HE J Z, et al. Dissimilatory nitrate reduction to ammonium dominates nitrate reduction in long-term low nitrogen fertilized rice paddies [J]. Soil Biology and Biochemistry, 2019, 131: 149-156.
[64] SALK K R, ERLER D V, EYRE B D, et al. Unexpectedly high degree of anammox and DNRA in seagrass sediments: Description and application of a revised isotope pairing technique [J]. Geochimica et Cosmochimica Acta, 2017, 211: 64-78.
(編辑 王秀玲)
