植物种子铁储存、运输和再利用分子机制的研究进展
2021-09-10常竣泊马哲宇丁忠杰郑绍建
常竣泊,马哲宇,丁忠杰,郑绍建
(浙江大学生命科学学院,植物生理学与生物化学国家重点实验室,杭州 310058)
铁(Fe)是地壳中含量最丰富的元素之一,在所有地壳元素中排第4位。但土壤中大部分的铁以难溶性化合物的形式存在,使得植物难以有效利用。因此,植物缺铁并非是土壤铁丰度低所致,而是由土壤铁的生物有效性低所导致的[1]。铁作为一种植物必需微量元素,在调节植物体的许多生命进程中都起着极为关键的作用,如光合作用、线粒体呼吸、营养物质运输和激素合成等。植物地上部90%以上的总铁储存在叶绿体中,以保证类囊体膜的结构和功能的完整性,从而使植物体能够进行高效的光合作用来确保其获得生长发育所需的能量和营养[2]。植物在缺铁时的主要症状是叶片黄化,这是由叶绿素含量降低所导致的。同时,植物的根和茎的生长发育也会迟缓,最终使得作物的产量下降,甚至绝产。世界上超过1/3的农田属于石灰性土壤,种植其上的作物普遍存在缺铁现象。研究发现,在这些土壤上生长的花生的叶、茎和根的干质量减少,导致产量损失20%,而其他几种作物(如果树、蔬菜以及谷类和豆类)的产量损失可能超过25%[3]。植物缺铁不仅会导致作物减产,而且会影响人的身体健康。种子是全球多数人口膳食铁的重要来源,其中谷物是世界上绝大多数人口的主食,尤其是水稻作为最重要的粮食作物,为全球超过50%的人口提供营养和能量。不同基因型稻米的含铁量(7.5~24.4 mg/kg)尽管差异较大,但都远低于营养学推荐的膳食标准。由于植物种子铁含量低,因而容易导致人体缺铁。人体在缺铁时会产生贫血现象,全世界至少有20亿人口受到缺铁性贫血的威胁。缺铁性贫血会导致各类严重的症状,如智力和身体发育迟缓,传染病的易感性增加等。而超过一半的缺铁性贫血病例可以通过增加食品中的铁含量来避免[4]。鉴于种子对人体铁营养的重要性,增加种子中的铁含量及其生物有效性是传统育种和通过生物技术方法进行作物铁强化的主要目标[5]。
1 种子铁的储存
铁在种子中的定位会根据物种和种子发育阶段不同而变化,且与储存的铁复合物形态密切关联[6]。铁在种子组织中并不是均匀分布的,如在拟南芥的成熟胚胎中,铁在子叶、下胚轴和胚根的维管组织周围高度富集,占干种子总铁含量的69%[7]。研究者通过二氨基联苯胺(diaminobenzidine,DAB)强化的普鲁士蓝染色发现,在拟南芥种子中,铁主要储存在原内胚层细胞中[8]。MARY 等[9]利用分辨率更高的透射电镜观察到大多数的种子铁定位在原内胚层细胞液泡的球状物中。研究表明,拟南芥的液泡铁转运蛋白1(vacuolar iron transporter 1,VIT1)在种子铁定位过程中发挥着至关重要的作用:VIT1在发育的种子中表达量最高,虽然其功能缺失突变体vit1-1种子的铁含量与野生型没有明显差异,但vit1-1种子中铁的分布发生了显著变化,其主要扩散分布在下胚轴、胚根以及子叶的表皮细胞层中,与锰(Mn)的定位非常类似[10]。需要指出的是,vit1-1中铁的亚细胞定位仍在液泡中[9]。此外,金属耐受蛋白8(metal tolerance protein 8,MTP8)也在拟南芥种子中被检测到,而且MTP8的表达量随着胚胎发育而增加,其功能缺失突变体mtp8-2的锰定位发生改变,与铁共定位,而在双突变体mtp8vit1种子中锰和铁的组织分布不再特异,而是均匀分布在整个种子中[11]。同时,MTP8能够回复铁敏感酵母突变体Δccc1的表型,说明MTP8 能够将铁运输到液泡中。后续实验还证明,MTP8 的4 个E/DxxE/D 铁结合基序对其发挥铁转运功能至关重要[12]。拟南芥胚胎铁的这种分布模式在被子植物中具有保守性。研究发现,菜豆(Phaseolus vulgaris)种子维管组织周围也会积累大量的铁[13]。研究人员在其他芸苔科植物中也观察到类似现象,只是它们会在更多的内胚层细胞中积累铁,而不像拟南芥只在最内层积累[14]。
在各类禾本科植物的种子中铁的分布与芸苔科植物有天壤之别,缘于胚只是谷粒中的一小部分。研究表明,铁主要在水稻的糊粉层中与植酸一起积累,并与磷共定位[15]。小麦中铁的累积与水稻类似,超过60%的种子铁在麸皮的糊粉层中积累,这是谷物中的主要铁库,其次是鳞茎,而在胚乳中只有非常微弱的铁积累。原位X 射线吸收光谱分析显示,铁在糊粉层中以Fe(Ⅱ)和Fe(Ⅲ)形式与植酸结合,其中Fe(Ⅲ)超过75%[16]。同时,铁与磷一起聚集在糊粉层储存蛋白质的液泡内的球状物中,类似于拟南芥中观察到的亚细胞定位[17]。研究显示,水稻中的OsVIT1和OsVIT2在旗叶中高度表达,并且OsVIT1和OsVIT2定位于液泡膜上,具有铁转运活性,其功能缺失突变体osvit1-1和osvit2-1胚中的铁不像野生型一样定位在胚根和盾片中,而是均匀分散在整个胚胎中。值得一提的是,尽管突变体胚胎中种子铁含量增加,但并没有赋予后代生长优势。这些结果说明,胚胎中铁的定位对种子萌发后的生长发育非常重要,且OsVIT1和OsVIT2在水稻胚胎铁定位过程中发挥着重要作用[18]。
种子中的铁除了转运到液泡中储存外,还会以铁蛋白的形式存在。铁蛋白是广泛存在于动物、植物和微生物界的重要铁存储蛋白。铁蛋白呈球状,具有蛋白质外壳,中间是能储存2 500~4 500 个Fe(Ⅲ)的铁核[19],其功能是储存铁用于蛋白质合成,以及在铁过量时起到解毒作用。在拟南芥中共鉴定到4 种铁蛋白,分别被命名为铁蛋白1~4(Arabidopsis thalianaferritin 1-4,AtFer1-4)。AtFer1和AtFer3在莲座叶等营养器官和花及荚果等生殖器官中被检测到表达;而AtFer2只在干种子中有表达,暗示其具有防止种子受到潜在铁毒害的功能;AtFer4只在花粉中被检测到,其具体功能还不明晰[20]。铁蛋白在植物的根、叶片和种子中都能被检测到,其亚细胞定位于植物的质体中。在豆科植物中铁蛋白是种子铁的主要储存形式。研究发现,在豌豆(Pisum sativum)种子中铁积累在种皮和胚中,尤其以胚中的铁含量更高,其中超过92%的铁以铁蛋白的形式储存在胚胎的胚根和子叶的淀粉体中[21]。此外,在大豆[Glycine max(Linn.)Merr.]中铁能够直接诱导铁蛋白mRNA的转录[22]。
植物种子中铁储存的分子调控机制一直不清楚。最新的研究表明,植物激素乙烯参与调控该过程。研究发现,乙烯在拟南芥种子发育中后期大量累积,其通过调控乙烯响应因子(ethylene response factor,ERF)家族中ERF95的表达来促进铁蛋白基因AtFer1的转录。铁蛋白的累积可以缓冲种子铁在储存过程中带来的铁毒害,从而帮助更多的铁进入胚细胞液泡中进行存储[23]。由于乙烯是调控果实成熟的关键信号物质,因此,乙烯促进种子铁的存储可能是一种普遍的机制。
2 种子铁的运输
种子在植物生命进程中处于非常特殊的时期,它是下一代和整个物种赖以生存的基础。铁最终运输到种子中储存要经过其他组织再动员和铁装载到种子组织中这2个步骤。
为确保下一代的存活率,母本植物会将它在营养生活过程中积累的大部分营养物质转移给种子。以氮为例,根据物种的不同,30%~90%的氮在植物生命结束时会分配给种子[24]。种子的铁储存对于维持幼苗的正常生长也非常重要,尤其是线粒体需要大量的铁来为幼苗初期发育提供能量[6]。在植物的营养生长阶段,大量铁被运输到地上部,用于叶肉细胞中叶绿体的合成和光合作用,如叶绿体内有大量富含FeS簇的光系统Ⅰ和铁氧还蛋白[25]。在过渡到生殖阶段时,营养组织中的部分铁会转移到种子中。以拟南芥为例,在植物生命周期结束时,50%~55%的铁会进入到种子中。因此,铁从其他器官再动员到种子中的过程非常关键。研究表明,自噬在铁从营养组织向种子中转运时扮演着重要角色,将自噬相关基因(autophagy related gene,ATG)家族的ATG5突变后,正常供铁情况下的营养组织分配给种子的铁仅有15%~20%[26]。除了自噬,植物衰老时间也是影响铁再动员的一个重要因素。野生小麦中的无顶端分生组织B1(no apical meristem B1 inTriticum turgidum,TtNAM-B1)是一个转录因子,被证明是籽粒成熟过程中加速衰老和叶片养分向种子再动员的正调节因子,暗示提前衰老可能会增加籽粒铁和锌的浓度[27],但同时又会降低产量。因此,后续应开展更多工作来全面理解自噬和衰老之间如何相互协调,并最终控制铁在不同物种的种子中合理分配的比例。
铁离开营养组织后会经由韧皮部运输到正在发育的种子中,而烟酰胺(nicotinamide,NA)能够与铁形成复合物,在通过韧皮部装卸进行的长距离铁运输和过量铁通过区室化进入液泡解毒的过程中发挥多重作用[28]。因此,NA也被认为是植物中铁长距离传递的信号物质[29]。研究发现,烟酰胺合成酶(nicotianamine synthase, NAS)的四突变体nas4x-1种子中的NA 含量不及野生型的一半,铁含量也只有野生型的54%[30],说明了NA 在种子铁累积过程中的重要性。黄色条纹样蛋白(yellow stripe like,YSL)被认为是NA的转运蛋白,YSL家族成员在铁向种子运输过程中也具有重要功能。拟南芥AtYSL1主要在叶片的木质部薄壁组织中表达,在发育的种子中也有微弱表达,并且其表达量在高铁含量条件下会上调。研究还发现,ysl1-1和ysl1-2功能缺失突变体种子中的NA含量均较野生型显著减少,从而使ysl1-1和ysl1-2种子的铁含量分别比对应的野生型低65%和30%。这些结果表明,AtYSL1参与了铁和NA 的长距离运输及转运到种子的过程[31]。另一个成员AtYSL3在拟南芥的莲座叶中表达量最高,在根中也有表达。虽然ysl1-2和ysl3-1单突变体没有明显表型,但ysl1ysl3双突变体出现明显的脉间黄化的缺铁表型,而且种子受精率下降;此外,双突变体叶片中的铁含量下降;同时,种子中的铁含量明显低于野生型。表明AtYSL1 和AtYSL3 共同参与了维管组织向种子的铁运输[32]。有趣的是,通过花序嫁接实验发现,将ysl1ysl3双突变体植株的初生花序茎嫁接到野生型植株后,收获的种子萌发正常,并且发育缺陷也得到挽救,但嫁接植株种子的铁含量仍显著低于野生型,再次证明AtYSL1 和AtYSL3 在植物种子铁运输过程中至关重要[33]。关于YSL 家族在铁向种子运输中的研究并不局限于拟南芥。研究人员在水稻中鉴定到18个YSL同源蛋白(OsYSLs),其中OsYSL2是定位于细胞质膜的转运蛋白,其启动子在韧皮部的特异性表达说明OsYSL2参与了铁的韧皮部转运。电生理实验显示,OsYSL2 能够运输Fe(Ⅱ)-NA,表明OsYSL2 是水稻中Fe-NA 复合物的转运体;同时,OsYSL2在发育的种子中也有表达,暗示其参与铁向籽粒的输送[34]。后续研究发现,RNAi 株系OsYSL2i根中的铁含量增加,但向茎和种子的铁运输被抑制,导致种子特别是胚乳中的铁含量下降,说明OsYSL2 在铁向胚乳的运输中也起着关键作用[35]。OsYSL15也被报道参与了种子铁的分配过程,其功能缺失突变体osysl15-1和osysl15-2在缺铁条件下均表现出更为敏感的叶片失绿和株高下降表型,且种子中的铁含量均低于野生型,而超表达株系的种子铁含量较野生型明显增多,表明OsYSL15在铁向种子分配过程中发挥作用[36]。此外,近年来的研究表明,OsYSL9定位在细胞质膜上,能够向胞内转运Fe(Ⅱ)-NA 和Fe(Ⅲ)-DMA(脱氧麦根酸)。缺铁后OsYSL9在根部的维管束中被诱导,而OsYSL9基因敲除植株胚中铁含量下降,但种子的其他部位铁含量升高,暗示OsYSL9 参与种子发育过程中胚乳到胚的铁转运[37]。
寡肽转运蛋白家族(oligopeptide transporter family, OPT)的AtOPT3 在铁从营养器官向发育种子运输过程中也扮演着关键角色。研究发现,OPT3在发育的胚胎和种子的母体组织中均有表达,而OPT3的基因敲除突变体胚胎死亡,表明OPT3转运的底物是一种必需的细胞代谢物[38]。进一步构建表达降低的突变体opt3-2发现,铁在该突变体的营养组织中大量积累,而种子中的铁含量明显下降,说明AtOPT3 在向种子转运铁方面发挥着重要作用[39]。值得一提的是,OPT3的表达可以部分挽救酵母铁吸收缺陷双突变体fet3fet4的生长缺陷[40],说明其能够转运铁复合物,但其确切底物仍不明晰。
由于母体的维管组织与胚胎之间没有连续性,因此,铁进入胚胎组织需要经历韧皮部铁释放和胚胎铁吸收2 个步骤。在拟南芥等双子叶植物中,铁首先释放到胚囊液中,再由胚胎吸收,拟南芥高铁还原酶缺陷3(ferric reductase defective 3 inA.thaliana,AtFRD3)是一个柠檬酸外排转运体,被认为在维持胚囊液Fe(Ⅲ)稳态过程中发挥作用。FRD3在韧皮部和胚胎中均有表达,暗示这个过程是由母体和胚胎共同完成的。FRD3功能缺失突变体frd3-7表现出萎黄和生长迟缓的表型,而且frd3-7植株基本上不育,很少形成荚果,从而导致种子产量只有野生型的2%。施加过量铁螯合物(500 mmol/L Fe-EDDHA)能够挽救植株黄化和减产的表型,但营养组织中铁过量累积造成的毒害作用使得植株更加矮小,同时也说明FRD3 在种子铁累积中具有重要作用[41]。虽然有报道膜铁转运蛋白(ferroportin,FPN)家族的FPN1 和FPN2 分别定位于质膜和液泡膜上,并且参与拟南芥中铁的外排,但目前还没有关于其突变体种子中铁含量的报道[42],因此,将铁释放到胚囊液的转运蛋白仍不清楚。双子叶植物中铁以亚铁形式被吸收进胚胎,因此,胚胎吸收前的铁还原过程也非常关键[6]。研究表明,胚胎具有铁还原性,但令人意外的是,Fe(Ⅲ)的还原并不是由膜定位的铁还原酶催化的,而是由胚胎排出的抗坏血酸(vitamin C)完成的。对豌豆种子分析发现,Fe(Ⅲ)与柠檬酸和苹果酸结合以复合物的形式存在于胚囊液中,而胚胎通过外排抗坏血酸将Fe(Ⅲ)还原为Fe(Ⅱ)供胚胎吸收。在拟南芥中也发现同样的机制:抗坏血酸突变体的种子胚胎中铁还原活性显著降低,并且普鲁士蓝染色和种子铁含量测定都显示突变体成熟胚胎中的铁积累明显低于野生型,说明抗坏血酸介导的Fe(Ⅲ)还原是胚胎铁吸收的必需步骤,而且在双子叶植物中可能普遍存在这一机制[43]。
3 萌发后种子铁的再利用
种子铁的主要作用是维持萌发后幼苗的早期生长发育。在拟南芥等双子叶植物中大多数的铁与植酸结合并储存在液泡中,因此,铁的再利用首先需要分解植酸铁化合物,然后将铁运出液泡,最终从细胞中排出,进而运输到其他部位。研究发现,拟南芥种子萌发4 d后,在干种子中观察到铁在维管组织周围高度富集的现象消失,这说明铁在种子萌发后会迅速再利用并重新分配到幼苗的营养器官中[8]。将细菌植酸酶(phytase, PHY)在拟南芥中过表达后,超表达株系L7 和L9 种子中的植酸浓度显著下降,而且种子萌发2 d 后,L7 和L9 维管组织附近铁浓度明显低于野生型,说明超表达株系的铁再利用率更高[44]。自然抗性相关巨噬细胞蛋白(natural resistance-associated macrophage protein,NRAMP)家族的AtNRAMP3 和AtNRAMP4 被报道在液泡铁的再利用过程中发挥重要作用,它们都定位在液泡膜上,而且功能冗余。研究发现,AtNRAMP3和AtNRAMP4在根、茎和叶的维管束中表达,且表达量受到缺铁诱导,单突变体nramp3-1和nramp4-1没有明显表型,但nramp3nramp4双突变体在正常培养基上播种后的前4 d,在子叶绿化和根系生长方面表现出明显的迟缓,播种在缺铁培养基上则表现出极其明显的敏感表型。后续实验表明,AtNRAMP3和AtNRAMP4双在种子萌发的早期表达,AtNRAMP4 定位于子叶细胞的液泡膜上,并且发现萌发后铁仍定位于nramp3nramp4双突变体子叶液泡的球状物内,而野生型液泡中的铁早已消失,说明铁在野生型子叶液泡中迅速被动员,而AtNRAMP3 和AtNRAMP4 在这一过程中发挥着重要作用[45]。有趣的是,当AtVIT1也突变后,nr3nr4vit1-1三突变体在缺铁条件下萌发时表现出野生型和nramp3nramp4之间的中间表型,这是由于AtVIT1的突变改变了种子中铁的定位,使其储存在子叶的表皮层细胞胚根的皮层细胞中,而这部分铁在缺失AtNRAMP3 和AtNRAMP4 时也能够被充分动员[9]。当铁被转运出细胞后,需要以可溶态形式扩散到其他细胞中,柠檬酸外排转运蛋白FRD3在该环节中发挥着重要作用。外源添加柠檬酸能够回复frd3-7根系生长缓慢和子叶失绿的表型,暗示柠檬酸外排有助于萌发早期的铁动员[41]。
由于组织结构不同,禾本科植物种子中铁的再利用机制与芸苔科植物有很大不同。谷粒中大部分铁储存在糊粉层中,萌发时在赤霉素(gibberellin,GA)的诱导下糊粉层细胞分泌淀粉酶来消化胚乳中的淀粉,而糊粉层细胞完成分泌后会发生细胞程序性死亡(programmed cell death, PCD),细胞膜在这个过程中被破坏,而储存在糊粉层液泡中的植酸铁复合物会释放到胚乳中。在胚乳中植酸可能被植酸酶水解,释放的铁与NA 结合。接着铁会从胚乳吸收到胚胎中,最终分配到胚胎内的生长器官中。研究发现,播种12 h后,铁在水稻维管束、糊粉层和胚乳中积累,24 h后铁分布在盾片中,并在胚芽鞘中积累,盾片附近的胚乳中也有铁的积累。36 h 后根尖中已经能检测到铁的积累,此时的铁不仅存在于盾片和胚芽鞘中,而且存在于叶原基和胚根中[46]。同时,NA 合成酶家族的OsNAS1、OsNAS2、OsNAS3和NA 氨 基 转 移 酶(nicotianamine aminotransferase,NAAT)家族的OsNAAT1都在胚根突出之前的萌发种子中表达上调,暗示铁与NA形成复合物而运输到胚胎中。铁转运蛋白OsYSL2和OsIRT1在萌发的水稻种子中表达量也增加,进一步说明种子萌发过程对铁的运输和再分配需求很高[47]。此外,与双子叶植物一样,柠檬酸外排转运蛋白基因OsFRDL1的表达也上调,表明柠檬酸在种子萌发后铁在胞间转运过程中起到维持铁的溶解度的功能[41]。
4 小结与展望
以拟南芥和水稻为例,目前,种子铁储存、运输和再利用的研究进展如图1所示。铁是植物生长发育必需的微量元素,为确保幼苗正常的生长发育,种子中的铁必须以合理的含量、复合物形式和特定的定位来储存。同时,种子也是全球大多数人口的重要膳食来源,因此,种子中的铁更应被关注。目前,已有许多铁的转运蛋白和配体被报道,并且这些知识已被应用于设计有针对性的铁生物强化策略,例如,通过过表达烟酰胺合成酶基因(NAS)来提高水稻种子的铁含量[48],或将铁转运蛋白基因(如OsIRT1、OsYSL15)导入到作物中以提高种子铁含量[36,49]。最新研究发现,敲除OsVIT2能够使更多的铁沉积在胚和胚乳中,从而提高精米铁含量[50]。此外,还可以通过提高种子铁蛋白水平来增加种子的铁累积。然而,许多关键步骤仍有待在分子水平上进行阐释。在铁储存过程中,植物激素如何调控铁储存,这种调控是否具有物种保守性,以及铁储存是如何与调节种子发育的信号通路和转录因子相联系的,这些问题还需要进一步解答。对于种子铁的运输,铁在韧皮部中运输时的配体仍未确定,OPT3 的确切底物也有待探索。负责铁、苹果酸和抗坏血酸分泌到胞外空间的转运蛋白以及将铁摄取到胚胎中的转运蛋白也有待确定。对拟南芥等双子叶植物而言,萌发后铁的再利用过程中NRAMP3/4 介导的液泡铁外排的上下游仍有几个步骤不清楚,例如:负责分解液泡植酸而释放可运输铁的植酸酶需要确定;NRAMP3/4 都是二价阳离子转运蛋白,因此,铁在排出液泡前可能存在还原步骤,潜在的高铁还原酶也需要鉴定;在铁流出液泡后,需要由内胚层细胞转运到其他细胞中,而铁质膜转运蛋白还有待研究。在单子叶植物中,种子萌发后许多转运蛋白和铁载体蛋白都参与到铁再利用过程中,但这些转运蛋白的具体贡献仍有待分析,并以此确定禾本科植物铁再活化的关键步骤。在铁生物强化方面,如何改变籽粒中的铁定位,使其更多定位于可食用的胚乳中仍有待研究。而低植酸种子的铁生物有效性也有待评估,需要更多的体内实验来验证。解开这些疑问不仅能够帮助我们更好地理解植物如何将铁传递给下一代,还可以为种子铁的生物强化提供新思路。
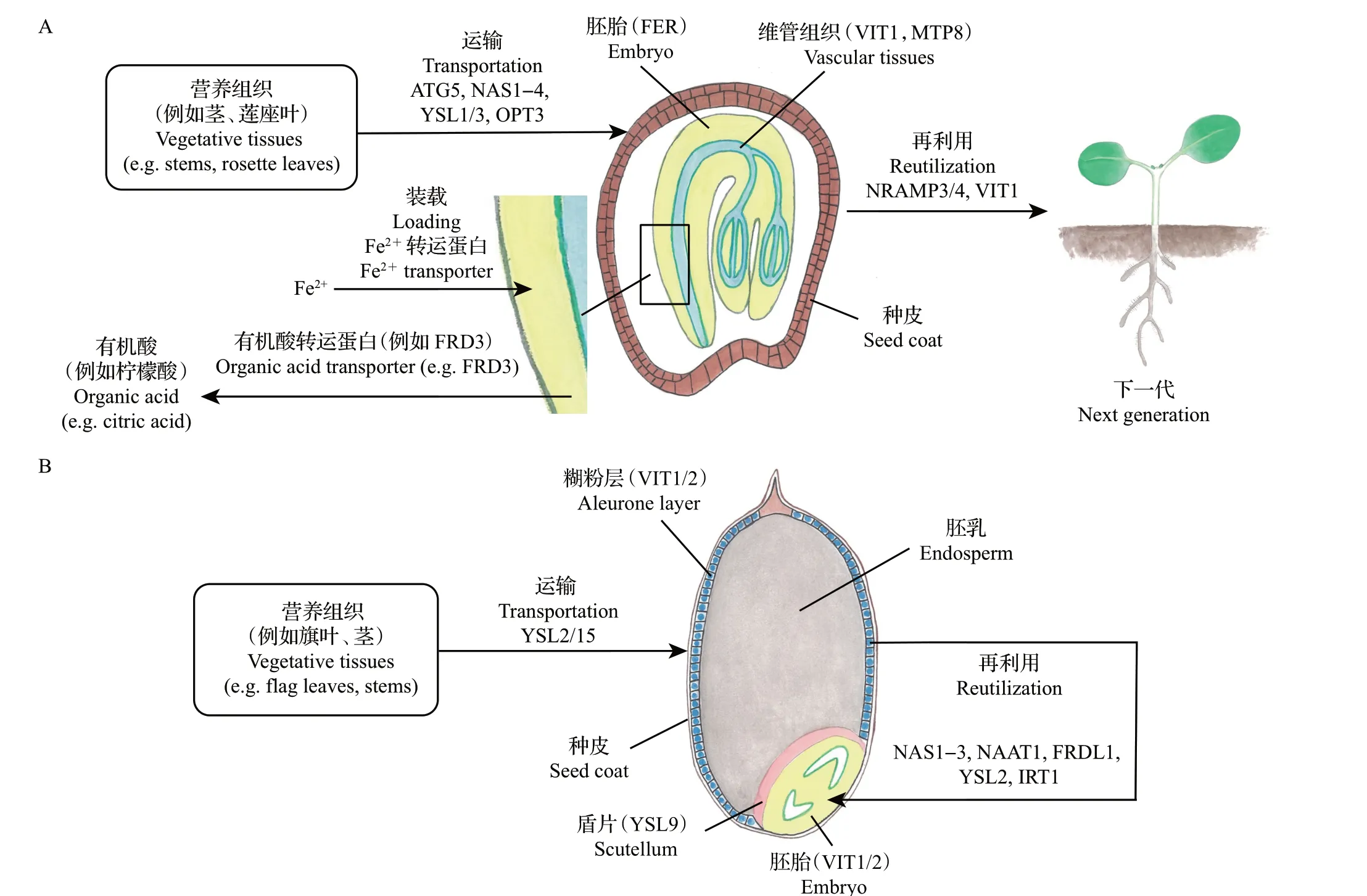
图1 拟南芥种子(A)和水稻种子(B)铁储存、运输和再利用模式图Fig.1 Pattern diagrams of iron storage,transportation and reutilization in Arabidopsis thaliana seeds(A)and rice seeds(B)
