大鼠膝骨关节炎模型中高迁移率族蛋白1的高表达机制
2021-09-10洪博文黄桂成
梅 伟,洪博文,黄桂成
南京中医药大学附属医院骨伤科,江苏 南京210000
膝骨性关节炎(KOA)是一种慢性退行性关节疾病,主要发病于老年人群当中,其主要病理改变包括关节软骨降解、软骨下骨硬化、囊肿形成、骨赘形成,是导致关节慢性疼痛、关节僵硬甚至下肢残疾的重要因素,显著影响患者的生活质量[1]。
高迁移率族蛋白1(HMGB1)是KOA病理进程中的重要炎症因子,滑膜成纤维细胞在相关炎症因子的作用下可大量释放HMGB1[2-5],HMGB1作用于软骨细胞促进基质金属蛋白酶的表达增加,加速关节软骨的降解[6],且HMGB1的水平与KOA滑膜炎症反应及KOA病理进展成正相关[7],但目前对于在KOA病理进程中引起HMGB1大量释放的的具体分子机制仍不明确。
KOA患者滑膜组织中滑膜成纤维细胞发生焦亡是促进关节局部滑膜炎症反应加重KOA的病理改变的重要因素,滑膜成纤维细胞焦亡主要依赖NLRPs/ASC/caspase-1经典细胞焦亡途径[8,9]。类似的基础实验发现,在急性肺损伤疾病中,NLRP3/ASC途径介导的肺泡巨噬细胞发生焦亡后可释放大量HMGB1,通过抑制NLRP3、ASC相关基因的表达可明显抑制肺泡巨噬细胞焦亡及HMGB1 的表达[10],这在一定程度上证明HMGB1是细胞焦亡的重要下游产物。
鉴于KOA病理进程中滑膜成纤维细胞发生焦亡的同时存在HMGB1 高表达的现象以及细胞焦亡与HMGB1之间存在的密切关系,我们推测在KOA的病理进程中,滑膜成纤维细胞焦亡可促进HMGB1的大量释放,进而加剧KOA的病理进程,为了进一步探究其内在联系,我们先后通过动物实验及细胞实验进一步观察滑膜成纤维细胞的焦亡与其分泌HMGB1的内在分子机制,为临床KOA的防治提供一定的理论基础。
1 材料和方法
1.1 实验动物及细胞
1.1.1 实验动物 2 月龄雄性SD 大鼠(动物证书编号201810A001),体质量200~300 g,饲养于SPF环境中,温度控制在(25±2)℃,湿度控制在(60±5)%,12 h黑白更替。所有动物实验方案均经南京中医药大学动物保护与利用委员会批准。所有实验都是按照美国国立卫生研究院的(NIH)实验动物护理和使用指南进行。将大鼠随机分为2 组:空白对照组(6只)、KOA组(6只)。使用前交叉韧带离断法(ACLT)建立大鼠KOA模型[11]。在造模后第21天处死大鼠,取下各组大鼠的软骨、滑膜组织。使用HE进行软骨染色,使用Mankin'评分评价软骨破坏情况,以此评估膝骨关节炎造模是否成功。使用Western blot 检测滑膜组织中焦亡相关蛋白及HMGB1蛋白的表达情况。
1.1.2 滑膜成纤维细胞的提取和培养 选择5只2月龄的SD大鼠,脱颈处死,置于75%酒精中浸泡消毒15 min,消毒后转入超净台,使用无菌剪刀、无菌刀片从大鼠膝关节中剥离滑膜组织,使用无菌PBS清洗3遍,使用眼科剪将滑膜组织剪成约3 mm×3 mm×3 mm大小的碎片,使用无菌PBS清洗3遍,放入用DMEM配成的I型胶原酶消化液中消化1 h,消化完成后使用100 μm的过滤器过滤,收集滤液,以300g离心力离心5 min,使用10%胎牛血清及1%双抗配成的培养液重悬,放入细胞培养箱中培养,本实验使用2~3代成熟的细胞进行实验。
1.2 实验方法
1.2.1 诱导滑膜成纤维细胞焦亡 在生长良好的滑膜成纤维细胞中加入LPS(3 μg/mL)诱导12 h,再以ATP(3 mmol/L)处理4 h。空白对照组给予等量的PBS处理。诱导焦亡后收集细胞上清及细胞组织。使用ELISA检测细胞上清中HMGB1的蛋白水平,Western blot 检测焦亡相关蛋白及HMGB1的表达情况。
1.2.2 小干扰RNA(SiRNA)转染 为了抑制滑膜成纤维细胞焦亡,我们使用小干扰RNA(广州锐博生物有限公司)抑制NLRP1、NLRP3、ASC及caspase-1的mRNA的表达,空载转染RNA有一定的基因序列但无实际转染沉默效果,本实验作为阴性对照组。各个小干扰RNA 序列如下:NLRP1(5'-GGUGGAGCUGCA UCACAUATT-dTdT-3');NLRP3(5'-GGAGAGACCU UUAUGAGAATT-dTdT-3');ASC(5'-CTGATAAAC TCGTCAGCTA-dTdT-3');caspase-1(5'-GGGCAAG CCAGAUGUUUAU-dTdT-3'),将滑膜成纤维细胞种植于6孔板中,将小干扰RNA溶于lipo2000试剂中,每孔加入20 pmol的小干扰RNA孵育6 h,后诱导滑膜成纤维细胞焦亡,我们使用聚合酶链式反应(RT-qPCR)技术检测小干扰RNA的转染效果。将滑膜成纤维细胞分为空白对照组(诱导焦亡后无小干扰RNA处理)、NLRP1、NLRP3、ASC或caspase-1转染组(小干扰RNA处理后诱导细胞焦亡)、空载转染组(空载体RNA处理后诱导细胞焦亡)。
1.2.3 蛋白免疫印迹法检测相关蛋白表达(Western blot)将滑膜组织及滑膜成纤维细胞放入RIPA裂解液中于冰上裂解10 min,裂解完成后以12 000g离心力离心10 min,用BCA法测定蛋白浓度。配置5%浓缩胶和10%分离胶进行SDS-PAGE电泳。在S1模式电压80 V和S2模式120 V电压下分离,250 mA将凝胶上的蛋白湿转到PVDF膜上,2%BSA封闭液室温摇床摇动封闭1 h,加入一抗4 ℃孵育过夜Caspase1p10(1∶1000,圣克鲁斯),NLRP3(1∶500,艾博抗),NLRP1(1∶1000,圣克鲁斯),proIL1β(1∶2000,艾博抗),IL1β(1∶1000;艾博抗),GSDMDC(1∶500,圣克鲁斯),HMGB1(1∶5000,艾博抗),β-actin(1∶2000;武汉三鹰公司)。TBST漂洗后加入二抗(HRP山羊抗大鼠抗体IgG(H+L)(1∶20 000,武汉三鹰公司),HRP-conjugated Affinipure Goat Anti-Mouse IgG(H+L)(1∶20 000,武汉三鹰公司),室温孵育1 h,再次TBST漂洗,ECL(上海天能,180-5001)显色。
1.2.4 聚合酶链式反应(RT-qPCR)利用Trizol法提取软骨细胞总RNA,将其反转录为cDNA,再以cDNA为模板,后进行PCR扩增,以GAPDH作为内参,反应条件为:95 ℃,30 s,变性95 ℃,3 s,退火62 ℃,34 s,共40个循环,实验结果采用2-ΔΔCt法进行表达量相对定量分析。检索NCBI-Gene-Bank 数据库,找到SD 大鼠NLRP1、NLRP3、ASC、caspase-1、GAPDH的基因序列,由上海生工生物有限公司设计并合成各基因引物。具体引物序列见表1。
1.2.4 ELISA检测细胞上清中HMGB1蛋白水平 将细胞上清在4 ℃环境下以1500g离心力离心15 min去除细胞碎片,按照ELISA检测试剂盒说明书进行操作,检测细胞上清HMGB1的蛋白水平,每组实验重复3次。
1.2.5 软骨组织染色及分析 将软骨组织置于4%甲醛溶液中,在常温环境下固定72 h,后将软骨置于15%的EDTA中,在常温环境中脱钙3个月,脱钙后置于无水乙醇中脱水2 h,后将软骨置于二甲苯中处理后进行石蜡包埋。石蜡包埋后石蜡切片,将软骨组织切成5 μm厚度的切片,将石蜡切片放入二甲苯中处理30 min进行脱蜡,使用不同浓度梯度酒精处理切片进行水化,水化后在常温中使用苏木精染色3 min,流水冲洗后使用伊红染液在常温下染色3 min,最后标本经过二甲苯处理20 min进行封闭,镜下观察软骨组织病理变化情况,使用Mankin'评分评估软骨组织破坏情况(0分,正常;1分,轻度破坏;2分,中度破坏;3分,重度破坏)。
1.3 统计学分析
使用Graphpad Prism 5软件进行数据分析,正态分布计量资料采用均数±标准差表示,单独组间比较采用t检验,组间不同指标分析采用Two-way ANOVA,以P<0.05为差异具有统计学意义。
2 结果
2.1 大鼠膝骨关节炎模型滑膜组织中焦亡相关蛋白、HMGB1的蛋白表达情况及软骨破坏情况
SD大鼠分为空白对照组(control)、膝骨关节炎组(KOA)。KOA组中焦亡相关蛋白及HMGB1的明显高于control组(P<0.05)。KOA组软骨组织的Mankin’评分明显高于control组(P<0.05,图1)。

图1 细胞焦亡的同时伴随HMGB1的高表达Fig.1 Pyroptosis of the FLSs accompanied by increased expression of HMGB1 in rat models of KOA.A,B:Western blot analysis of pyroptosis-related proteins and HMGB1 in the synovial tissues.C:Pathological changes of the cartilage(HE staining,original magnification:×200).D:Mankin scores of the cartilage in the control and KOAgroups.*P<0.05 vs control group.
2.2 NLRP1、NLRP3、ASC、caspase-1小干扰RNA显著降低滑膜成纤维细胞中相应基因的mRNA表达
细胞分为control 组,siRNA 组(小干扰RNA),Vehicle组(空载体小干扰RNA)。与control组及Vehicle组相比,各siRNA组mRNA表达明显降低,差异具有统计学意义(P<0.05)。与control 组相比,Vehicle 组mRNA表达无明显改变,无统计学差异(P>0.05,表2)。

表2 NLRP1、NLRP3、ASC、caspase-1 mRNA相对表达量Tab.2 Relative expression of NLRP1,NLRP1,NLRP3,ASC and caspase-1 mRNA(Mean±SD)
2.3 NLRP1小干扰RNA显著抑制滑膜成纤维细胞焦亡及HMGB1的释放
Western blot 检测滑膜成纤维细胞中焦亡相关蛋白(NLRP1、caspase-1 p10、GSDMD、pro-IL-1β、IL-1β)及HMGB1 蛋白的表达水平。ELISA 检测细胞上清中HMGB1的蛋白水平。pyroptosis组中细胞焦亡相关蛋白水平明显高于空白对照组(P<0.05),NLRP1 siRNA组细胞焦亡相关蛋白水平明显低于pyroptosis 组(P<0.05)。pyroptosis组HMGB1蛋白水平明显高于空白对照组(P<0.001),NLRP1 siRNA组HMGB1蛋白水平明显低于pyroptosis组(P=0.002,图2)。

图2 NLRP1小干扰RNA显著抑制滑膜成纤维细胞焦亡及HMGB1的释放Fig.2 NLRP1 knockdown decreases FLSs pyroptosis and HMGB1 secretion in vitro.A,B:Western blot analysis of pyroptosis-related proteins and HMGB1 in FLSs.C:ELISA analysis of HMGB1 in the supernatant of FLSs.*P<0.05 vs control group.#P<0.05 vs pyroptosis group.
2.4 NLRP3小干扰RNA显著抑制滑膜成纤维细胞焦亡及HMGB1的释放
Western blot 检测滑膜成纤维细胞中焦亡相关蛋白(NLRP3、caspase-1 p10、GSDMD、pro-IL-1β、IL-1β)及HMGB1 蛋白的表达水平。ELISA 检测细胞上清中HMGB1的蛋白水平。pyroptosis组中细胞焦亡相关蛋白水平明显高于空白对照组(P<0.05),NLRP3 siRNA组细胞焦亡相关蛋白水平明显低于pyroptosis 组(P<0.05)。pyroptosis组HMGB1蛋白水平明显高于空白对照组(P<0.001),NLRP3 siRNA组HMGB1蛋白水平明显低于pyroptosis组(P=0.007,图3)。

图3 NLRP3小干扰RNA显著抑制滑膜成纤维细胞焦亡及HMGB1的释放Fig.3 NLRP3 knockdown decreases FLSs pyroptosis and HMGB1 secretion in vitro.A,B:Western blot analysis of pyroptosis-related proteins and HMGB1 in FLSs.C:ELISA of HMGB1 in the supernatant of FLSs.*P<0.05 vs control group.#P<0.05 vs pyroptosis group.
2.5 ASC小干扰RNA显著抑制滑膜成纤维细胞焦亡及HMGB1的释放
Western blot 检测滑膜成纤维细胞中焦亡相关蛋白(caspase-1 p10、GSDMD、pro-IL-1β、IL-1β)及HMGB1蛋白的表达水平。ELISA检测细胞上清中HMGB1的蛋白水平。pyroptosis组中细胞焦亡相关蛋白水平明显高于空白对照组(P<0.05),ASC siRNA组细胞焦亡相关蛋白水平明显低于pyroptosis组(P<0.05)。pyroptosis组HMGB1蛋白水平明显高于空白对照组(P<0.001),ASC siRNA 组HMGB1 蛋白水平明显低于pyroptosis组(P=0.006,图4)。
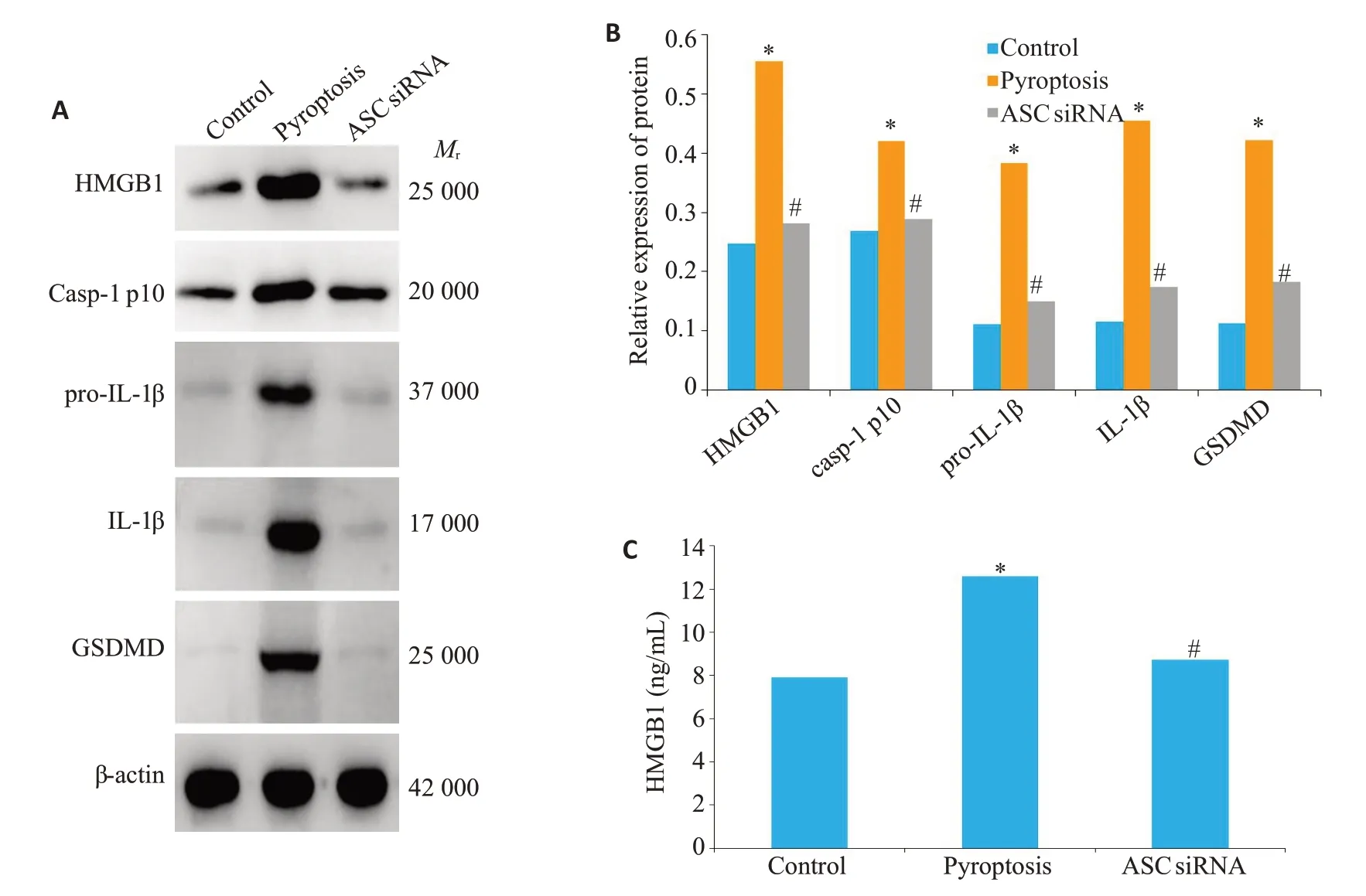
图4 ASC小干扰RNA显著抑制滑膜成纤维细胞焦亡及HMGB1的释放Fig.4 ASC knockdown decreases FLSs pyroptosis and HMGB1 secretion in vitro.A,B:Western blot analysis of pyroptosis related proteins and HMGB1 in FLSs.C:ELISA analysis of HMGB1 in the supernatant of FLSs.*P<0.05 vs control group.#P<0.05 vs pyroptosis group.
2.6 Caspase-1小干扰RNA显著抑制滑膜成纤维细胞焦亡及HMGB1的释放
Western blot 检测滑膜成纤维细胞中焦亡相关蛋白(GSDMD、pro-IL-1β、IL-1β)及HMGB1蛋白的表达水平。ELISA 检测细胞上清中HMGB1 的蛋白水平。pyroptosis组中pro-IL-1β蛋白水平明显高于空白对照组(P<0.05),但并不高于caspase-1siRNA组(P>0.05)。pyroptosis组其他焦亡相关蛋白水平明显高于空白对照组(P<0.05)。pyroptosis组HMGB1水平明显高于空白对照组(P<0.001),pyroptosis组HMGB1水平明显高于caspase-1siRNA组(P=0.006,图5)。

图5 Caspase-1小干扰RNA显著抑制滑膜成纤维细胞焦亡及HMGB1的释放Fig.5 Caspase-1 knockdown decreases FLSs pyroptosis and HMGB1 secretion in vitro.A,B:Western blot analysis of pyroptosis-related proteins and HMGB1 in FLSs.C:ELISA analysis of HMGB1 in the supernatant of FLSs.*P<0.05 vs control group.#P<0.05 vs pyroptosis group.
3 讨论
滑膜炎是KOA常见的病理特征,绝大多数具有临床症状的KOA患者都患有滑膜炎,滑膜炎症反应可伴随着关节局部瘀血、水肿、炎症介质聚集、软骨水解酶的增加等,这些都是导致关节软骨破坏的重要因素[12,13]。滑膜成纤维细胞作为重要的炎性细胞,在KOA病理进程中起到重要推动作用[14,15]。
有研究证实,HMGB1是KOA病理进程中重要的促炎因子,膝关节滑液中HMGB1的水平与KOA的病变程度成正比[16,17],HMGB1可反映滑膜炎的活动度,对于指导临床治疗、判断疾病预后具有重要意义[18]。HMGB1可以与RAGE,TLR4等受体结合直接导致软骨降解或诱发滑膜炎症反应,HMGB1也可以与LPS及IL-1形成复合体进而促进滑膜成纤维细胞释放相关促炎因子[19,20]。也有研究发现在急性肝损伤疾病中,HMGB1可激活NLRP3炎性小体进而促进巨噬细胞焦亡,表明HMGB1同样是促进细胞焦亡的重要因素之一,但是在KOA病理进程中HMGB1能否引起相关细胞焦亡目前仍不清楚[21]。有研究发现,在KOA病理过程中,滑膜成纤维细胞在炎症因子的作用下可促进HMGB1的大量释放,但是目前对于HMGB1释放的具体分子机制仍然缺乏研究[22]。
经典的细胞焦亡途径是由半胱氨酸蛋白酶1(caspase-1)介导的细胞程序性死亡模式,Nod 受体热蛋白结构域蛋白(NLRPs)炎性小体是介导细胞焦亡的重要炎性小体,NLRPs 可直接与凋亡相关斑点样蛋白(ASC)结合进而激活caspase-1,活化GSDMD 蛋白(Gsdermin D),活化的GSDMD可导致细胞膜穿孔最终促进炎性因子的大量释放,如白介素1β(IL-1β)、白介素18(IL-18)[23]。既往研究证实,KOA患者膝关节的滑膜成纤维细胞(FLSs)也存在细胞焦亡现象,该焦亡主要由NLRP1和NLRP3炎性小体介导[8,9]。
NLRP1及NLRP3在免疫性疾病中可介导巨噬细胞焦亡导致炎症因子的大量释放,如IL-1β、IL-18。NLRPs 炎症小体由Nod 受体热蛋白结构域蛋白(NLRP)、凋亡相关斑点样蛋白(ASC)和半胱天冬酶-1前体(pro-caspase-1)三种蛋白组成[24,26]。焦亡早期质膜上形成阳离子渗透孔隙即质膜孔,可引起细胞的离子梯度消失和渗透溶胀及裂解,致使核膜完整的核固缩及细胞肿胀。随后pro-caspase-1 发生自我剪切活化为caspase-1 p10、caspase-1 p20,活化后的caspase-1能将pro-IL-1β、pro-IL-18剪切为IL-1β、IL-18,细胞焦亡可导致下游GSDMD蛋白大量增加,进而在细胞膜上形成孔洞,使得IL-1β、IL-18等因子大量释放至细胞外,导致炎症的级联放大[27]。既往研究发现,滑膜成纤维细胞焦亡由NLRP1及NLRP3炎性小体介导,这表明炎性小体是滑膜炎症反应的重要因素[28,29]。本研究首先通过动物实验,我们发现大鼠KOA模型的膝关节滑膜组织中焦亡相关蛋白和HMGB1均升高,这在一定程度上表明滑膜组织释放的HMGB1或许与发生在滑膜组织中的细胞焦亡现象呈正相关,即HMGB1可能是细胞焦亡释放的下游炎症因子。
为了进一步验证HMGB1的分泌与细胞焦亡的关系,我们然后进行了体外实验,通过提取滑膜成纤维细胞并诱导焦亡,使用NLRP1、NLRP3、ASC及caspase-1的小干扰RNA抑制细胞焦亡信号通路相蛋白表达从而抑制滑膜成纤维细胞焦亡,从而验证HMGB1的释放与滑膜成纤维细胞焦亡的内在关系,NLRP1 和NLRP3均是能识别病原相关分子模式(PAMP)的模式识别受体(PRR),NLRPs 是诱发细胞焦亡的上游信号分子,当NLRPs表达增加后导致炎性小体表达显著增加,进而导致下游caspase-1和GSDMD蛋白的显著升高,最终导致HMGB1的大量表达,用小干扰RNA抑制了NLRPs的表达后焦亡相关蛋白及HMGB1的表达均降低,本实验通过使用NLRP1、NLRP3小干扰RNA,表明抑制了细胞焦亡信号通路上游NLRP、NLRP3基因表达水平后其下游细胞焦亡相关蛋白及HMGB1的表达水平也明显降低。目前可以肯定的是,KOA过程中滑膜成纤维细胞释放HMGB1的过程与NLRP1及NLRP3炎性小体激活导致的细胞焦亡有关。
为了进一步证实HMGB1的释放是与NLRPs炎性小体激活导致的细胞焦亡有关还是与NLRPs激活导致的其他炎症通路有关,我们使用了ASC和caspase-1的小干扰RNA来抑制滑膜成纤维细胞焦亡通路的下游因子ASC和caspase-1。ASC是构成NLRPs炎性小体的重要组成部分,与NLRPs的激活有关,使用ASC小干扰RNA 抑制ASC 表达之后其下游GSDMD、caspase-1、pro-IL-1β、IL-1β焦亡因子表达明显降低,这表明抑制炎性小体的组成部分ASC在抑制细胞焦亡信号通路的同时可明显降低HMGB1表达。
为了进一步验证细胞焦亡与HMGB1表达的关系,我们进一步使用caspase-1小干扰RNA抑制了细胞焦亡的重要下游因子caspase-1,目前大量的基础研究都已经证实,caspase-1是细胞焦亡信号通路的重要下游因子[30,31],活化后的caspase-1能将pro-IL-1β、pro-IL-18剪切为IL-1β、IL-18,本实验抑制了caspase-1基因表达后发现细胞焦亡下游蛋白如IL-1β、GSDMD、HMGB1的蛋白表达均降低,pro-IL-1β蛋白表达没有降低,表明抑制了细胞焦亡信号通路下游的caspase-1基因表达水平后其下游细胞焦亡相关蛋白及HMGB1的表达水平也明显降低,而pro-IL-1β因缺少了成熟caspase-1的剪切作用而没有明显减少,也证明HMGB1 的表达与caspase-1蛋白的活化有关,是经典细胞焦亡途径的产物,但目前对于caspase-1的激活如何促进HMGB1合成及其释放的具体分子机制仍不清楚,仍然需要进一步深入的研究。
综上所述,滑膜巨噬细胞焦亡确实可促进HMGB1的大量合成及释放,在抑制了滑膜成纤维细胞焦亡之后其表达的细胞焦亡相关蛋白及HMGB1蛋水平均显著降低,且HMGB1的表达与细胞焦亡下游的caspase-1蛋白的活化关系密切,这也证明KOA患者膝关节内HMGB1的大量增加与滑膜成纤维细胞发生细胞焦亡有关。
总之,我们的研究证实NLRPs炎性小体介导的滑膜成纤维细胞焦亡可释放大量HMGB1,抑制滑膜成纤维细胞焦亡可显著降低HMGB1的释放,其中caspase-1蛋白的活化可能在其过程中起到重要的促进作用,本研究是首次探讨在KOA中研究滑膜成纤维细胞焦亡与其释放HMGB1的内在分子机制,为临床KOA防治提供一定的理论依据。
