藏北燕麦草地持续利用与撂荒对高寒草甸土壤特征的影响
2021-09-07王明涛方江平包赛很那苗彦军王向涛赵玉红谢文栋仓木德吉
王明涛, 方江平, 包赛很那, 苗彦军, 王向涛, 赵玉红, 谢文栋, 仓木德吉
(1.西藏高原生态研究所, 西藏 林芝 860000; 2.西藏农牧学院动物科学学院, 西藏 林芝 860000;3.那曲市草原站, 西藏 那曲 852000; 4.西藏那曲市申扎县农牧科技服务站, 西藏 那曲 852000)
藏北那曲地区草地面积约0.42亿hm2,占那曲地区总面积的86.40%[1]。该区域是西藏畜牧业重要的生产基地,天然草地生产力较低导致该区域饲草匮乏,建植人工草地提高优质饲草产量是解决当前饲草供需矛盾的重要举措[2]。
已有研究结果表明,随着种植年限的增加,种植人工草地能够有效的增加土壤有机质含量并促进土壤有机碳的形成,土壤中碱解氮、有效磷、速效钾、有机碳、全氮、全磷含量较原生草地明显升高[3]。燕麦(AvenasativaL.)是禾本科燕麦属一年生作物,具有抗旱、耐寒、耐贫瘠等特点,在高寒牧区复杂多变的气候下燕麦具有较好的适应能力,已是青藏高寒牧区不可替代的饲草品种[4]。相关研究显示以燕麦建植一年生人工草地可显著提升草地生产力,缓解天然草地放牧压力,由于不同地域及自然条件的差异导致建植燕麦人工草地对土壤理化性质影响不同,土壤因子的变化将对土壤微生物群落结构多样性产生重要的影响[5-7]。土壤微生物通过自身的生长代谢活动与其它植物、动物或非生物因素相互协调、相互作用调节土壤的养分及循环过程,进而影响植物的生长和植被群落结构特征[8]。因此,土壤微生物数量、群落多样性和群落结构等是评价其所在生态系统是否健康与稳定的几个重要指标[9-11]。目前,国内外学者在不同的土地利用方式、土壤微生物群落结构、环境因子相关性等方面做了大量的研究工作[12-14]。
藏北高寒地区受生长季短暂、缺氧、温度低、紫外线强烈等因素的限制,适宜种植栽培的牧草种类极少,人工草地建植草种多以一年生牧草为主[15]。到目前为止,有关高寒草甸建植人工草地对土壤理化性质和土壤微生物群落影响的研究报道较少。鉴于此,我们选择藏北高寒草甸类草地上建植的一年生燕麦人工草地为研究对象,通过与邻近天然草地的对比,分析长期利用近21 a的一年生燕麦人工草地、撂荒近21 a的一年生燕麦人工草地与邻近天然草地土壤理化性质和土壤细菌群落结构的差异,以期为高寒草甸草地人工草地的持续合理利用、开发及高寒草甸生态建设与保护提供科学依据及参考。
1 材料与方法
1.1 试验地自然概况
西藏自治区那曲市位于青藏高原腹地,区域面积为42万km2,占西藏自治区总面积的1/3,海拔4 500 m以上;属于高原亚寒带季风气候区,高寒缺氧、气候干燥、辐射强,全年大风日数100 d左右,年平均气温-2.2℃,年最低气温达-28.6℃,最高气温为21.9℃;年降水量400 mm左右,降水主要集中在5-9月份;全年日照时数2 886 h以上,无绝对无霜期[16-17]。天然草地主要植被有高山嵩草(KobresiapygmaeaC.B.Clarke),钉柱委陵菜(PotentillasaundersianaRoyle),黑苞风毛菊(SaussureamelanotricaHand.-Mazz),紫花针茅(StipapurpureaGriseb),青海刺参(MorinakokonoricaHao),狼毒(StellerachamaejasmeLinn.),圆齿皱龙胆(Gentianacrenulatotruncata(Marp.)T.N.Ho),青藏雪灵芝(ArenariaroborowskiiMaxim),毛果草(Lasiocaryummunroi(C.B.Clarke)Johnst.),梭罗草(KengyiliaYen et J.L.Yang)等。
1.2 试验方法
1.2.1样地设置与样品采集 试验于2019年8月植物生长旺季进行,通过走访当地住户,与草原主管部门相关人员对人工草地种植年限、种植面积等进行信息核实,确定了3种试验样地连续建植21 a一年生燕麦人工草地(Artificial grassland,AG),每年6月份种植,播种量约240 kg·hm-2,翻耕深度约15 cm,施底肥磷酸二胺为150 kg·hm-2,有灌溉措施;一年生燕麦撂荒草地(Abandoned cultivation grassland,AC),建植时播种与管理方式与AG相近,一次收获牧草后撂荒至今,无人为管理措施,撂荒后与邻近天然草地相一致;邻近天然草地作为对照样地(Natural grassland,NG)(表1)。

表1 试验样地基本信息Table 1 Basic information of the test site
样地土壤样品采集用内径5 cm土钻,按“V”字形路线取样间距2 m,取样土层为0~10 cm,一部分土样带回实验室置于通风处,干燥后去除植物根系、碎石和残体等杂物,磨碎后过0.25 mm筛,用四分法取土样0.5 kg,重复3次,进行土壤理化性质的测定。另一部分土样用车载冰箱带回实验室用-80℃低温冰箱保存,以供测试土壤微生物使用。
1.2.2土壤理化性质测定 土壤理化性质指标的测定采用常规分析方法[18]。土壤容重采用环刀法测定;土壤含水量采用烘干称重法测定;土壤有机质含量采用重铬酸钾氧化外加热法测定;土壤pH值用酸度计电位法测定;土壤全氮含量采用凯氏定氮法测定;土壤全钾含量采用原子吸收-火焰光度计法测定;土壤速效氮含量采用碱解扩散法测定;土壤速效钾含量采用原子吸收-火焰光度计法测定。
1.2.3土壤细菌高通量测定 利用高通量测序技术方法对3个样地共计9份草地土壤样品的细菌菌群V3-V4区进行测序,累积获得664 111条有效序列,各样品平均有效序列数为73 790条。土壤样品总DNA提取使用QIAamp Fast DNA Stool Mini Kit试剂盒,利用引物(5′-ACTCCTACGGGAGGCAGCA-3′)和(5′-GGACTACHVGGGTWTCTAAT-3′)获得细菌16S rRNA基因V3-V4高变异区。扩增经产物回收纯化,采用Illumina公司TruSeq Nano DNA LT Library Prep Kit制备测序文库。由于MiSeq测序读长有限制,同时也为了保证测序质量,选定最佳测序的插入片段范围是200~450 bp。Illumina HiSeq测序分析均由上海派森诺生物科技股份有限公司协助完成。
1.3 数据分析
应用SPSS 21.0软件进行单因素方差分析(One-way ANOVA),采用最小显著差数法(LSD)进行多重比较,P<0.05表示差异显著。QIIME2软件计算微生物Alpha多样性,数据制图使用R软件(R package)绘制主成分分析图(Principal component analysis,PCA),RDA分析图用Canoco 5.0完成[19-20]。
2 结果分析
2.1 土壤理化性质
表2显示0~10 cm土层,人工草地土壤有机质、全钾含量和pH与天然草地无显著差异,土壤全氮、速效氮和速效钾含量显著低于天然草地(P<0.05)。与天然草地相比,撂荒草地土壤pH显著升高,土壤有机质、全氮、速效氮和速效钾含量显著降低(P<0.05)。

表2 土壤理化性质比较分析Table 2 Comparative analysis of soil physical and chemical properties
2.2 土壤细菌多样性
随着测序数量的增加,样品中物种的观察指数稀释曲线逐渐上升,斜率减小,表明样品大多数菌群被覆盖,可足够反映样品中绝大部分细菌物种的信息。如图1所示,人工草地(AG)共检测到OTU数10 217个,撂荒草地(AC)OTU数为8 809个,天然草地(NG)OTU数为8 736个。OTU数由大到小排序为:人工草地(AG)>撂荒草地(AC)>天然草地(NG)。

图1 不同样地稀疏曲线与韦恩图Fig. 1 Rsrefaction curves and venn diagram analysis in different sampling sites
人工草地细菌群落丰富度指数、香农指数和均匀度指数显著高于天然草地(P<0.05)。撂荒草地细菌群落丰富度指数、香农指数和均匀度指数与天然草地无显著差异,人工草地和撂荒草地的系统发育多样性指数与天然草地无显著性差异(表3)。由PCA分析(图2)可知,3个样地的9个样本能够很好的区分,表明细菌群落结构组成存在明显的差异。
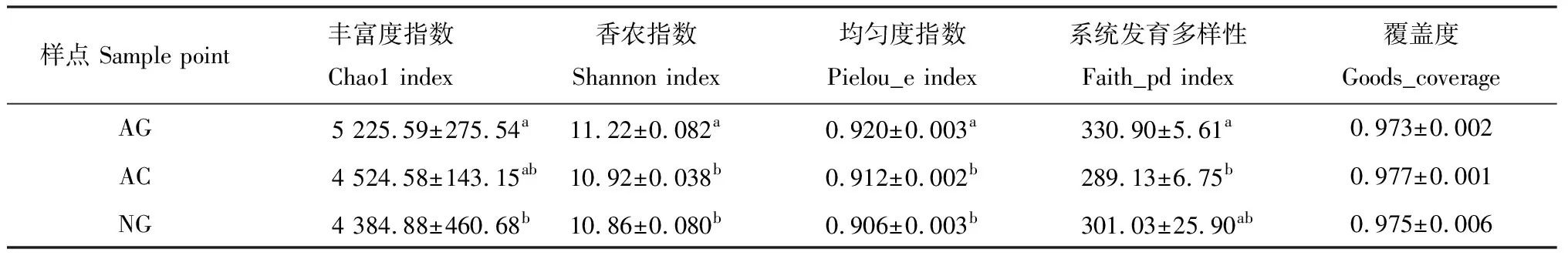
表3 不同样地土壤细菌多样性指数分析Table 3 Analysis of bacterial diversity index in different sampling sites

图2 不同样地细菌组成PCA分析Fig. 2 PCA analysis of different bacterial composition
2.3 土壤细菌群落组成分析
注释结果显示,各样地细菌门水平组成中放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatimonadetes)、拟杆菌门(Bacteroidetes)、已科河菌门(Rokubacteria)、疣微菌门(Verrucomicrobia)、Patescibacteria和消化螺菌门(Nitrospirae)等10个菌门占总相对丰度的近98%,其余菌门相对丰度低于1%,共占近2%。前3个菌门的相对丰度均大于10%,占总丰度的近78%,是不同样地细菌群落中的优势菌门。如图3所示,对比天然草地,人工草地放线菌门、已科河菌门、疣微菌门、Patescibacteria相对丰度显著降低,变形菌门、芽单胞菌门、拟杆菌门相对丰度显著升高(P<0.05);撂荒草地放线菌门、绿弯菌门、Patescibacteria丰度显著降低,酸杆菌门、变形菌门、芽单胞菌门、已科河菌门、消化螺菌门丰度显著升高(P<0.05)。
细菌属水平上,Subgroup_6,RB41,67-14,KD4-96,红色杆菌属(Rubrobacter)、土壤红杆菌属(Solirubrobacter)、鞘氨醇单胞菌属(Sphingomonas)、盖勒氏菌属(Gaiella)、MB-A2-108,Subgroup_7等10个属占总相对丰度的近41%(图4)。对比天然草地,人工草地RB41,67-14,土壤红杆菌属、盖勒氏菌属、MB-A2-108相对丰度显著降低,鞘氨醇单胞菌属相对丰度显著升高(P<0.05)。撂荒草地Subgroup_6、鞘氨醇单胞菌属、Subgroup_7相对丰度显著升高,67-14,KD4-96、土壤红杆菌属、盖勒氏菌属、MB-A2-108相对丰度显著降低(P<0.05)。

图4 细菌属水平下的群落结构组成Fig. 4 Community structure composition of bacteria at genus level注:1.Subgroup_6;2.RB41;3.67-14;4.KD4-96;5.红色杆菌属;6.土壤红杆菌属;7.鞘氨醇单胞菌属;8.盖勒氏菌属;9.MB-A2-108;10.Subgroup_7Note:1. Subgroup_6;2. RB41;3. 67-14;4. KD4-96;5. Rubrobacter;6. Solirubrobacter;7. Sphingomonas;8. Gaiella;9. MB-A2-108;10. Subgroup_7
2.4 土壤因子与细菌群落的关系
为揭示土壤细菌群落与环境因子的关系,以门和属水平上的土壤细菌群落相对丰度作为响应变量,土壤理化因子作为环境解释变量进行了冗余分析(RDA)。如图5所示,门水平上轴1和轴2的解释变量分别为65.99%和32.39%(图5-a),土壤因子对细菌群落结构的影响明显;放线菌门、绿弯菌门和疣微菌门相对丰度与土壤有机质和土壤速效氮含量呈正相关关系;变形菌门、拟杆菌门和芽单胞菌门相对丰度与土壤有机质、土壤全氮、土壤速效氮、土壤全钾和土壤速效钾含量呈负相关关系,与土壤容重呈正相关关系;酸杆菌门、已科河菌门和消化螺菌门相对丰度与土壤含水量、pH、土壤全氮、土壤全钾和速效钾呈正相关关系。属水平上轴1和轴2的解释变量分别达到63.23%和29.96%(图5-b),Subgroup_6、鞘氨醇单胞菌属和Subgroup_7相对丰度与土壤含水量和土壤pH呈正相关关系;RB41、红色杆菌属相对丰度与土壤全氮、土壤全钾和土壤速效钾含量呈正相关关系;67-14,KD4-96、土壤红杆菌属和MB-A2-108相对丰度与土壤有机质和速效氮含量呈正相关关系。

图5 土壤细菌群落与土壤因子的冗余分析Fig. 5 Redundancy analysis(RDA) of soil bacterial community and soil factors注:a,土壤细菌门水平;b,土壤细菌属水平Note:a,Soil bacteria level of phylum;b,Soil bacteria level of genus
3 讨论
3.1 一年生人工草地持续利用与撂荒对土壤理化性质的影响
随着建立年限的增加,人工草地土壤环境得到明显的改善[21-22]。张莉等[23]对人工草地建植后土壤的理化性质进行研究,认为土壤有机质、碱解氮、速效磷含量得到提升,土壤pH值降低。本研究中人工草地的持续利用对土壤有机质含量的影响不明显,土壤全氮、土壤速效氮和速效钾含量显著降低,原因可能是人工草地种植植被和利用方式不同。郝良杰等[24]在人工种植牧草对退化沙质草甸土养分性状的影响研究中发现,种植燕麦与苜蓿(MedicagosativaL.)对于提升土壤有机质含量存在着显著性的差异。魏学红等[21]对人工草地建植改良青藏高原东缘“黑土型”退化草甸的土壤养分进行研究,发现由于地上植被的快速生长利用和消耗,随着人工草地建植年限的增长土壤速效养分含量显著降低,这与本文研究结果相一致。说明一年生燕麦人工草地在长期的利用过程中,植被的快速生长和产量输出消耗了土壤养分,这可能是本研究中土壤全氮、土壤速效氮和速效钾含量显著降低的主要原因。贾倩民等[25]研究不同人工草地对干旱区撂荒地土壤理化性质的影响,发现不同牧草建植的人工草地土壤有机质、全氮、速效氮和速效磷含量均显著高于撂荒地。本研究发现,与天然草地相比撂荒草地土壤pH显著升高,土壤有机质、全氮、速效氮和速效钾含量显著降低,表明一年生人工草地撂荒导致土壤养分含量降低。
3.2 一年生人工草地持续利用与撂荒对土壤细菌群落的影响
土壤微生物细菌OTU数量是反映土壤微生物最基本特征的一个重要指标,分类单元OTU数量通常代表不同微生物物种,OTU数量越多代表着微生物种类越多[26]。本研究中,人工草地和撂荒草地土壤细菌OTU数量升高,其中人工草地升高幅度最大。Sun等[27]研究了不同翻耕深度和季节对土壤微生物的影响,认为土壤表层5 cm的长期耕作措施增加了土壤微生物的数量;郭婷[28]研究了草甸黑土的耕作和施肥对细菌多样性的影响,认为深耕处理使土壤中微生物的含量提高,与本研究结果相一致。其原因可能是土壤的翻耕方式使土壤表面的植物的残枝落叶或施加的肥料更好的转移到土壤深层,翻耕使土壤变得更加疏松,增加了土壤的孔隙度,透气性增高,有利于微生物生存和生长。因此,土壤微生物数量得到明显的提升。PCA分析表明,人工草地近21 a的持续利用改变了土壤细菌群落的结构组成,这可能是人工草地细菌群落多样性显著升高的主要原因。撂荒草地与人工草地不同,翻耕与施肥等人工干预较少(仅有1次),因此土壤细菌多样性与天然草地无显著差异。
研究发现放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、变形菌门(Proteobacteria)是3个样地土壤细菌结构组成中的优势菌门,这与大多数草地土壤细菌多样性研究结果相一致[29-31]。已有的研究结果认为,放线菌门与适应环境及抵御外界干扰有关;变形菌门是世界上最为普遍的菌门之一,其与土壤碳的利用有关;酸杆菌门与土壤的贫瘠程度有关[32-33]。本研究中,与天然草地相比,人工草地和撂荒草地放线菌门丰度显著降低,表明2种草地的利用方式使草地对抗外界干扰的能力在下降;变形菌门丰度显著升高,可能是土壤扰动使土壤中的碳在被持续消耗,具体原因还有待进一步研究;撂荒草地酸杆菌门丰度升高和绿弯菌门丰度降低(P<0.05),这是土壤贫瘠的表现。对比天然草地,撂荒草地土壤细菌Subgroup_6和Subgroup_7相对丰度显著升高,RB41属相对丰度较高,3者均属于酸杆菌门[34],可能是撂荒草地酸杆菌门丰度显著升高的主要原因。
3.3 土壤细菌群落与土壤环境因子的关系
大量研究表明,土地的利用方式是影响土壤质量的主要因素,通过植物特征、管理方式等影响土壤理化性质,进而影响土壤细菌群落结构与组成[35-36]。土壤pH被认为是影响土壤细菌分布和群落结构组成的重要因素[37-38]。本研究发现,土壤含水量、pH、土壤容重、有机质含量、全氮含量、速效氮含量、全钾含量和速效钾含量是细菌门、属水平的群落结构组成的主要作用因子。酸杆菌门相对丰度与pH呈正相关关系,与邓楚璇等[39]在土地利用方式对土壤微生物群落结构影响的研究结果一致。本研究中放线菌门、变形菌门相对丰度与pH呈负相关关系,这是因为高寒地区土壤整体营养状况较差,土壤pH偏碱性[37]。土壤容重可以影响土壤的透气性、持水能力,进而影响到微生物的活动[40]。变形菌门、拟杆菌门和芽单胞菌门与土壤容重呈正相关关系,表明3个菌门具有较强的生态适应能力。盖勒氏菌属、MB-A2-108、67-14、土壤红杆菌属相对丰度与土壤有机质、土壤全氮、土壤速效氮、土壤全钾和土壤速效钾含量呈正相关关系,反映出4个菌属对土壤养分的偏好。细菌群落属水平上还有大量的未知或不可培养类群,占主要菌属(排序前10属)总丰度值的近62.95%,其作用功能等还有待进一步的研究。
4 结论
高寒草甸类草原建植一年生燕麦人工草地与天然草地相比,土壤全氮、土壤速效氮和速效钾含量显著降低;撂荒导致土壤pH显著升高,土壤有机质、全氮、速效氮和速效钾含量显著降低。近21 a的人工草地持续利用不仅改变了土壤细菌群落结构的组成方式,也明显提升了细菌群落的多样性;撂荒没有改变土壤细菌群落多样性,但改变了细菌群落结构组成。因此,高寒草甸建植一年生人工草地在持续利用的过程中应注意土壤速效养分的补给,以免影响草地的生产力。对撂荒草地应及时采取恢复技术措施,避免撂荒草地发生退化。
