贵州不同地区“生花”糟辣椒中微生物多样性研究
2021-09-03王雪雅蓬桂华孙小静李文馨
王雪雅,陆 宽 ,殷 勇,蓬桂华,孙小静,李文馨
(1.贵州省农业科学院 辣椒研究所,贵州 贵阳 550006;2.贵州省生物技术研究开发基地,贵州 贵阳 550002)
糟辣椒(fermented pepper)是贵州主要的民族特色辣椒制品之一,是将新鲜红椒辅以姜、蒜、食盐剁碎块后以乳酸菌为优势菌发酵而成的调味品,口感爽脆,香辣适宜,风味酸香。糟辣椒在贮藏过程中易受到腐败微生物污染出现“生花”现象。“生花”,也称产膜,是指微生物在腌制蔬菜表面形成的一层白膜或少数白斑,引起该现象的微生物主要为芽孢杆菌(Bacillus)、假丝酵母(Candida)、毕赤酵母(Pichia pastoris)等[1]。汉逊酵母(Hansenula polymorpha)、毕赤氏酵母等发酵力低的产膜酵母在有氧条件下迅速生长繁殖形成大量的菌醭,赋予“菌醭”味,同时还造成发酵液浑浊[2],不仅分解组织内有机物质,同时发酵生成的乳酸和其他酯类等代谢物质,致使制品酸度下降和腐败变质,影响产品品质风味[3]。JEON S B等[4]对四川省不同城市采集的7份腐烂泡菜样品进行研究,发现泡菜形成膜醭的微生物均为真菌。目前对糟辣椒的保质方法主要有两种,一是热力消毒灭菌法,通过高温杀灭糟辣椒中微生物,但该方法对糟辣椒的口感和风味均有较大的影响;二是添加化学防腐剂,如山梨酸钾、苯甲酸钠等人工合成的化学防腐剂,该方法对风味、品质影响较小,但有一定的毒副作用,长期使用造成食用安全隐患。因此,开发绿色、安全、无害的天然防腐剂或抑菌剂是今后食品贮藏保鲜技术的研究热点。
目前,发酵辣椒的研究主要集中在优势菌的筛选和多样性分析方面,韩俊燕等[5]对家庭自制的剁辣椒、酸辣椒、腌辣椒和辣椒酱进行MiSeq高通量测序分析样品中细菌的多样性,RIELA L等[6]从受污染辣椒酱罐头中分离到曼氏毕赤酵母(Pichia manshurica)和弯曲乳杆菌(Lactobacilluscurvatus);李玲玲等[7]从腐败的黄灯笼辣椒酱中分离纯化到11种细菌、1种酵母菌、8种霉菌,GARCÍA-DIEZ J等[8]利用平板挖井扩散法从新鲜切断辣椒中分离出4株腐败菌。本研究通过Miseq高通量测序技术进行微生物多样性差异分析,结合传统微生物培养分离方法、16S rDNA序列分析技术和引物内转录间隔区(internal transcribed spacer,ITS)序列分析技术筛选引起糟辣椒“生花”现象的主要微生物,并对分离菌株进行发酵特性试验及回接试验,研究“生花”糟辣椒中的微生物多样性,并分离纯化引起“生花”现象的菌株,可为糟辣椒绿色安全的天然保质技术的开发提供试验基础,以期为糟辣椒绿色、安全保质技术的开发提供新的思路。
1 材料与方法
1.1 材料与试剂
1.1.1 糟辣椒样品
选取贵州省不同地区“生花”的糟辣椒样品:1号样品采集自贵阳(编号GY);2号样品采集自遵义乌江(编号WJ);3号样品采集自黔南龙里(编号LL);4号样品采集自毕节大方(编号DF)。以上样品均为农户自制,存放于土陶发酵坛中,食用时开盖即取;样品表面附有一层碎花状的白斑,取样时,利用已灭菌的器具,均匀取样。
1.1.2 化学试剂
糖发酵生化鉴定管:青岛日水生物技术有限公司;ExTaq酶(5 U/μL)、基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒、DNA回收试剂盒:天根生化科技(北京)有限公司;FastDNASpin Kit for Soil试剂盒:美国MP Biomedicals公司;AxyPrep DNA凝胶提取试剂盒:美国Axygen Biosciences公司;QuantiFluorTM-ST微型荧光剂:美国Promega公司;10×Taq缓冲液、脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphates,dNTPs)、DNA聚合酶、琼脂糖:上海生工生物公司;QIAquick胶回收试剂盒:安倍医疗器械贸易(上海)有限公司。其他试剂均为国产分析纯或生化试剂。
1.1.3 培养基
营养琼脂(nutrient agar,NA)培养基、马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基、察氏(Czapek's,CZ)培养基:北京陆桥技术股份有限公司;产氨培养基:100 mL/L脱脂牛乳,0.5 g/L NaCl,0.5 g/L精氨酸、奈氏试剂。105 ℃灭菌15 min。
1.2 仪器与设备
FSH-2A高速均质机:常州越新仪器制造有限公司;TGL-24MC离心机:长沙平凡仪器仪表有限公司;PB-10赛多利斯pH计:赛多利斯科学仪器(北京)有限公司;CRH-150生化培养箱:上海一恒科学仪器有限公司;SW-CJ-K超净工作台:苏州华宏净化技术有限公司;THZ-C-1恒温振荡器:苏州培英实验设备有限公司;5331梯度聚合酶链式反应(polymerase chain reaction,PCR)仪:德国Eppendorf公司;Nano Drop-2000超微量分光光度计:美国Nano Drop公司;QuantusTM荧光计:美国Promega公司;Illumina Miseq PE300测序仪:美国Illumina公司。
1.3 方法
1.3.1 高通量测序分析
糟辣椒菌群总DNA提取:菌群总DNA的提取采用FastDNASpin Kit for Soil试剂盒,按产品说明书要求对所有样品进行DNA抽提,使用1%的琼脂糖凝胶电泳检测DNA的提取质量,使用NanoDrop-2000测定DNA浓度和纯度。
PCR扩增产物与测序[9]:以提取的DNA为模板,细菌使用799F(5'-AACMGGATTAGATACCCKG-3')和1193R(5'-ACGTCATCCCCACCTTCC-3'')对16S rRNA基因V5-V7可变区进行PCR扩增,扩增条件为:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,共35个循环;72 ℃再稳定延伸10 min,在4 ℃进行保存。PCR扩增体系为:5×TransStart FastPfu缓冲液4 μL,dNTPs(2.5 mmol/L)2 μL,上、下游引物(5 μmol/L)0.8 μL,TransStart FastPfu DNA聚合酶0.2 μL,模板DNA10 ng,加双蒸水(ddH2O)补足至20 μL。每个试验重复3次。
真菌ITS扩增区引物为ITS1F(5'-CTTGGTCATTTA GAGGAAGTAA-3')和ITS2R(5'-GCTGCGTTCTTCATCGATGC-3')。PCR扩增条件为:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,40个循环;72 ℃再稳定延伸10 min,在4 ℃进行保存。PCR扩增体系为:5×TransStart FastPfu缓冲液2 μL,dNTPs(2.5 mmol/L)2 μL,上、下游引物(5 μmol/L)0.8 μL,TransStart FastPfu DNA聚合酶0.2 μL,模板DNA 10 ng,加双蒸水(ddH2O)补足至20 μL。每个试验重复3次。
高通量测序分析:将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物,采用AxyPrep DNA Gel Extraction Kit对回收产物进行纯化,经2%琼脂糖凝胶电泳检测后,用QuantusTM荧光仪对回收产物进行检测定量。使用NEXTFLEX Rapid DNA-Seq Kit建库,文库质检合格后,利用Illumina公司的Miseq PE300平台由上海美吉生物医药科技有限公司进行高通量测序。数据处理使用Fastp[10]软件对原始测序序列进行质控,FLASH[11]软件进行拼接,使用UPARSE[12](https://drive 5.com/uparse/)软件根据97%[13-14]的相似度对序列进行操作分类单元(operational taxonomic units,OTU)聚类并剔除嵌合体。利用核糖体数据库项目(ribosomal database project,RDP)Classifier(https://rdp.cme.msu.edu)对每条序列进行物种分类注释,比对Silva 16S rRNA数据库(Version 138),设置比对阈值为70%。
1.3.2 “生花”糟辣椒样品中微生物的提取、分离及纯化[15-16]
在无菌操作条件下,称取25 g“生花”糟辣椒样品,加到225 mL无菌水中,在摇床中振荡30 min制成1∶10的样品均液,吸取1 mL上清液,选择3个合适稀释梯度,涂布于对应的培养基上,每个稀释度做3个平行,接种至NA培养基(37 ℃,24 h)和PDA培养基(28 ℃,48 h)中,均倒置培养,培养完成后挑取单菌落进行多次划线分离、纯化培养,获得单个菌落并进行编号记录备用。
1.3.3 分离菌株的分子生物学鉴定
真菌采用引物内转录间隔区(internal transcribed spacer,ITS)Sanger测序[17]:取1.5 mL离心管,挑取纯化过得单菌落置入100 μL无菌水中,轻微振荡,取1 mL菌液,以4 000 r/min(4 ℃)离心2 min得到细胞沉淀,去上清,用1 mL无菌水清洗菌体2次,以酵母全基因组为模板,以引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')进行ITS序列扩增,PCR扩增体系(20 μL),正反引物各1 μL,DNA模板0.5 μL,10×ExTaqbuffer 2.0 μL,ExTaq(5 U/μL)0.2 μL,dNTP Mix(2.5 mmol/L)1.6 μL以及ddH2O 13.7 μL;PCR扩增程序:95 ℃预变性5 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1.5 min,25个循环;72 ℃再延伸10 min,最后降温至10 ℃。扩增产物采用2%的琼脂凝胶进行电泳检测,将合格的ITS序列送至上海美吉生物医药科技有限公司。
细菌16S rDNA鉴定[18]:取1.5 mL离心管,挑取纯化过的单菌落置入100 μL无菌水中,轻微振荡,置于PCR仪中95~100 ℃处理10 min,8 000 r/min离心3 min,取上清液作为DNA模板,-20 ℃保存备用。PCR扩增采用16S rDNA通用引物,正向引物27F:5'-AGAGTTTGATCCTGGCTCAG-3';反向引物1492R:5'-TACGGCTACCTTGTTACGACTT-3';PCR扩增体系:正反引物各1 μL,DNA模板0.5 μL,10×Ex-Taqbuffer 2.0 μL,ExTaq(5 U/μL)0.2 μL,2.5 mmol/L dNTP Mix1.6 μL以及ddH2O13.7 μL。PCR扩增程序:95 ℃预变性5 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1.5 min,25个循环;72 ℃延伸10 min,最后降温至10 ℃。1%琼脂糖凝胶电泳检测PCR反应产物结果,30 min后再紫外灯下观察结果并拍照记录,并将PCR产物送至上海美吉生物医药科技有限公司测序,测序结果同上述真菌测序结果一样处理。
将测序结果提交美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对,确定与已报道的微生物16S rDNA基因核苷酸序列的同源性。分别下载每个序列相似性最高的同源序列及其种属代表性微生物的ITS序列,采用Clustal W1.8软件进行多序列比对。采用MEGA 6.0软件中的邻接(neighbor-joining,NJ)法构建分子进化树,并进行系统发育分析。
1.3.5 菌种发酵特性试验
糖发酵试验参照顾春涛[19]的方法;产氨、产酸、产膜、产黏试验参照蔡炯等[20]的方法。
1.3.6 回接验证试验
为进一步确认引起糟辣椒“生花”的主要微生物,将已发酵成熟的未“生花”糟辣椒采用无菌离心管密封包装后采用60Co-γ射线辐照灭菌处理,3 kGy剂量γ辐照样品重复3次,方法参照文献[21]。用上述分离纯化获得的菌株扩大培养[22],分别接入装有50 mL相应液体培养基的锥形瓶中,在30 ℃、160 r/min的条件下恒温振荡培养,至对数期取出,然后在4 ℃条件下,11 000 r/min离心15 min,弃去上清液,加无菌生理盐水进行重悬,反复吹打液体,重复3次以上操作,最后将菌种浓度调至108CFU/mL的数量级,4 ℃条件下保存备用。以接种量2%(V/V)转接量转接至糟辣椒中,以接种菌的糟辣椒为试验组,以不接菌的糟辣椒为空白组(CK),每组3个平行,于28 ℃恒温培养30 d,每天观察是否“生花”,以验证其致“生花”性。
2 结果与分析
2.1 样品中微生物Alpha多样性分析
在97%相似性水平条件下采集OTU信息,进行“生花”糟辣椒样品中微生物菌群Alpha多样性分析,获得Shannon、Simpson、ACE、Chao1指数及Coverage,结果见表1。

表1 “生花”糟辣椒样品微生物菌群Alpha多样性分析结果Table1 Results of Alpha diversity analysis of microbial flora in "Shenghua" fermented pepper samples
在Alpha多样性分析中,Chao1和ACE指数用于衡量物种丰度,值越高表明群落物种的丰富度越高,Shannon和Simpson指数用于衡量物种多样性,Shannon指数越高、Simpson指数越低,表明群落物种的多样性越高[23]。由表1可知,获得细菌和真菌的有效序列数分别为97 306条、288 570条,4个样品的OTU覆盖率(Coverage)均为99.9%以上,表明绝大部分物种均能检出,本次实验建立的文库能真实有效的反应样品细菌和真菌的多样性,所有样品中细菌和真菌OTU数量最多的是GY样品,细菌、真菌OTU数分别为257条、7条,DF样品中细菌OTU数量最少(26条),ZY样品中真菌OTU数量最少(3条),表明GY样品中微生物种类和数量较多,其余3个样品OUT数量差异不大。4个样品中,GY样品的细菌和真菌Chao1和ACE指数最高,细菌分别为257.097、257.771,真菌分别为8.000、10.667,说明GY样品物种丰度最高。物种多样性方面,GY样品中细菌的Shannon指数最高(2.477),LL样品最低(0.620),说明GY样品不仅物种丰度高,多样性也高;DF样品中真菌的Shannon指数最高,Simpson指数最低,表明DF样品的真菌物种多样性高。综上所述,贵州不同区域的“生花”糟辣椒微生物物种差异性较大。在收集的样品中,GY样品中细菌和真菌物种丰度相对最高,细菌的物种多样性最复杂,DF样品中真菌的物种多样性最高。
2.2 基于门、属分类学地位的菌群结构分析
2.2.1 基于门水平样品菌群结构分析
本研究将平均相对含量>1.00%的真菌门或属定义为优势门或属,将不能鉴定到门或者属水平的序列归并为“unclassified”,将其他<1.00%的门或属求和后归并为“others”。基于门水平的贵州不同地区“生花”糟辣椒样品细菌和真菌菌群组成见图1。
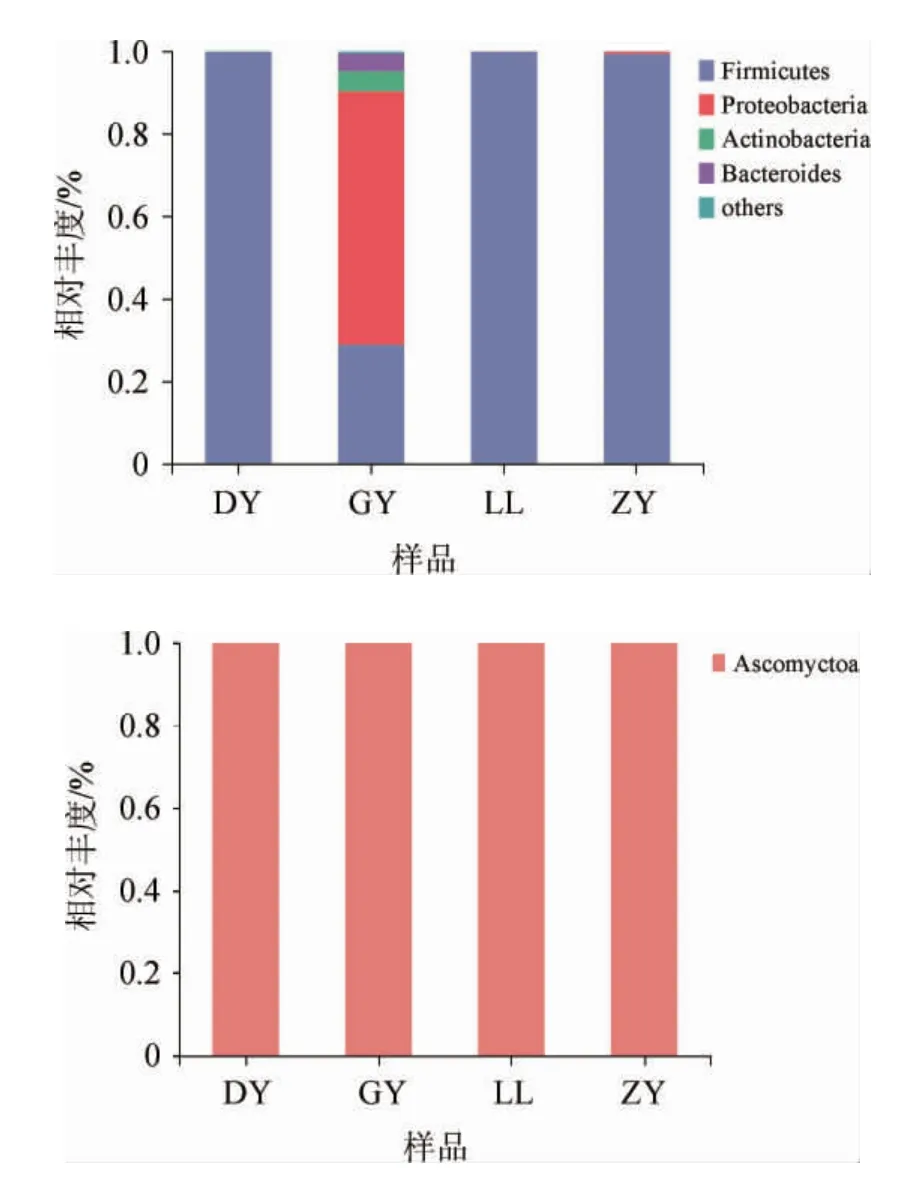
图1 基于门水平的4个样品的细菌(a)和真菌(b)组成Fig.1 Composition of bacteria (a) and fungi (b) in 4 samples based on phylum level
由图1可知,4个样品共检测出4个主要细菌门和1个真菌门,细菌门分别是分别为厚壁菌门(Firmicutes)、变形杆菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroides),真菌门为子囊菌门(Ascomyctoa),该结果与宁明等[24]检测的发酵辣椒中在门水平上细菌结果相似。由图1a可知,4个样品均检测到厚壁菌门、变形杆菌门、放线菌门,但是相对丰度差异较大,其中GY样品的微生物组成与其他样品差异较大,变形杆菌门(61.29%)是GY样品中的优势菌门,但是其余3个样品中该菌门占比低,其在DF、LL、ZY样品中占比分别为0.001%、0.06%、0.64%;厚壁菌门为DF(99.79%)、LL(99.91%)、ZY(99.32%)样品中主要优势菌门,其余的细菌门组成仍有一定差异,DF、ZY样品中未检测到拟杆菌门。由图1b可知,门水平上,4个样品真菌组成中只有一个子囊菌门,真菌丰度无差异。由此可知,在门水平上,贵州不同地区“生花”糟辣椒的细菌组成存在差异,GY样品的细菌相对丰度高,变形杆菌门、厚壁菌门占优势,微生物种类比其余3个样品更为丰富。
2.2.2 基于属水平样品中细菌菌群结构分析
基于属水平样品中细菌的组成及相对含量见表2。
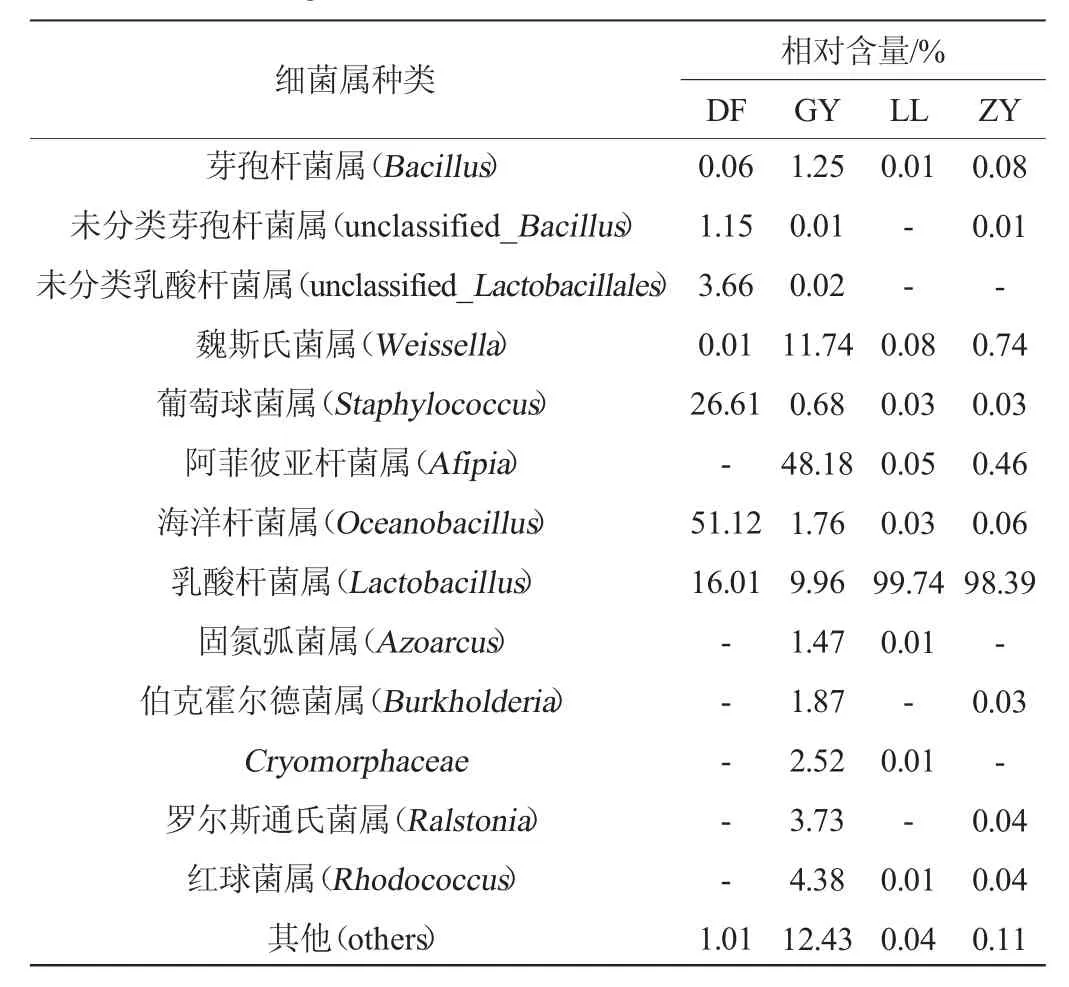
表2 基于属水平样品中细菌菌群组成及相对含量Table2 Composition and relative contents of bacterial flora in samples based on genus level
由表2可知,4个样品由于发酵条件、贮藏环境不同,细菌菌落组成和比例均不同,共检测出13个主要细菌属,位于前5为的菌属为乳杆菌属(Lactobacillus)、海洋杆菌属(Oceanobacillus)、葡萄球菌属(Staphylococcus)、阿菲彼亚杆菌属(Afipia),与前期的研究结果一致,乳杆菌属、海洋杆菌属、红球菌属均为发酵的优势菌属[25-27]。GY样品中的细菌多样性比其余3个样品的丰富,主要优势菌属为阿菲彼亚杆菌属(Afipia)(48.18%)、魏斯氏菌属(Weissella)(11.74%)、Lactobacillus(9.96%)、其他细菌属(12.43%),在其余3个样品中相对含量较低(0.05%~0.46%),DF样品中未检测出;DF样品的主要优势菌属为Oceanobacillus(51.12%)、Staphylococcus(26.61%),但其余3个样品中Oceanobacillus的相对含量为0.03%~1.76%,Staphylococcus相对含量为0.03%~0.68%,与DF样品差异大;LL、ZY样品的细菌属相较为单一,优势菌属为Lactobacillus,相对含量分别为99.74%、98.39%;乳杆菌属是一类厌氧菌,在发酵过程中可改善风味,产生有机酸和蛋白酶等[28-31]。由此可知,贵州不同地区的“生花”糟辣椒细菌属构成差异性大,由于糟辣椒制作完成后放置于发酵坛中,食用时开盖取出,导致不同的贮藏环境和条件导致样品接触到的微生物种类不一,并且采集样品时,LL、ZY样品均已发生“生花”,由于优势菌属为乳杆菌属,表明占比较低的其他细菌或真菌属是导致糟辣椒出现白色璞膜的主要微生物。
2.2.3 基于属水平样品中真菌菌群结构分析
4个糟辣椒样品真菌在属水平上的组成及相对含量见表3。

表3 基于属水平样品中真菌菌群组成及相对丰度Table3 Composition and relative content of fungi flora in samples based on genus level
由表3可知,4个样品中真菌属的菌群结构和各有差异,共检测到3个主要真菌属和1个其他未分类的菌属,分别为汉斯德巴氏酵母菌属(Debaryomyces)、异常威克汉姆酵母属(Wickerhamomyces)、毕赤酵母属(Pichia)、伊萨酵母属(Issatchenkia)。DF样品的真菌多样性相对其余3个样品丰富,优势真菌属为异常威克汉姆酵母属(Wickerhamomyces)(85.41%),其余3个样品中仅有GY样品检测出(1.88%),LL和ZY样品均未检出该菌属,德巴利氏酵母属(Debaryomyces)(14.11%)是DF样品中第二位优势菌属,但在其余样品中未检出,表明DF样品与其他样品差异性最大;GY样品中检测出的真菌属有3个,分别为伊萨酵母属(Issatchenkia)(95.15%)、毕赤酵母属(Pichia)(2.97%)、异常威克汉姆酵母属(Wickerhamomyces)(1.88%);LL、ZY样品真菌组成较为单一,但其优势真菌属不同,LL样品的优势菌属为Pichia(99.97%);ZY样品的优势菌属为伊萨酵母属(Issatchenkia)(99.99%)。综上可知,贵州不同地区收集的“生花”糟辣椒样品真菌组成差异性大,其中DF样品真菌多样性丰富,LL、ZY样品真菌组成较为单一,由于样品已“生花”,初步认为菌属Issatchenkia、Pichia、Wickerhamomyces、Debaryomyces与糟辣椒产生异味、“生花”等现象有一定的关联。
2.3 样品中微生物的鉴定
2.3.1 真菌的分子生物学鉴定
由图2可知,以真菌基因组DNA为模板,引物为ITS1及ITS4,通过真菌的特异性PCR反应扩增,用1%琼脂糖凝胶电泳检测均扩增产生了单一的DNA片段条带,与DNA Marker对比显示,碱基片段在500~750 bp之间。菌株LJS1-LJS12序列长度分别为537 bp、576 bp、605 bp、630 bp、624 bp、632 bp、672 bp、705 bp、712 bp、678 bp、681 bp、692 bp,均符合真菌ITS序列长度。

图2 样品中筛选真菌的ITS序列PCR扩增产物电泳图Fig.2 Electrophoresis of PCR amplification products of ITS sequence of screened fungi from samples
基于ITS序列构建的系统发育树见图3。由图3可知,菌株LJS1、LJS2、LJS3与数据库中Pichia kudriavzevii(GenBank号LC389035.1)同源性最高(100%),聚于相同分支,亲缘关系最近,菌株LJS1、LJS2、LJS3被鉴定为库德里阿兹威氏毕赤酵母(Pichia kudriavzevii);该三菌株来自ZY样品,与菌落形态判定的结果相符。菌株LJS4、LJS5、LJS6、LJS7与数据库中的Pichia membranifaciens(GenBank序列号AY349435.1)同源性最高(100%),4株菌被鉴定为膜璞毕赤酵母(Pichia membranifaciens)。菌株LJS10与数据库中的Debaryomyces hansenii(GenBank序列号KY105881.1)同源性最高(100%),菌株LJS10鉴定为汉逊德巴利酵母(Debaryomyces hansenii),来源于DF样品;菌株LJS8、LJS9、LJS11、LJS12同数据库中的Wickerhamomyces anomalus(GenBank序列号KP132887.1)同源性最高(100%),鉴定为异常威克汉姆酵母(Wickerhamomyces anomalus)。
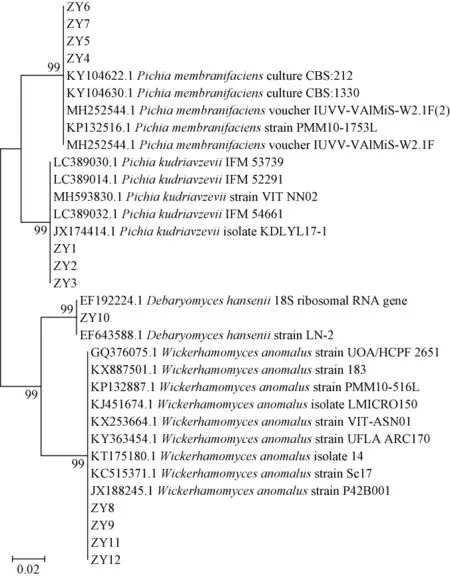
图3 基于ITS序列样品中筛选真菌的系统发育树Fig.3 Phylogenetic tree of screened fungi in samples based on ITS sequence
2.3.2 细菌分子生物学鉴定
由图4可知,电泳检测结果显示糟辣椒分离细菌在约1500bp处有目的条带。菌株XY1~XY3序列长度在1435bp、1 443 bp、1 421 bp,均符合细菌16S rDNA序列长度。

图4 筛选细菌16S rDNA序列PCR扩增产物电泳图Fig.4 Electrophoresis of PCR amplification products of 16S rDNA sequence of screened bacteria
将16S rDNA序列通过BLAST比对,并构建系统发育树,见图5。由图5可知,细菌XY1、XY2的基因序列与数据库中的布氏假单胞菌(Pseudomonas brenneri)(GenBank号JX417436.1)同源性最高,从进化树分支可以看出XY1、XY2菌株同Pseudomonas brenneri处于同一分支上,亲缘关系最近,根据形态特征及16S rDNA序列进化分析鉴定,可以确认XY1、XY2属于布氏假单胞菌,分离于GY、DF样品。细菌XY3序列与数据库中的雅马纳假单胞菌(Pseudomonas yamanorum)(GenBank号MG269619.1)同源性最高,从进化树分支上看,XY3同Pseudomonas yamanorum在一个分支上,亲缘关系最近,根据形态特征及16S rDNA序列进化分析鉴定,可以确认XY3属于雅马纳假单胞菌,从GY样品中分离。

图5 基于16S rDNA序列筛选细菌的系统发育树Fig.5 Phylogenetic tree of screened bacteria based on 16S rDNA sequence
2.4 筛选菌株发酵特性试验
选取上述筛选到不同种的菌株进行发酵特性试验,包含糖发酵试验和腐败试验,糖发酵试验主要用于研究酵母菌对糖的利用能力,酵母菌在无氧气条件下能分解糖类,产生各种有机酸、气体和其他产物[32]。
由表4可知,菌株LJS10对所有糖类有较好分解能力;菌株LJS1、LJS4结果一致,能利用果糖、乳糖、半乳糖、蔗糖、海藻糖、葡萄糖,不能利用木糖和麦芽糖;菌株LJS11只能利用果糖、木糖、葡萄糖、麦芽糖,其余4种糖不能利用;两株细菌XY1、XY3的糖发酵试验结果相同,对木糖、乳糖、半乳糖、麦芽糖不能利用。腐败试验结果表明,2株细菌均呈阴性,4株酵母菌皆产酸、产黏,可能是导致糟辣椒液黏稠的腐败菌,除菌株LJS11不产膜外,其余3株酵母菌皆具有一定的产膜能力,可能是引起糟辣椒产生“生花”现象的真菌。菌株LJS10、LJS11在产氨试验表现为阳性,表明有可能同糟辣椒异味的形成有关,菌株LJS1、LJS4为阴性,结果与王斌[33]的研究结果相符。产酸菌株导致糟辣椒酸化,产氨的菌株会产生异味,产膜、产黏的菌株导致糟辣椒“生花”产膜,降低糟辣椒的品质。

表4 筛选菌株发酵特性试验结果Table4 Experimental results of fermentation characteristics of screened strains
2.5 回接试验验证
为进一步确认引起糟辣椒“生花”的主要微生物,采用60Co-γ射线3 kGy剂量γ辐照对糟辣椒进行杀菌后,无菌条件下接入以上4种菌,28 ℃恒温培养箱培养一段时间,辣椒腐败现象见表5。

表5 糟辣椒“生花”腐败现象Table5 Spoilage phenomenon of "Shenghua" fermented pepper
由表5可知,糟辣椒接菌培养72 h后,4种糟辣椒均有产气现象,其中接种菌株LJS1、LJS10、LJS4的糟辣椒,发酵产气速度明显优于其他菌株。继续培养发现,接种菌株LJS1、LJS10、LJS4的糟辣椒分别于第10 天、第12天、第14天有璞膜“生花”现象产生,并伴有异味,其中接种菌株LJS1的糟辣椒表现出较快地“生花”;细菌组XY1、XY3有轻微的产气现象出现,气味、形态无明显变化;CK组样品在第12天形态正常,其他无明显变化。通过回接试验的结果可验证分离获得的4株酵母菌均是导致糟辣椒贮藏过程中发生“生花”现象的主要菌株。
3 结论
采用Miseq高通量测序技术、传统培养分离法结合引物内转录间隔区(internal transcribed spacer,ITS)序列分析技术对贵州4个地区的“生花”糟辣椒中微生物进行多样性分析和菌种分离鉴定,并对分离菌株进行特性试验及回接试验,确定引起糟辣椒“生花”现象的主要微生物。结果表明,获得细菌和真菌的有效序列分别为973 06条、288 570条,OTU覆盖率在99.9%以上。在门水平上,4个样品共检测出4个主要细菌门和1个真菌门;在属水平上,4个样品共检测出13个主要细菌属及3个主要真菌属。引起糟辣椒出现“生花”现象的4株酵母菌分别为:库德里阿兹威氏毕赤酵母(Pichia kudriavzevi)、膜璞毕赤酵母(Pichia membranifaciens)、汉逊德巴利酵母(Debaryomyces hansenii)、异常威克汉姆酵母(Wickerhamomyces anomalus)。本实验可为后期研究提供试验基础及供试菌株,为糟辣椒绿色、安全的保鲜技术的开发提供有力的保障。应该提出防控“生花”现象的建议措施。
