刺五加苷提取物调控PI3K/AKT信号通路对糖尿病小鼠糖代谢的作用及机制
2021-09-01隋春红吴沚蒙耿泽男
隋春红 , 吴沚蒙 , 耿泽男 , 姚 璐 , 罗 军 , 安 英 , 张 巍 , 王 程
(吉林医药学院药学院 , 吉林 吉林 132013)
在临床治疗2型糖尿病(Type 2 diabetes mellitus,T2DM)过程中发现,多种中药均能提取到有效的降糖活性成分,来源广泛、种类丰富[1]。中药降糖活性成分具有良好的降糖作用,不仅对人体产生的副作用小,而且可发挥多环节、多靶点的综合作用,具有独特优势[2]。刺五加苷提取物(Acanthopanaxsenticosusglycosides extract,ASGE)主要含有刺五加苷B(紫丁香苷)、刺五加苷E和三萜皂苷等化合物,具有降低空腹血糖,缓解胰岛素抵抗及防治糖尿病并发症的功效[3],其作用机制与多方面因素有关。ASGE可通过调节机体氧化还原平衡,抵御糖尿病引起的氧化应激损伤[4],ASGE亦可通过调控物质和能量代谢,纠正糖尿病导致的物质代谢紊乱[5]和能量代谢障碍[6],ASGE还能通过改善血液流动性以减少组织细胞的耗氧量,缓解糖尿病发生过程中胰岛素B细胞的损伤[7]。基于网络药理学深入研究其分子机制发现,ASGE发挥降糖作用可能与丝裂原蛋白激酶信号通路、环磷酸腺苷信号通路、酪氨酸蛋白激酶信号通路等多种信号转导途径有关[8]。磷脂酰肌醇-3-激酶(Phosphatidylinositol 3 kinase,PI3K)/蛋白激酶 B(Protein kinase B,PKB/Akt)信号通路是胰岛素发挥作用的主要信号通路之一,与糖尿病密切相关。PI3K是胰岛素受体(Insulin receptor,IR)的重要下游分子,与胰岛素受体底物(Insulin receptor substrate,IRS)结合并被活化,催化产生第二信使3,4,5-三磷酸磷脂酰肌醇并使Akt激活,Akt发挥蛋白激酶活性磷酸化叉头框蛋白1(Forkhead box O1,FoxO1)等下游分子,进而调节多种糖代谢相关酶类及葡萄糖转运体(Glucose transporters,GLUT),发挥调节糖代谢的作用[9]。故此,为明确ASGE通过调控PI3K/Akt信号通路对糖尿病小鼠糖代谢的作用及其分子机制,本试验利用链脲佐菌素(Streptozotocin,STZ)致T2DM小鼠模型为研究对象,以二甲双胍(Metformin)为阳性药物对照,初步探讨ASGE通过PI3K/Akt信号通路降低血糖的分子机制,为刺五加在糖尿病治疗方面的应用提供药理学依据。
1 材料与方法
1.1 主要试剂 ASGE由课题组自制,采用超声波辅助乙醇提取,正丁醇萃取后AB-8大孔树脂纯化,经高效液相色谱分析鉴定其主要成分为刺五加苷B和刺五加苷E,并含有少量吡喃阿洛糖苷、齐墩果烯糖苷、罗盘草苷等其他苷类物质[10]。二甲双胍、STZ(美国Sigma公司,批号分别为BCBT7573和WXBC3087V);小鼠胰岛素酶联免疫检测试剂盒、血糖含量检测试剂盒、考马斯亮蓝G-250、糖代谢相关酶(HK、PFK、CS、GS、PEPCK)活力测定试剂盒、苏木素-伊红(H.E.)染色试剂盒(北京索莱宝科技有限公司,批号分别为20181107、20190301、20181026、20190213、20190319、20190218、20190330、20190305和20201021);动物组织总RNA提取试剂盒和一步法荧光定量PCR试剂盒(北京天根生化科技有限公司,批号分别为Q5919和Q5310);引物由上海捷瑞生物工程有限公司合成;兔抗鼠p-PI3K、PI3K、p-Akt和Akt抗体、山羊抗兔β-肌动蛋白(β-actin)抗体(美国CST公司,批号分别为201904、201812、201905、201810和201901);兔抗鼠p-FoxO1、FoxO1、GLUT-2抗体和山羊抗兔HRP-IgG抗体(上海艾博抗贸易有限公司,批号分别为GR3192627-1、GR319251-1、GR3193674-2和GR3192836-1);ECL发光液(北京鼎国昌盛生物技术有限责任公司,批号180903-1);SDS-PAGE凝胶配制试剂盒、PVDF膜、TBST封闭洗涤缓冲液(上海碧云天生物技术有限公司,批号分别为 072219191228、101519191116和091419191124)。
1.2 主要仪器 590型血糖仪(江苏鱼跃医疗设备股份有限公司);BMC500数码生物显微镜(凤凰光学股份有限公司);ABI7500荧光定量PCR仪(美国AB公司);JY-SCZ2+型垂直电泳槽、JY-ZY5型转移电泳槽、JY300C电泳仪(北京君意东方电泳设备有限公司);680型酶标仪、Gel Doc 2000型凝胶成像系统(美国Bio-Rad公司)。
1.3 实验动物 近交系C57BL/6J雄性小鼠,SPF级,8周龄,由长春亿斯实验动物技术有限公司提供,动物许可证号:SCXK(吉)2011—0004。饲养环境温度(23±1)℃,湿度(55±5)%,12 h光/暗循环,自由饮水,基础饲料喂养。
1.4 试验方法
1.4.1 糖尿病小鼠的制备 雄性C57BL/6J小鼠50只,高脂饲料喂养4周。禁食12 h后首次按40 mg/(kg·bw)剂量腹腔注射现用现配的50 mmol/L STZ(4 ℃预冷0.1 mmol/L柠檬酸缓冲液配制,避光,pH4.5),随后每隔24 h注射1次,每次注射前4 h禁食不禁水,共注射5次,期间给予小鼠喂饲高脂饲料和饮用10%蔗糖水,末次注射后恢复为基础饲料和普通饮用水[11],此后连续3 d尾尖采血,空腹血糖(Fasting blood glucose,FBG)浓度>11.1 mmol/L的小鼠判定为T2DM模型小鼠[12]。另设基础饲料喂养的正常小鼠10只,按3 mL/(kg·bw)腹腔注射0.1 mmol/L柠檬酸缓冲液作为平行对照。
1.4.2 分组及给药 选取基础饲料喂养的正常小鼠10只为空白对照(BC)组。选取造模成功的T2DM小鼠40只,随机分为糖尿病模型(DM)组、二甲双胍对照[MC,150 mg/(kg·bw)]组[13]、刺五加苷提取物低剂量[ASGE-L,200 mg/(kg·bw)]组、高剂量[ASGE-H,400 mg/(kg·bw)]组[14],每组各10只。BC组和DM组小鼠给予生理盐水灌胃,DC组小鼠给予7.5 g/L的二甲双胍灌胃,ASGE-L组和ASGE-H组小鼠分别给予10 g/L和20 g/L的 ASGE灌胃。各组小鼠灌胃体积均为20 mL/(kg·bw),每日灌胃1次,连续28 d。
1.4.3 体重测量 每2天测量小鼠体重1次。
1.4.4 血糖变化和葡萄糖耐受性测定 每3天尾尖采血测定1次FBG,观察小鼠血糖变化。末次给药后,小鼠禁食不禁水6 h,然后用400 g/L葡萄糖溶液,按2.5 g/(kg·bw)剂量灌胃,测定0、0.5、1 h和2 h时血糖,进行口服葡萄糖耐量试验(Oral glucose tolerance test,OGTT)[15]。
1.4.5 胰岛素抵抗指数和敏感性指标测定 小鼠禁食18 h,10%水合氯醛[4 mL/(kg·bw)]麻醉,眼球取血,3 000 r/min离心15 min,取血清。葡萄糖氧化酶法测定血清FBG,酶联免疫法测定血清胰岛素(Insulin,INS),采用梅斯医学胰岛素敏感性在线评分系统(http://m.medsci.cn/scale/)计算稳态模型胰岛素抵抗指数(HOMA of insulin resistance,HOMA-IR)。
1.4.6 葡萄糖代谢相关酶活力测定 取小鼠肝组织剪碎称重后,加9倍组织重量的生理盐水匀浆,匀浆液在冰水浴下超声破碎后4 ℃下12 000 r/min离心30 min,取上清液即为肝组织总蛋白,考马斯亮蓝法测定蛋白浓度。按试剂盒说明书取肝组织总蛋白分别加入己糖激酶(Hexokinase,HK)、磷酸果糖激酶(Phosphofructokinase,PFK)、柠檬酸合酶(Citrate synthase,CS)、糖原合成酶(Glycogen synthase,GS)、磷酸烯醇式丙酮酸羧激酶(Phosphoenolpyruvate carboxykinase,PEPCK)的酶反应体系中,测定反应体系吸光度值,并根据肝组织总蛋白浓度计算酶活力。
1.4.7 组织病理学检查 取小鼠肝组织固定于10%中性福尔马林缓冲液,经常规组织脱水、透明、包埋、切片,然后进行H.E.染色,树脂封片,显微镜下观察并记录病理变化。
1.4.8 胰岛素信号相关基因表达检测 荧光定量逆转录聚合酶链式反应法测定肝组织中IRS-1、IRS-2基因和IR基因mRNA的相对表达量。提取小鼠肝组织总RNA,紫外分光光度法测定260 nm波长下吸光度值并计算总RNA浓度。将1 μg总RNA逆转录成cDNA,以甘油醛-3-磷酸脱氢酶(Glyceraldehyde phosphate dehydrogenase,GAPDH)基因为内参,检测肝组织中IR、IRS-1、IRS-2的mRNA表达水平,引物序列由PrimerBank(https://pga.mgh.harvard.edu/primerbank/index.html)查询,见表1。25 μL反应体系包含cDNA 1 μL(≤100 ng)、上下游引物各0.5 μL、12.5 μL反应液和10.5 μL双蒸水。反应程序为50 ℃ 预热2 min,95 ℃预变性10 min,之后为40个循环的3步反应:95 ℃变性15 s,60 ℃退火30 s,72 ℃ 退火30 s,反应结束后,通过熔解曲线分析确定PCR产物是否单一,获得PCR反应临界循环数Ct值,用2-ΔΔCt计算待测基因mRNA的相对表达量。ΔΔCt=ΔCt试验处理组-ΔCt对照组,各组ΔCt=Ct待测基因-Ct内参基因。
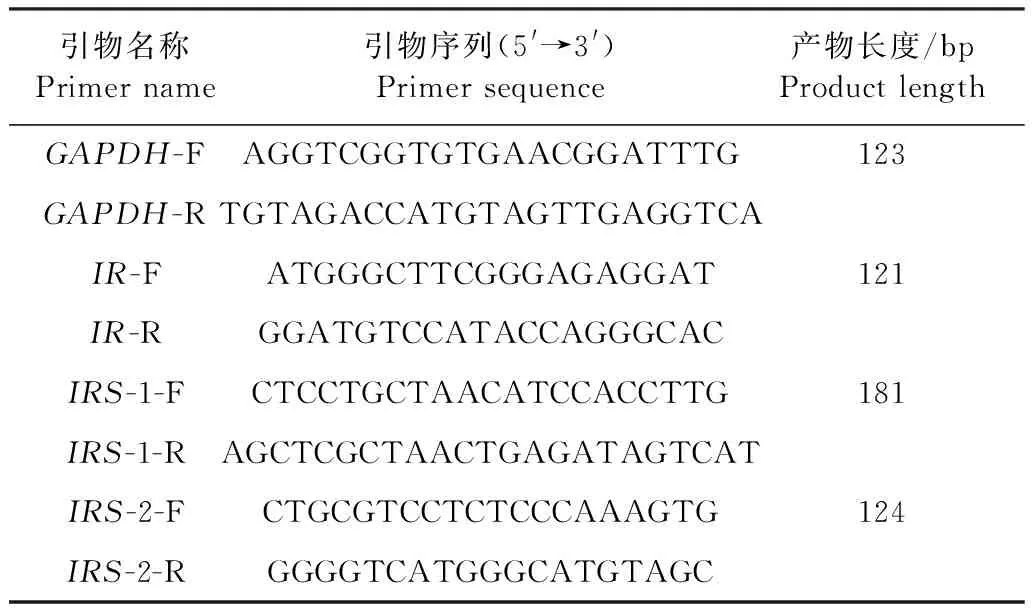
表1 荧光定量PCR引物Table 1 Real-time PCR primer
1.4.9 胰岛素信号相关蛋白磷酸化水平和GLUT-2蛋白表达的检测 免疫印迹法检测p-PI3K、PI3K、p-Akt、Akt、p-FoxO1、FoxO1和GLUT-2的蛋白相对表达量。取小鼠肝组织总蛋白加5×上样缓冲液,煮沸10 min。配制10%的分离胶和5% 的浓缩胶,每孔加50 μg蛋白上样,进行SDS-PAGE后电转印到PVDF膜,5%脱脂奶粉封闭2 h,加入1∶1 000稀释 的p-PI3K、PI3K、p-Akt、Akt、p-FoxO1、FoxO1、GLUT-2和β-Actin一抗,4 ℃孵育14 h,TBST漂洗后加1∶2 000稀释的HRP-IgG二抗,室温孵育2 h,TBST充分漂洗后加ECL试剂显影,用Quantity One软件对蛋白条带进行分析,p-PI3K/PI3K、p-Akt/Akt、p-FoxO1/FoxO1比值为蛋白磷酸化水平,GLUT-2/β-actin比值为蛋白相对表达量。
2 结果
2.1 对小鼠体重变化的影响 试验期间BC组小鼠体重呈生理性增长。给药前第33天(造模前),各组小鼠体重无显著差异(P>0.05);给药第1天,DM组、MC组、ASGE-L组和ASGE-H组小鼠体重无显著差异(P>0.05),但较BC组小鼠显著增加(P<0.01); 给药第28天,DM组、MC组、ASGE-L组和ASGE-H组小鼠体重均呈负增长(P<0.01),但MC组、ASGE-L组和ASGE-H组小鼠体重较DM组小鼠显著增加(P<0.01),见表2。
表2 ASGE对STZ 诱导糖尿病小鼠体重的影响Table 2 Effect of ASGE on body weights in STZ-induced diabetic mice
2.2 对小鼠空腹血糖的影响 给药第1天,DM组小鼠FBG显著高于BC组(P<0.01),且>11.1 mmol/L,说明糖尿病小鼠模型建模成功,MC组、ASGE-L组和ASGE-H组小鼠FBG与DM组无显著性差异(P>0.05);给药第28天,BC组和DM组小鼠FBG较给药第1天无显著变化(P>0.05),MC组、ASGE-L组和ASGE-H组小鼠FBG较给药第1天显著降低(P<0.01),并且较DM组小鼠FBG也显著降低(P<0.01),见表3。
表3 ASGE对STZ 诱导糖尿病小鼠空腹血糖的影响Table 3 Effect of ASGE on FBG in STZ-induced diabetic mice
2.3 对小鼠葡萄糖耐量的影响 OGTT过程中,BC组小鼠0 h血糖<6.1 mmol/L,2 h血糖<7.8 mmol/L,为正常糖耐量;各组糖尿病组小鼠在0、0.5、1 h和2 h血糖均显著高于BC组(P<0.01),0 h 血糖≥7.0 mmol/L,2 h血糖≥11.1 mmol/L,均为糖尿病性糖耐量;但与DM组相比,MC组、ASGE-L组和ASGE-H组小鼠血糖显著下降(P<0.01),见表4。
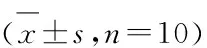
表4 ASGE对STZ 诱导糖尿病小鼠葡萄糖耐量的影响Table 4 Effect of ASGE on glucose tolerance in STZ-induced diabetic mice
2.4 对小鼠血清胰岛素含量和胰岛素抵抗指数的影响 给药第28天,各组糖尿病小鼠血清INS较BC组均显著升高(P<0.01),HOMA-IR出现较大差异(P<0.01)。与DM组相比,MC组、ASGE-L组和ASGE-H组小鼠血清INS均显著降低(P<0.01),HOMA-IR也均显著下降(P<0.01),见表5。
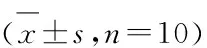
表5 ASGE对STZ诱导糖尿病小鼠血清胰岛素含量和胰岛素抵抗指数的影响Table 5 Effect of ASGE on serum insulin level and insulin resistance index in STZ-induced diabetic mice
2.5 对小鼠葡萄糖代谢相关酶活力的影响 与BC组相比,各组糖尿病小鼠肝HK、PFK、CS、GS活力显著降低(P<0.01),PEPCK活力显著增高(P<0.01)。与DM组相比,MC组、ASGE-L组和ASGE-H组小鼠肝HK、PFK、CS、GS活力显著增高(P<0.01),PEPCK活力显著降低(P<0.01),见表6。
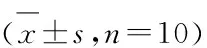
表6 ASGE对STZ诱导糖尿病小鼠葡萄糖代谢相关酶活力的影响Table 6 Effect of ASGE on activities of enzymes related to glucose metabolism in STZ-induced diabetic mice
2.6 对小鼠肝组织病变的影响 BC组小鼠肝小叶结构完整,无变性或坏死肝细胞,汇管区血管、肝中央小静脉及胆管均为正常结构,间质无结缔组织增生。DM组小鼠肝小叶轮廓不清,组织结构松散,肝细胞重度肿胀、增大并呈浊状改变,可见大量空泡,即脂滴所占据的胞内空间,与DM组相比,MC组、ASGE-L组和ASGE-H组小鼠上述病变均不同程度减轻,其中ASGE-H组小鼠改善效果较为明显,肝小叶结构相对完整,肝细胞肿胀程度减轻,空泡数量减少变小,见中插彩版图1。
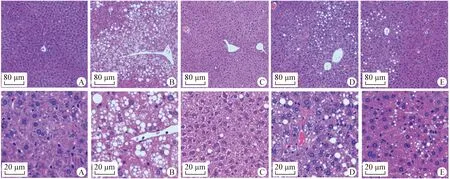
图1 小鼠肝脏组织病理学检测(H.E.染色,上:100×,下:400×)Fig.1 Mice liver tissues detected by histopathology (H.E. staining,up:100×,down:400×)A:空白对照组; B:糖尿病模型组; C:二甲双胍对照组; D:刺五加苷提取物低剂量组; E:刺五加苷提取物高剂量组A:Blank control (BC) group; B:Diabetes model (DM) group; C:Metformin control (MC) group;D:ASGE-Low dose (ASGE-L) group; E:ASGE-High dose (ASGE-H) group
2.7 对小鼠胰岛素信号通路相关基因表达的影响 与BC组相比,各组糖尿病小鼠肝IRS-1、IRS-2和IR基因mRNA表达水平显著降低(P<0.01)。与DM组相比,MC组、ASGE-L组和ASGE-H组小鼠肝IRS-1、IRS-2基因和IR基因mRNA表达水平显著增高(P<0.01)。见表7。
表7 ASGE对STZ诱导糖尿病小鼠胰岛素信号通路相关基因mRNA表达的影响Table 7 Effect of ASGE on mRNA expression of genes related to insulin signaling pathway in STZ-induced diabetic mice
2.8 对小鼠胰岛素信号通路相关蛋白磷酸化水平和GLUT-2蛋白表达的影响 与BC组相比,DM组小鼠肝p-PI3K/PI3K、p-Akt/Akt比值和GLUT-2蛋白表达水平显著降低(P<0.01),p-FoxO1/FoxO1比值显著升高(P<0.01),MC组小鼠肝p-PI3K/PI3K、p-Akt/Akt比值显著降低(P<0.01),p-FoxO1/FoxO1比值和GLUT-2蛋白表达水平显著增高(P<0.01),ASGE-L组和ASGE-H组小鼠肝p-PI3K/PI3K、p-FoxO1/FoxO1比值和GLUT-2蛋白表达水平显著增高(P<0.01),p-Akt/Akt比值显著降低(P<0.01)。与DM组相比,MC组、ASGE-L组和ASGE-H组小鼠肝p-PI3K/PI3K、p-Akt/Akt比值和GLUT-2蛋白表达水平显著增高(P<0.01),p-FoxO1/FoxO1比值显著降低(P<0.01),见图2和图3。
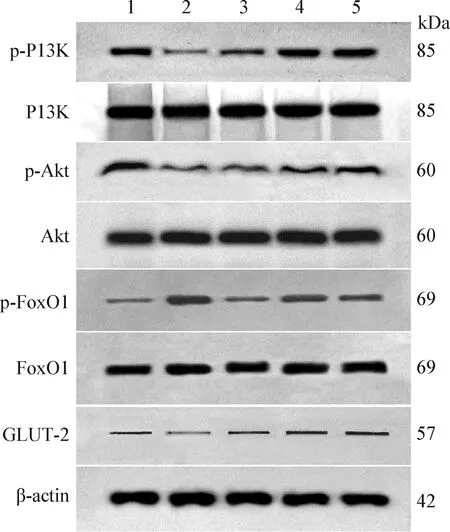
图2 小鼠胰岛素信号通路相关蛋白的免疫印迹Fig.2 Immunoblotting of proteins related to insulin signaling pathway in mice1:空白对照组; 2:糖尿病模型组; 3:二甲双胍对照组;4:刺五加苷提取物低剂量组; 5:刺五加苷提取物高剂量组1:Blank control (BC) group; 2:Diabetes model (DM) group;3:Metformin control (MC) group; 4:ASGE-Low dose (ASGE-L) group; 5:ASGE-High dose (ASGE-H) group
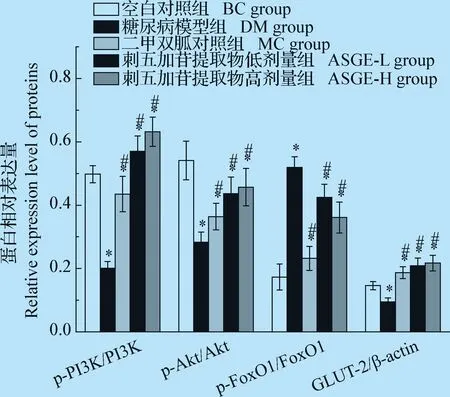
图3 小鼠胰岛素信号通路相关蛋白的表达量Fig.3 The relative expression of proteins related to insulin signaling pathway in mice注:与空白对照组比较,*:P<0.01; 与糖尿病模型组比较, #:P<0.01Note:Compared with blank control group,*:P<0.01; compared with diabetes model group, #:P<0.01
3 讨论
中药活性部位可发挥有效降糖作用,延缓并发症的发生,且毒副作用小,因此具有抗糖尿病作用中药活性成分具有较大开发潜力[16]。刺五加中含有大量的苷类化合物,可发挥降血糖作用[3]。本试验采用STZ为诱导剂构建T2DM小鼠模型,研究ASGE对糖代谢的作用及其分子调节机制。试验发现,模型小鼠在高脂饮食和STZ诱导下出现T2DM的典型病症,血糖显著升高,葡萄糖耐受能力下降,血清INS代偿性分泌过多,发生以高胰岛素血症为重要标志[17]的胰岛素抵抗。而ASGE可有效降低T2DM小鼠血糖,提高葡萄糖耐受能力,说明ASGE可以控制T2DM小鼠血糖异常,缓解胰岛素抵抗,提高肝细胞的胰岛素敏感性。同时,ASGE可调节INS分泌,降低T2DM小鼠血清INS,说明ASGE可在一定程度上恢复糖尿病小鼠受损的胰岛β细胞。糖代谢紊乱是糖尿病重要病理基础,肝脏是调控糖代谢的主要器官,为进一步探索ASGE调控糖代谢的机制,本试验选择肝组织作为研究对象。ASGE可减少高脂高糖代谢条件下肝细胞的脂肪堆积,维持糖尿病小鼠正常肝组织结构。肝内还含有多种糖代谢相关酶类,可体现肝功能状态,在糖尿病发病过程中起重要作用[18]。通过测定肝中多种关键酶的活性发现,T2DM小鼠糖酵解、三羧酸循环及糖原合成的关键酶HK、PFK、CS、GS的活性被显著抑制,糖异生关键酶PEPCK活性显著升高,而ASGE可提高HK、PFK、CS、GS的活性,降低PEPCK活性。说明ASGE可有效恢复糖尿病小鼠肝功能,促进糖的分解代谢及肝糖原的合成,减弱糖异生,在降低血糖过程中发挥明显作用。另一方面,PI3K/Akt信号转导通路是INS对糖代谢调节的主要通路之一[19],信号转导过程中IRS(主要为IRS-1和IRS-2)作为INS与IR结合后的重要枢纽蛋白,发挥偶联作用[20]。其下游与肝细胞糖代谢关系最为密切的蛋白FoxO1在糖尿病发生过程中磷酸化水平升高,并能够刺激糖异生关键酶PEPCK表达从而激活糖异生[21]。肝细胞膜表面GLUT-2是PI3K/Akt信号转导通路调节糖代谢最重要的效应蛋白之一,参与肝细胞对葡萄糖摄取[22]。通过测定肝PI3K/Akt信号转导通路相关基因和蛋白的表达发现,糖尿病小鼠肝IRS-1、IRS-2基因和IR基因mRNA表达显著降低,PI3K、Akt蛋白磷酸化水平降低,FoxO1蛋白磷酸化水平升高,GLUT-2蛋白表达显著降低,而ASGE可有效恢复蛋白的磷酸化水平和表达水平,使其趋于正常。说明ASGE在转录水平即可有效调控IR基因mRNA表达量,进而增加蛋白表达,促发受体自身磷酸化,进而引起IRS的酪氨酸磷酸化,活化PI3K激活Akt,调控下游蛋白FoxO1和效应蛋白GLUT-2。各项试验指标综合分析,说明ASGE可促进IR基因和IRS基因的转录,上调IR蛋白和IRS蛋白表达,激活PI3K/Akt信号转导通路并活化FoxO1蛋白,促进效应蛋白GLUT-2在肝细胞膜上的表达和转位,提高肝细胞对葡萄糖的摄取,同时调节糖代谢相关酶类的活性,促进糖原合成并抑制糖异生,多方面协调控制减少葡萄糖合成,最终起到降低血糖,恢复葡萄糖耐受能力,改善胰岛素抵抗的作用。
综上所述,本试验证实了ASGE具有降低T2DM小鼠血糖和血清INS浓度的作用,可缓解胰岛素抵抗,提高葡萄糖耐受能力,达到了改善病情的治疗效果。初步揭示ASGE通过激活胰岛素效应信号传导的主要途径PI3K/AKT信号通路调控T2DM小鼠糖代谢的作用机制,丰富了刺五加苷类化合物治疗糖尿病的试验依据,为传统中药刺五加在防治糖尿病方面的开发和利用提供理论基础。
