轮状病毒NSP5克隆、鉴定、表达及其条件优化
2021-08-31林家锋陶晓莉陆恒章于美玲李婷婷李藤菲程美慧李永刚
林家锋,陶晓莉,陆恒章,于美玲,李婷婷,李藤菲,程美慧,李永刚
轮状病毒(Rotavirus, RV)是能够使人类和动物引起一系列消化系统症状的常见病毒,可侵及小肠黏膜并且附着定居,给宿主细胞造成极大的危害[1]。与其他RNA病毒相比,它参与编码6种结构蛋白(VP1、VP2、VP3、VP4、VP6、VP7)及6种非结构蛋白(NSP1、NSP2、NSP3、NSP4、NSP5、NSP6),对病毒的增殖及致病有着重要的生物学意义[2-4]。RV大多通过粪-口途径传播,秋冬季节活跃,在一般环境中能稳定生存。它在世界范围内广泛存在,分型众多,A~C组能够导致人类和动物腹泻,D~G组只能导致动物腹泻,给当地家畜业及卫生健康构成极大的威胁[5-6]。一经感染,便可诱发蛋花汤样便、眩晕、发热等具体表现,严重者会因机体内环境失衡而脱水、休克死亡[7]。然而,目前尚无治疗该病毒公认有效的药品或疫苗,此外该病毒与宿主间的互作机制和致病机理还有待进一步研究。
作为一种重要的非结构蛋白,NSP5具有高度磷酸化的功能,能在细胞质内表达且稳定调控病毒的复制和感染周期。研究表明,具有多个骨架蛋白修饰位点的NSP5可与NSP2、VP2以及VP6蛋白共同构成病毒质体,而病毒质体又是病毒复制的主要场所[8-10]。一些学者通过小干扰RNA7(MicroRNA-7)靶向下调NSP5的表达,从而影响病毒质体的形成并抑制RV复制[11]。由此可见,NSP5在病毒的增殖表达及生物学活性中发挥着重要的作用,但具体机制还不清楚,本研究利用分子克隆的方法构建A组RV-NSP5重组表达载体来检测其在细胞内的表达,并对原核表达的条件进行优化分析,确定融合蛋白的富集位置,从而进一步探究分离株RV NSP5在病毒增殖中所承担的作用,同时为后续多抗及相关制剂的制备提供实验基础。
1 材料与方法
1.1 主要材料与试剂
1.1.1 病毒、细胞与质粒 本实验所用的A组RV病毒株分离自辽宁省锦州市妇婴医院一患儿粪便样品,293T细胞购于北京协和医学院细胞中心,pGEX-6P-1原核表达载体和pFLAG-CMV-3真核表达载体由锦州医科大学病原生物学实验室保存。
1.1.2 试剂 KOD-PLus-Neo PCR扩增试剂盒购买于日本TOYOBO公司;限制性内切酶EcoRⅠ酶、XhoⅠ酶、XbaⅠ酶、DNA连接酶和反转录试剂盒均购买于大连TaKaRa公司;TRIzol Reagent LS购买于Ambion公司;DNA凝胶回收试剂盒、质粒DNA中提试剂盒都购买于美国Axyprep公司;普通DNA产物纯化试剂盒购买于北京天根生化科技有限公司;DH5α、BL21(DE3)感受态细胞、氨苄西林钠(Ampicilin,Amp)、异丙基硫代半乳糖苷(Isopropyl β-D-Thiogalactoside,IPTG)、酵母提取物、胰蛋白胨都购买于北京索来宝科技有限公司;DMEM培养基、胎牛血清都购买于Gibco公司;BCA蛋白浓度测定试剂盒购买于碧云天生物技术公司;GST琼脂糖纯化树脂购买于上海生工公司;抗FLAG单克隆抗体购买于Sigma公司;Mouse Anti-β-actin mAb和Mouse Anti-GST mAb购买于北京中杉金桥生物技术有限公司;Alexa Flour 594 goat anti-mouse IgG(H+L)和HRP-goat anti-mouse IgG(H+L)都购买于美国Invitrogen公司等。
1.2 NSP5原核及真核表达载体的构建
1.2.1 引物设计与合成 根据分离所得的病毒株进行引物设计并经BLAST检测特异性、测序检测准确性。详见表1。

表1 轮状病毒NSP5原核及真核表达引物
1.2.2 提取RV RNA及PCR扩增NSP5 从RV病毒分离株提取RNA,经过反转录、PCR反应获得特异NSP5基因。反应体系及成分为:KOD-PLus-Neo酶1 μL,cDNA 1 μL,dNTP 5 μL,MgSO43 μL,10×PCR Buffer 5 μL,上下游引物各1 μL,最后用ddH2O补足至50 μL;条件如下:94 ℃持续2 min; 98 ℃持续10 s,58 ℃持续30 s,68 ℃持续30 s,共35个循环;最后 68 ℃ 持续7 min。电泳后,将NSP5目的条带切胶并且纯化回收,测序验证。
1.2.3 NSP5-pGEX-6P-1和NSP5-pFLAG-CMV-3的构建和鉴定 对纯化的NSP5片段和空载体双酶切,酶切反应体系分别为pGEX-6P-1或NSP5 2.5 μg,EcoR I 1 μL,XhoⅠ 1 μL,10×H Buffer 5 μL,ddH2O补足至50 μL;pFLAG-CMV-3或NSP5 2.5 μg,EcoR I 1 μL,XbaⅠ 1 μL,10×M Buffer 5 μL,0.1% BSA 5 μL,ddH2O补足至50 μL,条件为37 ℃水浴3 h。DNA液体纯化再回收,经电泳验证和理论大小相符时,把载体片段以及目的片段按1∶5比例、总体积10 μL进行连接,连接酶10 μL,16 ℃反应1 h,转化DH5α感受态细胞,第2 d选细菌培养板上生长状况良好的单克隆菌落,进行菌落PCR的初步验证。验证阳性者,即可中提质粒,双酶切验证。所得质粒送至南京金斯瑞生物科技有限公司测序验证。
1.3 NSP5-pFLAG-CMV-3真核细胞转染及相关检测
1.3.1 293T细胞培养及转染 293T细胞按照每孔6×105的数量级加到6孔板中,培养过夜。等长到60%~70%的时候,每个孔240 μL Opti-MEM稀释10 μL PEI,轻柔混合切勿振荡,室温孵育5 min;然后240 μL Opti-MEM稀释4 μg NSP5-pFLAG-CMV-3重组质粒,用同样的方法稀释pFLAG-CMV-3空载体。把上述稀释液分别缓慢混合,室温孵育20 min。最后,加入对应孔培养细胞48 h,用于Western Blot和间接免疫荧光检测。
1.3.2 Western blot检测 NSP5-pFLAG-CMV-3转染后,吸弃上清液体,每个孔加入250 μL的NP-40,变性、离心、-20 ℃保存。蛋白样品经过10%SDS-PAGE分离,15V半干转12 min,PVDF膜右上角裁角标记,5% 脱脂奶粉封闭2.5 h。然后,用封闭液1∶2 000稀释鼠抗β-actin抗体、1∶5 000的比例稀释鼠抗FLAG抗体,浸没PVDF膜4 ℃过夜。1×PBST洗膜10 min×3次;二抗HRP-goat anti-mouse IgG(H+L)经1∶3 000稀释后将膜均匀孵育,室温1 h,洗膜10 min×3次。ECL显影拍照,检测NSP5-pFLAG-CMV-3蛋白在细胞水平上的表达。
1.3.3 间接免疫荧光检测 取出细胞培养板置于室温下,弃掉原有培养液,4%多聚甲醛静置1 h,500 μL PBS洗涤3次,加200 μL 0.1% Triton X-100静置15 min,500 μL PBS洗涤3次。1% BSA静置1 h,PBS洗后,加1∶200比例稀释的鼠抗FLAG,37 ℃孵箱中静置1 h。吸掉一抗,500 μL PBS洗涤3次,避光环境下加入1∶500比例稀释的羊抗鼠荧光二抗,37 ℃湿盒避光1 h,吸掉二抗,PBS洗涤后,运用荧光显微镜采图。
1.4 NSP5-pGEX-6P-1原核表达和条件优化
1.4.1 NSP5-pGEX-6P-1在大肠杆菌中的原核表达 NSP5-pGEX-6P-1转化到E.coliBL21(DE3)中,置在细菌培养箱生长过夜。第二天把重组菌的单菌落接种至150 mL新鲜的LB培养液(1∶1 000的比例加了Amp),在恒温摇床培养,直至重组菌菌体OD值达到0.6~0.8时,设置不同变量对最适蛋白诱导表达条件进行摸索:IPTG浓度(0、0.2、0.4、0.6、0.8、1.0、1.2 mmol/L)、诱导温度(28 ℃和37 ℃)以及诱导时间(2、4、6、8、10、12 h)。
1.4.2 NSP5-pGEX-6P-1可溶性表达、纯化及鉴定 取出保存的最佳诱导条件下菌体蛋白,冰浴超声破碎:每次工作5 s、间歇10 s,总共超声99次。然后,离心,保存上清,冰浴条件下用400 μL PBS将沉淀吹打均匀。各吸50 μL上清及沉淀,变性、离心后制成样品,进行后续SDS-PAGE分析。经大量诱导表达后,沉淀蛋白用含盐酸胍的变性缓冲液充分溶解,4 ℃摇晃过夜。次日,不断用不含盐酸胍的复性缓冲液超滤置换,直至液体清透。根据GST琼脂糖纯化树脂说明书,控制流速上柱洗脱,并测定纯化所得目的蛋白的浓度。随后,将纯化的重组蛋白转移至PVDF膜,Mouse Anti-GST mAb为一抗、HRP-goat anti-mouse IgG(H+L)为二抗,分别以1∶2 000和1∶3 000稀释,进行Western Blot检测。
2 结 果
2.1 RV-NSP5基因扩增 RV cDNA经针对NSP5的特异引物进行体外扩增,电泳结果表明,605 bp左右出现一明亮条带,与预期片段大小一致(图1)。测序结果进一步表明,RV-NSP5基因扩增成功。

1为RV-NSP5目的片段
2.2 重组载体的构建及鉴定 扩增反应产物经过DNA胶回收纯化、酶切、再纯化及片段连接,转化到DH5α中,提取质粒后分别使用EcoRI/XhoI和EcoRI/XbaⅠ进行双酶切验证,得到的条带与理论大小相符(图2、3)。经测序结果证明,所得序列与NSP5基因序列相一致,表明NSP5-pGEX-6P-1和NSP5-pFLAG-CMV-3重组质粒构建成功(图4、5)。

1为NSP5-pGEX-6P-1质粒
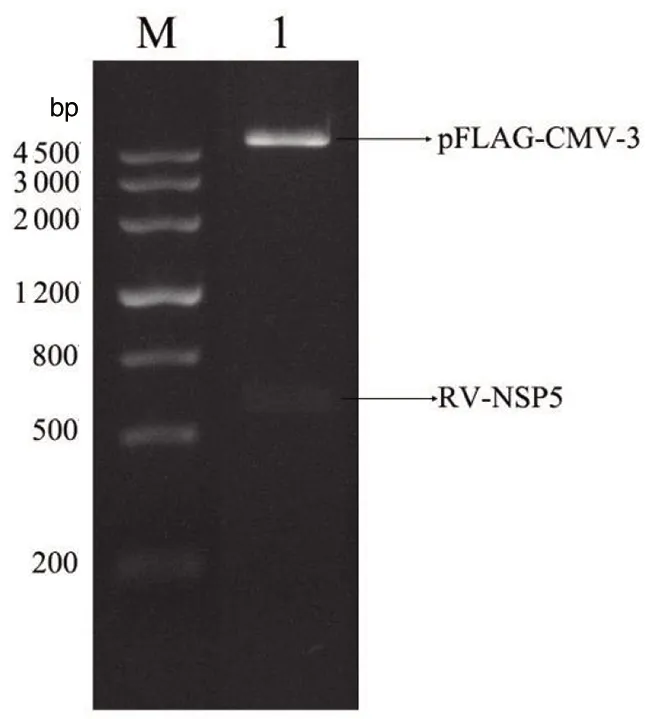
1为NSP5-pFLAG-CMV-3质粒

图4 NSP5-pGEX-6P-1的测序鉴定图(部分截图)

图5 NSP5-pFLAG-CMV-3的测序鉴定图(部分截图)
2.3 Western blot 验证NSP5-pFLAG-CMV-3在细胞中的表达 NSP5-pFLAG-CMV-3转染至293T细胞,分析NSP5在细胞水平上的表达情况。由图所示,NSP5-pFLAG-CMV-3转染后在约25 kD呈现特异条带,符合理论大小,而pFLAG-CMV-3空载体转染并没有出现条带(图6)。

1为转染pFLAG-CMV-3质粒;2为转染NSP5-pFLAG-CMV-3质粒
2.4 间接免疫荧光检测NSP5-pFLAG-CMV-3在细胞内分布 NSP5-pFLAG-CMV-3转染至293T细胞之后在37 ℃细胞培养箱中培养48 h,IFA结果表明,转染NSP5-pFLAG-CMV-3的细胞能够观察到荧光主要汇集在细胞质中,细胞核并没有荧光;转染pFLAG-CMV-3空载体没有呈现出特异性荧光(图7)。

A为转染重组质粒NSP5-pFLAG-CMV-3;B为转染空载体pFLAG-CMV-3质粒
2.5 NSP5-pGEX-6P-1优化表达、纯化及鉴定 经诱导条件摸索,确定NSP5-pGEX-6P-1最适诱导条件为37 ℃、8 h、IPTG 0.4 mmol/L,超声破碎获得上清液和沉淀悬液,用于电泳及进一步的染色分析。结果表明,在最适蛋白诱导条件下,NSP5-pGEX-6P-1大部分是以包涵体形式富集于沉淀中表达,而在上清的可溶性表达微乎其微(图8A)。包涵体蛋白在变性、复性之后,经GST琼脂糖树脂亲和层析洗脱,纯化所得的蛋白浓度为0.92 mg/mL(图8B)。经Western Blot检测,纯化的融合蛋白能被抗GST单抗特异性识别,且在48 kD左右处有一条特异性条带,符合预期大小(图8C)。

A:NSP5-pGEX-6P-1菌体总蛋白裂解后分析:1为裂解后的上清液;2为裂解后的沉淀悬液;B:NSP5-pGEX-6P-1纯化蛋白SDS-PAGE分析:1和2为纯化所得的重组蛋白;C:NSP5-pGEX-6P-1纯化蛋白的Western Blot检测:1为纯化所得的重组蛋白
3 讨 论
轮状病毒是全球高发的人兽共患病原体之一,约95%的婴幼儿在5岁前受过感染,此外也给畜牧业和世界经济造成了一定的损失[12]。由于该种病毒包装机制复杂,复制增殖功能会大大加强病毒的致病力,给卫生防控带来了很大的难度[13]。至今除了预防性减毒活疫苗外,尚无有效的药物及制剂可治疗轮状病毒,故从轮状病毒的基因成分入手,对病毒的致病机制、表达方式及与宿主间互作机理进行深入研究,从而为肠道类病毒的检测和治疗提供理论基础。
NSP5是病毒基因组11片段编码的蛋白质,含有大量丝氨酸、苏氨酸等多种氨基酸的修饰位点,参与RV翻译后修饰及加工处理,对病毒的复制周期和蛋白表达调控有着举足轻重的作用[14]。基于反向遗传学技术的兴起,科学家尝试产生NSP5的稳定反向互补系统以鉴定NSP5突变对RV病毒株的影响,结果发现NSP5过度磷酸化是装配圆形病毒质体的关键步骤,并且突出了NSP5的C末端尾巴在具有复制能力的病毒工厂形成过程中的关键作用[15-18]。随后,Buttafuoco等[19]发现NSP5高表达是一个初始步骤,能够触发与NSP2、VP2结合形成胞质包涵体,可在病毒颗粒蛋白募集过程中起到“桥梁”作用,这便为蛋白互作影响病毒功能提供了有力的依据。由此表明,NSP5非结构蛋白在病毒的复制和表达过程中起到非常重要作用,所以NSP5是如何加快病毒感染宿主并且协助逃避免疫监视将会是人类未来深入探讨的一大课题。
本次研究通过构建轮状病毒NSP5真核及原核表达系统,一方面通过转染真核细胞来研究重组质粒在细胞水平上的表达情况,为深入探究NSP5的功能与致病机理提供了新思路;另一方面,基于重组蛋白独特的属性,利用基因工程等方面的技术,摸索出最优化的表达条件,确定了重组蛋白富集在沉淀中,恰恰也验证了Buttafuoco等研究者的观点,并且顺利纯化NSP5蛋白,这为研制多抗提供了一定的前期基础。
利益冲突:无
