非疫苗血清型肺炎链球菌发生机制及疫苗新策略
2021-08-31刘福莉李佳茵华允芬
刘福莉,李佳茵,何 平,华允芬
肺炎链球菌(Streptococcuspneumoniae,Sp)是一种表面包被荚膜的革兰氏阳性双球菌,兼性厌氧。到目前为止,依据其荚膜多糖结构的特异性,Sp已确定有近100种血清型。SP在自然界中分布广泛,作为一种常见的条件致病菌,常在正常人鼻咽腔中定植,当机体免疫功能下降或受其他因素影响时,可引发各种侵袭性疾病,如脑膜炎、败血症、菌血症等,患有慢性疾病或免疫力低下的人群、2岁及以下的儿童和65岁以上老年人是其主要的侵袭对象。据统计,由细菌性肺炎导致的死亡约占全球5岁以下儿童死亡人数的15%[1]。尽管抗生素治疗具有一定的效果,但抗生素不能治疗由肺炎链球菌感染初期造成的生理上的不可逆损伤,并且肺炎链球菌对抗生素的耐药性日益严重,而新型抗菌药物的发现受制于高昂的研发成本和可能较低的投资回报率[2]。因此,寻求控制Sp感染的新方法,是目前亟待解决的关键问题。疫苗通过提高易感人群对病原菌的免疫能力有效地降低感染率,在Sp感染防治中愈加受到重视[3]。但近年来血清型替换及荚膜转换现象频繁发生导致肺炎链球菌血清型分布发生变化,使得目前以荚膜多糖为基础的多糖疫苗和多糖蛋白结合疫苗的保护效力大大降低,此外,肺炎链球菌疫苗不能预防由无荚膜肺炎链球菌的引起的疾病,这无疑增加了疾病防控的风险和治疗难度。研究肺炎链球菌非疫苗血清型的发生机制进而开发新的疫苗已经成为当下必要的课题。
1 肺炎链球菌荚膜多糖及其疫苗
细菌荚膜多糖(capsular polysaccharide,CPS)在细胞壁外形成关键的防护层,保护细菌逃避宿主的先天免疫反应机制,逃逸后的细菌可在机体组织细胞中生长繁殖引发感染,故荚膜多糖与细菌毒力息息相关。肺炎链球菌荚膜种类繁多,有近100种不同的荚膜类型,称为血清型,这些不同的血清型由荚膜多糖的组成和结构决定[4]。CPS位点由12至20个基因组成,编码4种保守的调控蛋白,1种初始糖基转移酶、几种非初始糖基转移酶、1种Wzy重复单位聚合酶和1种Wzx翻转酶[5-6]。最近的研究发现,不同的CPS不仅造成肺炎链球菌毒力的差异,还影响其定植和传播。Ammar Zafar通过构建一种幼鼠鼻腔定值、脱落和传播模型证明了肺炎链球菌从宿主上呼吸道粘膜(upper respiratory tract,URT)脱落的水平与CPS类型和表达量相关,且通过传播导致不同荚膜型的肺炎链球菌感染率差异呈显著性。这一研究可能解释了为何一些肺炎链球菌血清型在人群中更常见[7]。
肺炎链球菌荚膜多糖作为抗原可刺激机体产生相应抗体,通过中和作用加速对肺炎链球菌的清除。1983年,23价荚膜多糖疫苗研制成功。PPV23覆盖了23种经常引起肺炎链球菌感染的血清型,理论上能有效预防80%以上的成人肺炎链球菌感染,但该疫苗对2岁以下儿童的保护效果较弱。为了使2岁以下儿童产生保护性免疫应答,2002年开发了第1种7价肺炎链球菌多糖蛋白结合疫苗(pneumococcal conjugate vaccines,PCV),基于北美和欧洲的流行病学数据,该疫苗将7种常见致病血清型(4、6B、9V、14、18C、19F、23F)的荚膜多糖与载体蛋白CRM197相结合。流行病学数据显示,在接种疫苗前,血清型14在这些国家是导致儿童和成人侵袭性肺炎链球菌病(invasive pneumococcal disease,IPD)的主要原因,接种PCV7后,7F和19A血清型开始在儿童中占主导地位[8]。2010年,惠氏公司在7价多糖蛋白结合疫苗的基础上又上市了第2种结合疫苗,即13价肺炎链球菌多糖蛋白结合疫苗(PCV13),该疫苗包含了PCV7中未覆盖的6种新血清型,即血清型1、3、5、6A、7F和19A,其血清型覆盖范围的增加为预防肺炎链球菌感染提供了更广泛的保护作用[9]。表1总结了目前所有获得许可的肺炎链球菌疫苗。虽然PPV和PCV已经得到广泛应用,但由于其保护范围有限以及非疫苗血清型及无荚膜肺炎链球菌的增加,使得由肺炎链球菌感染导致的死亡率仍然居高不下。

表1 肺炎链球菌疫苗成分比较
2 肺炎链球菌非疫苗血清型的发生机制
2.1 血清型替换 血清型替换是指原来是次要的或非致病性肺炎链球菌血清型变成了主要的致病性血清型,且不在现有疫苗血清型的涵盖范围内[10]。研究发现,尽管PCV接种有效地减少了疫苗血清型Sp在鼻咽部的定植,但随着疫苗血清型Sp从鼻咽生态位中清除,非疫苗血清型Sp的携带量很快增加,导致肺炎链球菌的携带率仍然很高[11]。最典型的例子是继2000年美国引入7价结合疫苗后,19A血清型肺炎链球菌的流行率迅速增加并成为IPD的主要诱因。血清型19A肺炎链球菌于1998年首次被报道,在PCV7疫苗实施前,疾病控制和预防中心中并没有关于19A分离株的相关记录,当时较为常见的是19F,而1998-2005期间,由19A血清型肺炎链球菌导致的侵袭性疾病增加了近3倍[12]。同样的,在美国引入了13价肺炎链球菌结合疫苗后,监测发现PCV13包含的19A血清型肺炎链球菌的定植率有所降低,但35B等非疫苗血清型的定植在逐渐增加[13-14]。在2012年印度南部的两例成人侵袭性肺炎链球菌感染的患者中发现,导致患者死亡的两个肺炎链球菌分离株血清型33C和7C均属于非疫苗血清型[15]。流行病学数据表明,世界各国在疫苗接种后均出现了明显的血清型替换现象,而且不同地区和年龄组之间导致IPD的非疫苗血清型存在差异。近年来研究者观察到,非疫苗血清型8、9N、15A和23B在澳大利亚、北美和某些欧洲国家呈上升趋势,尽管出现了共有的非疫苗血清型,但并没有观察到像在PCV7上市前的血清型14和PCV13上市前的血清型19A一样有一种占据主导地位的血清型[8]。目前的研究普遍认为,在疫苗的直接作用下,非疫苗血清型的迅速替换可能是由于不同血清型的菌株在定植部位的竞争性作用[16]。血清型替换现象的出现使我们意识到长期使用PCV的策略必须要有所转变,并且不断提高对流行的肺炎链球菌血清型的认知。且各国之间流行的血清型存在差异,也要求我们考虑是否在不同地区研制不同的血清型疫苗制剂。
2.2 荚膜转换 除了血清型替换,荚膜转换也是肺炎链球菌血清型流行率发生变化的主要原因。荚膜转换即通过改变或交换其CPS基因座来改变单个克隆血清型的现象[17-18]。通过对1937年至2007年收集的426株肺炎链球菌的血清型和MLST数据进行分析发现,其中有36株肺炎链球菌发生了荚膜转换,其原因个别归因于核苷酸的替换或缺失,但大多数是由于CPS基因座的重组造成的,并且存在从另一个肺炎链球菌菌株或相关物种中捕获基因片段进而表达新荚膜类型的可能[17,19]。Chrispin实验室收集了98名婴儿共1 553份鼻咽拭子样本,通过全基因组测序比较了肺炎链球菌在定植过程中的基因组变化,数据显示,在定植过程中,Sp能迅速进行微进化使菌株获得较高的遗传多样性[20]。这种多样性的决定因素包括宿主、菌株类型和定植持续时间,并受突变和同源重组现象的影响。而Chrispin早期的一项研究表明肺炎链球菌这种通过转化和同源重组从其他菌株甚至其他物种中获得异源DNA的能力与其定植能力相关,作者认为,具有较强的定植能力的肺炎链球菌通常具有较厚的荚膜,从而能抵抗中性粒细胞的吞噬作用和补体介导的杀伤作用,在长期的定植过程中有更高的获得外源DNA的几率[21]。从2010年至今,人们又相继发现了10种新的荚膜类型,表2列出了最新发现的10种肺炎链球菌血清型信息。2020年,Feroze Ganaie实验室发现了第100种肺炎链球菌荚膜类型,并将其命名为血清型10D,通过基因分析发现,10D肺炎链球菌CPS中唯一编码核糖醇转移酶的基因wcrO10D极有可能来自口腔链球菌[22]。链球菌属包含104种已知的物种,目前的研究表明,缓症链球菌、婴儿链球菌和口腔链球菌,是肺炎链球菌获得外源基因片段的主要来源[23-25]。种间的荚膜基因交换大大增加了肺炎链球菌荚膜型别的多样性,并使血清型复杂化。
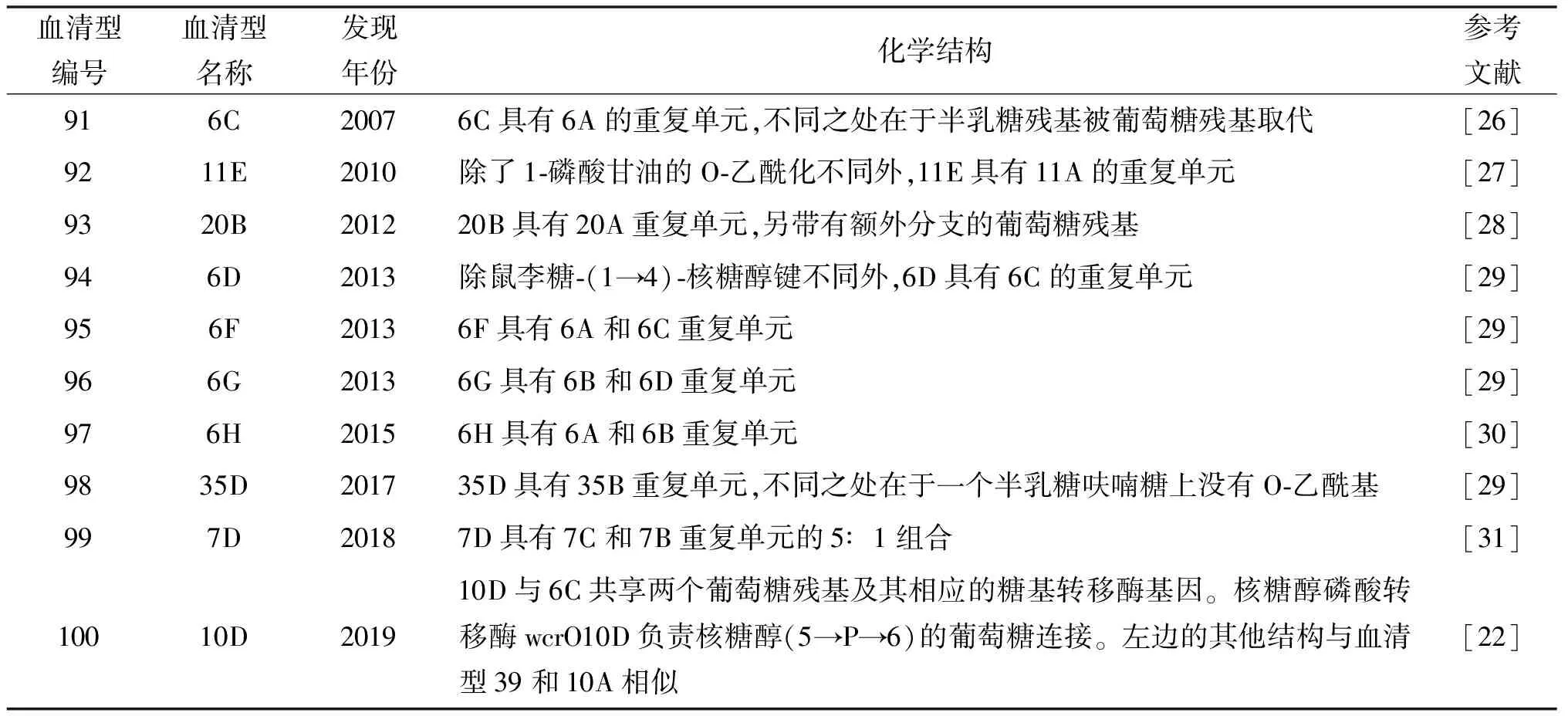
表2 最近发现的10种肺炎链球菌血清型列表
在疫苗的选择压力下,肺炎链球菌通过种内重组以及与其他链球菌的种间重组不断进化,使其具有结构多样的荚膜多糖,这种由疫苗血清型到非疫苗血清型的荚膜转换,促使新型的肺炎链球菌菌株逃避现有疫苗的作用。除此之外,通过重组,还增加了肺炎链球菌获得耐药基因的可能[32-33]。
2.3 无荚膜肺炎链球菌 荚膜多糖作为肺炎链球菌分型的依据,不仅是肺炎链球菌最重要的毒力因子之一,还有助于病原菌在宿主的鼻咽部定植。近年来,研究发现无荚膜肺炎链球菌(nonencapsulated streptococcus pneumoniae,NESp)的分离率逐渐增加,在使用了PCV7疫苗后,葡萄牙儿童NESp携带率从2001年的1.5%增加到2006年的5.1%[34]。
CPS合成位点位于肺炎链球菌高度保守的dexB基因和aliA基因之间,是表达荚膜多糖所必需的。通过对NESp的CPS位点的组成进行分析,可将NESp分为两类[23],第1类NESp分离株具有传统荚膜类型肺炎链球菌的CPS位点序列,但由于在dexB基因和aliA基因之间出现基因的缺失或突变,从而不能正常表达荚膜多糖;第2类NESp分离株的CPS基因位点完全被其他基因取代。NESp菌株由于缺乏荚膜多糖,传统上认为该类菌株不具有致病能力。但研究发现,在一些NESp分离株中,CPS位点具有编码新的毒力的相关蛋白PspK、aliC和aliD,这些蛋白增加了NESp在宿主鼻咽部的定植能力和毒力。基于第2类NESp是否表达肺炎链球菌表面蛋白(PspK)和两个寡肽结合脂蛋白(aliC和aliD)又被分为4个支系,分别为NCC1(null-capsule clade,NCC)、NCC2、NCC3和NCC4。NCC1表达肺炎链球菌表面蛋白PspK,但aliC和aliD呈阴性;NCC2是aliC和aliD阳性,而PspK阴性;NCC3为aliD阳性,aliC和PspK阴性;NCC4均为阴性[35-36]。
来自日本的一项最新研究报告称,从儿童急性中耳炎患者分离到的肺炎链球菌菌株中,6.4%的菌株为NESp,其中4.7%为PspK阳性[23,37]。此外在韩国不同城市的儿童中发现了同一种MLST类型的NCC1分离株。这表明NCC1克隆株可在人群中传播[38]。已有多个研究表明,PspK表达可以促进肺炎链球菌与宿主细胞的粘附,与NESp的定植和毒力有关[37]。动物实验也证明NCC1分离株只有在含有pspK的情况下才能定植于小鼠鼻咽部[39]。aliC和aliD作为底物结合蛋白,在NESp菌株早期定植和持续感染中发挥着重要作用。体外分析表明,aliC和aliD的存在导致NESp对上皮细胞的粘附和体外生物膜形成的减少,但增加了溶血素Ply的表达。而当aliD缺失时,Ply表达量和NESp在血液中的存活率显著降低,这表明与aliC相比,aliD在侵袭性疾病中具有更为主导的作用[40]。
目前已经证明NESp一样可以有效地在鼻咽部定植,并占无症状携带者分离株的3%~19%[41]。这些NESp与非侵袭性疾病如中耳炎、结膜炎和非细菌性肺炎相关[42],并且菌株中携带多重耐药基因[43]。最近,日本一家医院首次从肺炎病人支气管痰液中分离出对β-内酰胺类抗生素、大环内酯类和喹诺酮类耐药的多耐药性NESp[38],此外,Bradshaw将带有荚膜的热灭活菌株WU2与NESp菌株混合,通过腹腔注射构建了混合菌株的小鼠全身感染模型,发现NESp能够在体内转化过程中获得荚膜并维持抗生素抗药性,进而进化为毒性更强的菌株[41]。荚膜的缺乏,使NESp菌株更容易获得外源DNA,具有更高的遗传可塑性。但现有肺炎链球菌疫苗并不针对缺乏荚膜多糖的NESp,这可能导致NESp在鼻咽部的定植增加[44]。我们必须意识到由NESp引起的感染在不久的将来可能成为一个重要的临床问题。因此,监测和研究NESp的致病性和药物敏感性对于制定有效的预防和治疗策略具有重要意义。
3 新型疫苗及策略
血清型替换、荚膜转换及NESp的增加使得现有疫苗已不能全面有效地预防肺炎链球菌感染,因此,基于有荚膜和无荚膜的肺炎链球菌表达的蛋白质设计的蛋白质疫苗以及全细胞疫苗等新一代疫苗的开发有可能解决当下非疫苗血清型肺炎链球菌流行率增加的问题,通过引起与特定血清型无关的免疫应答,实现对现有疫苗的补充。
肺炎链球菌能表达多种有助于其在鼻咽黏膜表面定植的表面蛋白[45],如图1所示。使用所有血清型肺炎链球菌共有的表面蛋白作为抗原,以期开发能诱导机体对不同血清型肺炎球菌均能产生免疫应答的蛋白质疫苗,是未来肺炎链球菌疫苗的发展趋势,也是更加经济可行、广泛持久的保护方式。目前已经发现了20多种具有保护作用的肺炎链球菌蛋白质,其中对于肺炎链球菌表面蛋白A、肺炎链球菌溶血素、肺炎链球菌表面黏附素A的研究较多,已经证明它们有助于肺炎链球菌的定植并具有免疫原性。但是这些蛋白有些并不能被NESp菌株表达,需要研究能有效针对NESp的目标蛋白。在NESp菌株中,研究者发现了(pspK、aliC和aliD)3个基因,它们取代了荚膜多糖生物合成位点中的CPS合成基因。先前的研究表明,肺炎链球菌表面蛋白k和两个寡肽结合脂蛋白与NESp菌株的黏膜定植和感染密切相关,并且PspK、aliC和aliD均具有免疫原性,是重要的疫苗候选蛋白[46]。已有研究表明,全身免疫及粘膜免疫均能够在小鼠体内诱导产生PspK特异性保护性抗体,且PspK免疫小鼠血清能有效减少表达PspK的菌株在小鼠上皮细胞的粘附[47]。此外,肺炎球菌表面蛋白C(PspC)与PspK具有一定的序列同源性,而PspC免疫也被证明对肺炎链球菌病有保护作用[48]。

图1 肺炎链球菌在宿主表面定殖的分子机制[45]
近年,研究开发出一种肺炎链球菌全细胞疫苗(whole cell vaccine,WCV),它经基因修饰去除了自溶素基因,并由且不含荚膜多糖的灭活的肺炎链球菌菌株组成,常以氢氧化铝作为佐剂[49]。NESp菌株由于没有荚膜包裹,使得肺炎链球菌表面的蛋白质抗原暴露于免疫系统中,而这些抗原通常由不同血清型的肺炎链球菌表达,因此能够引起与特定的血清型无关的免疫应答[50-51],WCV可以更好地预防这类菌株的感染。此外,肺炎链球菌是一种革兰阳性菌,不含脂多糖,作为全细胞疫苗使用相对安全[52]。根据多个实验室的研究表明,当全细胞疫苗与合适的佐剂结合时,可以通过粘膜免疫减少肺炎链球菌的定植。
4 小 结
肺炎链球菌感染性疾病一直是世界上重要的公共卫生问题之一,通过广泛的预防和治疗措施减少儿童链球菌性肺炎的发病率,降低死亡率和死亡人数,是联合国千年发展目标实现的关键[53]。虽然疫苗对肺炎球菌疾病有显著的保护作用,但近年来频繁的血清型替换及NESp的增加使得目前的多糖疫苗和多糖蛋白结合疫苗免疫效果并不理想,此外,肺炎链球菌通过种间基因转移促进了荚膜多糖的多样性,导致了抗原的多样性。而有荚膜和无荚膜的肺炎链球菌在定植期间密切的相互作用不仅导致重组菌株的出现,还可能导致获得抗生素抗药性和毒力因子的几率增加,进而增加疾病防控的风险和治疗难度。目前的疫苗和治疗策略对非疫苗血清型肺炎链球菌和NESp均无效,因此研究开发新的疫苗已经成为当下必要的课题。了解非疫苗血清型肺炎链球菌的流行机制及探究无荚膜肺炎链球菌如何在宿主定植并导致疾病,将有助于设计更有效的应对策略。
利益冲突:无
