水稻稻瘟病生防细菌5-8的鉴定及其生防机制研究
2021-08-26李珅瑀贾祥子郭君陶张清霞陈夕军
李珅瑀,贾祥子,郭君陶,张清霞,陈夕军
(扬州大学园艺与植物保护学院,江苏扬州 225009)
水稻是亚洲许多国家的主粮。亚洲水稻的种植面积占世界总面积的90%,而我国水稻的种植面积居世界第2 位。稻瘟病是由稻瘟病菌(Pyricularia oryae)引起的一种真菌病害,具有突发性强、传播迅速、易于流行等特点,在世界范围内广泛分布,平均每年造成的水稻产量损失可达30%~50%,严重时颗粒无收[1]。目前,施用化学农药和采用抗病品种是防治稻瘟病的主要方式,但抗病品种存在选育时间长、抗病性易丧失等问题,长期使用化学农药不仅会使病原菌产生抗药性,还危害生态环境和人畜健康。生物防治因具有无残留、对人畜和天敌安全、与环境相容性好等优点[2],更有利于恢复与重建以自然调控为核心的生态系统,实现水稻植株生态系统的平衡,近年来,越来越受到国内外学者的重视。
目前,对稻瘟病有良好拮抗作用的生防微生物有多种,不同生防菌作用方式不同。ALI 等[3]研究发现,木霉(Trichodermasp.)可通过溶解稻瘟病菌菌丝细胞壁使菌丝卷曲来降低稻瘟病菌的致病性。DE VLEESSCHAUWER 等[4]研究表明,Pseudomonas fluorescensWCS374r 可引发水稻产生ISR 增强抗叶瘟的能力。通过突变体分析证实,P.fluorescensWCS374r诱导的ISR 依赖茉莉酸/乙烯信号传导通路,不依赖水杨酸。YU 等[5]分离的葡萄球菌(Staphylococcussp.)可产生抑菌活性物质嘌呤核苷磷酸化酶,显著抑制孢子的萌发、附着胞的形成,从而预防稻瘟病。甲基营养型芽孢杆菌(Bacillus methylotrophicus)产生抑菌活性物质啉氨甲基醋酸,可抑制稻瘟病菌菌丝的生长和孢子萌发[6]。芽孢杆菌产生的芽孢在环境中可与其他微生物互作,具有极强的抗逆性和广谱抑菌活性,并诱导植株产生抗病性[7]。
本研究为确定生防细菌5-8 对水稻稻瘟病的防治效果,在对扬州大学园艺与植物保护学院实验室现存的10 株生防菌进行苗期防病试验后,又通过16S rDNA 基因序列同源性分析及生理生化指标测定对生防细菌5-8 进行菌种鉴定,通过PCR 扩增及MALDI-TOF MS 检测确定菌株5-8 产生的抗菌活性物质,通过孢子萌发及对细胞膜的破坏试验确定其抗菌作用方式,旨在为今后防治稻瘟病提供更为新型、优异的生防资源。
1 材料和方法
1.1 试验材料
以感稻瘟病品种武育粳3 号为供试水稻品种。对扬州大学园艺与植物保护学院实验室保存的拮抗细菌5-8、绿针假单胞菌(Pseudomonas choloeaphtis7-5)[8]、50、JY1-5、DC1、29、53、55、HTC-1、HTC-5 进行测试,以抑菌谱广的Bacillus amyloliquefaciensW10[9]为阳性对照。
供试病原真菌:水稻纹枯病菌(Rhizoctonia solani)、油菜菌核病菌(Sclerotinia sclerotiorum)、小麦赤霉病菌(Fusarium graminearum)、桃褐腐病菌(Monilinia fructicola)、稻瘟病菌(Pyricularia oryae)、草莓灰霉病菌(Botrytis cinerea)、辣椒疫霉病菌(Phytophthora capsici)、黄瓜枯萎病菌(Fusarium oxysporumf.sp.cucumerinum)、桃枝枯病菌(Phomopsis amygdali)、棉立枯病菌(Rhizoctonia solani)、瓜果腐霉病菌(Pythium aphanidermatum)、番茄枯萎病菌(Fusarium oxysporumf.sp.radicislycopersic)、茭白胡麻斑病菌(Helminthosporium zizaniae)。
供试培养基:马铃薯葡萄糖琼脂培养基为马铃薯200.0 g/L、葡萄糖20.0 g/L、琼脂15.0 g/L,pH 值自然;稻秆粉培养基为水稻秸秆或稻壳30%~40%、棉籽壳30%~40%、豆粕2%~7%、麦麸7%~15%、米糠7%~15%、玉米粉3%~9%、生石灰0.5%~3%[10];LB 培养基为胰蛋白胨10.0 g/L、酵母提取物5.0 g/L、氯化钠10.0 g/L,pH 值7.2~7.4。
1.2 苗期防病试验
将水稻品种武育粳3 号种子经1%H2O2浸泡1 d后,用30 ℃清水浸泡2 d。待绝大多数种子发芽后分别播于育秧盘,一个盘40 穴,每穴3 株,每10 穴一个重复,每个处理3 次重复。稻瘟病菌孢子制备参照周益军等[11]的方法,将稻瘟病菌在产孢培养基(稻秆粉培养基)上培育7 d,黑光灯照射处理3 d,将分生孢子洗脱,配成106个/mL 的孢子悬浮液备用。
将新活化的供试生防细菌接种于50 mL LB 液体培养基中,在28 ℃170 r/min 振荡培养48 h,直接用细菌悬浮液喷雾处理水稻秧苗,24 h 后再用稻瘟病菌孢子悬浮液喷雾接种,接种后移至温室内,再用塑料薄膜覆盖保温保湿,7~10 d 调查发病情况,计算病情指数及防治效果。

1.3 抑菌谱测定
将直径0.5 cm 病原菌菌碟接种于PDA 平板中央,取3 μL 的细菌悬浮液接种于距离培养皿边缘10 mm 处,置25 ℃恒温箱中培养5~15 d,测定抑菌带宽。每处理3 次重复。
1.4 菌株鉴定及数据处理
CTAB/NaCl 法提取菌株5-8 基因组DNA。采用16S rDNA 保守引物16S-63F 和16S-1387R(表1)进行PCR 扩增,PCR 反应程序:94 ℃预变性5 min;98 ℃变性10 s,30 个循环;55 ℃退火15 s;72 ℃延展1 min。扩增产物直接送到上海生工生物工程有限公司进行测序。采用BLASTn 在GenBank 数据库进行同源序列搜索,用MEGA 5.0 软件进行多重序列比对及系统发育分析(邻接法),并用Bootstrap 软件对进化树进行1 000 次可信度分析。
接种新活化的5-8 单菌落,28 ℃振荡培养至麦比浊度为1.80~2.20 MCF,将BCL 卡(VITEK)和试管菌液放入VITEK-2 Compact 30 全自动微生物鉴定与药敏分析系统,对菌株5-8 进行生理生化特征分析。
1.5 生防作用机制分析
1.5.1 拮抗细菌5-8 抗生素合成相关基因检测 据报道,芽孢杆菌属细菌通常采用非核糖体途径产生丰原素、伊枯草菌素和表面活性素等脂肽类物质[12],因此试验以菌株5-8 基因组为模板,利用表1 中的引物fenB-F/fenB-R、IturinA-F/IturinA-R、Surfactin-F/Surfactin-R 扩增丰原素、伊枯草菌素和表面活性素的保守区序列,PCR 采用标准循环条件,退火温度分别为53 ℃(fenB)、43 ℃(ituA)、46 ℃(sfp),使用1%琼脂糖凝胶对PCR 产物进行电泳检测。

表1 试验所用引物
1.5.2 脂肽化合物提取及质谱检测 取新活化的5-8 单菌落接种于200 mL 的LB 培养液中,28 ℃避光振荡培养2 d,4 ℃、5 000 r/min 离心30 min,收集上清液。将上清液倒入三角瓶,加入6~7 mol/L 的HCl,调节至pH=2,4 ℃过夜沉淀。将液体在4 ℃、5 000 r/min 离心30 min,收集沉淀。取50 mL 的甲醇萃取沉淀8 h,4 ℃、5 000 r/min 离心30 min,收集上清液。用同样方法萃取两次,合并上清液。使用旋转蒸发仪(EYELA N-1300)旋蒸得到粗提物,使用1~2 mL 的甲醇溶液溶解粗提物并用直径0.2 μm 偏氟乙烯膜过滤,获得粗提液[13]。
质谱分析在扬州大学测试中心完成,质谱仪器为5800 MALDI/TOF/TOF 串联飞行时间质谱仪(AB SCIEX,USA)。点样的样品为真空离心浓缩后以50%乙腈、50%水和0.1%三氟乙酸(TFA)的溶液复溶。样品与基质(α-氰基-4-羟基肉桂酸,CHCA)以“基质-样品-基质”的顺序夹心点样,待自然干燥后进行靶标分析。基质工作液溶剂包含0.1%三氟乙酸,50%乙腈配制的基质(CHCA)饱和溶液。激光源为200 Hz(355 nm 波长)的Nd:YAG 激光器,加速电压为20 KV。MS 采集模式为反射正离子模式,质量为800~4 000 Da。采用Default 方式处理样品点。先用多肽标准品(AB SCIEX,USA)进行内标校正,再进行采集,每个图谱采集4 000 shots。
1.5.3 活性物质对稻瘟病菌分生孢子萌发率的影响 将得到的脂肽粗提物使用60 ℃金属浴烘干并称重。将不同浓度的脂肽粗提物(0、1.0、1.5、2.0 mg/mL)加入含有稻瘟病菌分生孢子的PDB 培养液制成孢子悬浮液,以等体积的甲醇溶液做对照,得到终浓度为105个/mL 孢子。放至28 ℃培养箱中培养,当芽管长度大于病菌分生孢子直径时,视为孢子萌发。用目镜测微计Primostar176045-fed 微目镜测量孢子萌发率。每个重复中测定大约100 个孢子,每个处理设3 次重复。
1.5.4 细胞膜完整性测定 本研究采用荧光碘化丙啶(PI)检测细胞膜完整性。将稻瘟病菌孢子加入含有不同浓度脂肽粗提物(0、1.0、1.5、2.0 mg/mL)的PDB 培养基,25 ℃静置培养4 h,4 000 r/min 离心5 min 收集孢子,室温下用0.01 g/L PI 染色30 min,用磷酸盐缓冲液(PBS)洗涤3 次,并在OLYMPUS BS53C 荧光显微镜(日本奥林巴斯)下观察(PI 激发波长:535 nm,发射波长:615 nm)。每个处理随机选择100 个孢子,重复3 次。孢子膜的完整性根据以下公式计算

1.6 数据分析
采用唐启义等[15]DPS 6.55 统计学软件中的LSD多重比较法对数据进行差异显著性分析。
2 结果与分析
2.1 拮抗细菌对苗期稻瘟病防效测定
温室盆栽试验结果表明,对照的病情指数为61.11,菌株DC1、JY1-5、55、53、HTC-5、29 和B.amyloliquefaciensW10 的病情指数均在40.00 以上,且与对照差异不显著(P>0.05)。菌株5-8的病情指数最低为4.90,防病效果达90%以上,其次是P.chlororaphis7-5,该细菌的病情指数为26.53,防效可达56.5%,且两种细菌处理均与对照差异显著(P<0.05)。由此可见,菌株5-8的防病效果最好,后续工作主要针对菌株5-8 进行深入研究(图1)。
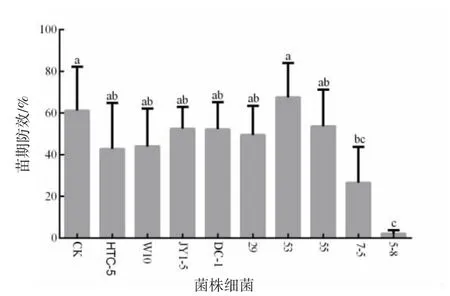
图1 拮抗细菌对水稻稻瘟病的防病效果
2.2 抑菌谱的测定
菌株5-8 抑菌谱广,对桃褐腐病菌和油菜菌核病菌抑菌能力最强,抑菌带宽分别为1.83 cm 和1.80 cm,其次为桃枝枯病菌、瓜果腐霉病菌和黄瓜枯萎病菌,抑菌带宽分别为1.15、1.14、1.08 cm,对小麦赤霉病菌和棉立枯病菌抑菌效果最差(表2)。
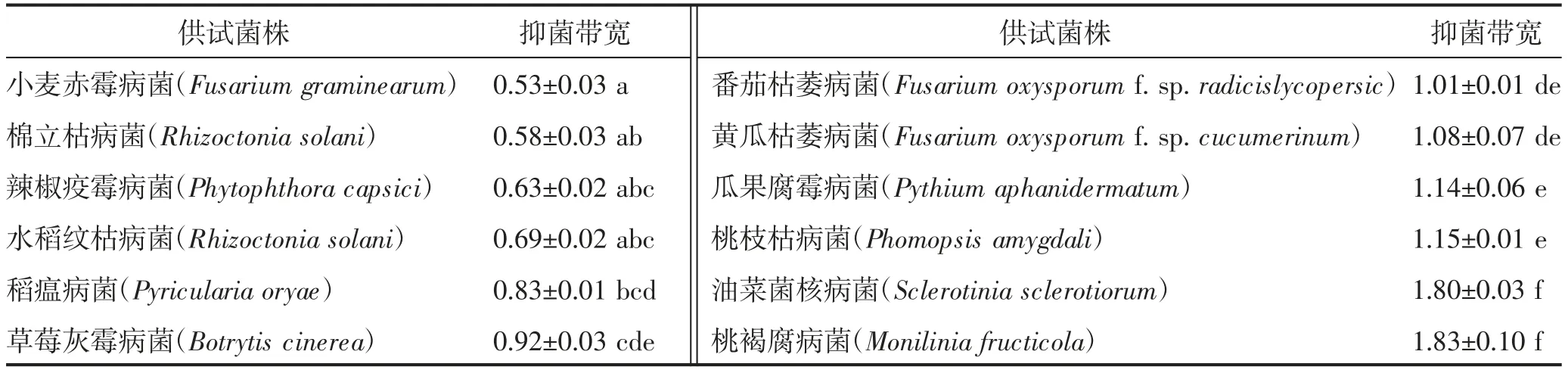
表2 菌株5-8的抑菌谱测定 单位:cm
2.3 菌株5-8的种类鉴定
将菌株5-8的16S rDNA 基因序列在GenBank中比对分析,结果表明,与B.subtilis的s127e、B.amyloliquefaciensSSH100-3 及B.velezensisTY190-16相似度均达到99%以上,可初步判定菌株5-8 属于芽孢杆菌属细菌,其16S rDNA 序列登录号为MT584667。系统发育进化树显示,菌株5-8 与贝莱斯芽孢杆菌Bacillus velezensisCR-502(AY603658)处于同一分支(图2)。

图2 菌株5-8 16S rDNA 系统发育树
在LB 固体培养基表面菌株5-8 菌落呈乳白色,粗糙、边缘略有不规则,革兰氏染色阳性。在15~45 ℃及6.5%的NaCl 溶液中可生长,氧化酶呈阳性,可利用糖原、麦芽三糖、D-葡萄糖、D-甘露糖等,不能利用D-松二糖和D-松三糖,不能水解吐温20。这些指标符合贝莱斯芽孢杆菌生理生化特征(表3)。结合菌株5-8 16S rDNA 基因序列同源性分析和生理生化指标测定结果,初步鉴定为贝莱斯芽孢杆菌(B.velezensis)[16]。

表3 菌株5-8 生理生化指标
2.4 抗生素合成相关基因的PCR 检测
脂肽类抗生素合成基因PCR 扩增结果显示(图3),菌株5-8 基因组中可扩增到1 400 bp 的fenB基因、1 200 bp 的ituA基因,未扩增到sfp基因,说明该细菌可能产生丰原素、伊枯草菌素,不能产生表面活性素。

图3 菌株5-8 抗生素合成相关基因的PCR 检测
2.5 抗菌活性物质质谱分析
根据MALDI-TOF MS 检测一级质谱图谱显示(图4),强度最大的峰主要集中在1 050~1 100 m/z,此范围内主要峰包括m/z1 065.5、m/z1 079.6、m/z1 081.5、m/z1 095.5。根据文献报道,其中m/z1 065.5和m/z1 079.6 的峰分别为C14-IturinA [M+Na]+和C15-IturinA[M+Na]+;m/z1 081.5 和m/z1 095.5 的峰分别为C14-IturinA[M+K]+和C15-IturinA[M+K]+。脂肽抗生素通常以同系物的形式存在,结合标准品分子量的大小,最终明确m/z1 065.5、m/z1 079.6、m/z1 081.5、m/z1 095.5 分别为C14-IturinA[M+Na]+、C15-IturinA[M+Na]+、C14-IturinA[M+K]+、C15-IturinA[M+K]+。初步判定菌株5-8 产生的抗菌活性物质为iturin A 及其同系物[17]。

图4 抗菌物质MALDI-TOF MS 检测一级质谱图谱
2.6 抗菌活性物质对稻瘟病菌分生孢子萌发的影响
不同浓度的粗提物对稻瘟病菌分生孢子萌发有不同程度的影响,1.0 mg/mL 的活性物质不能抑制稻瘟病菌分生孢子萌发,用1.5 mg/mL 的活性物质处理后,分生孢子萌发率约为50%,添加2.0 mg/mL 的活性物质可完全抑制分生孢子萌发(图5)。
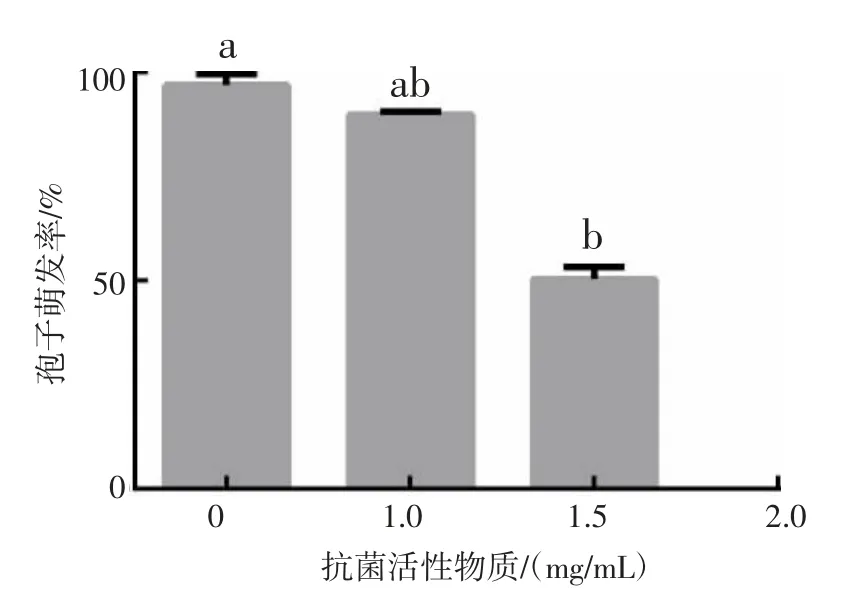
图5 抗菌活性物质对分生孢子萌发的影响
2.7 抗菌活性物质对分生孢子细胞膜的破坏
用PI 法测定了抗菌活性物质对细胞膜完整性的影响。PI 是一种常用的细胞核荧光染料,不能穿透细胞膜而被排斥在活细胞外,但是可以穿过破损的细胞膜而对核染色,并能发出红色荧光。不同浓度的抗菌物质对稻瘟病菌分生孢子细胞膜有不同程度的破坏,细胞膜的完整性与抗菌活性物质浓度呈负相关,且各处理与对照相比差异均显著(P<0.05)。当抗菌活性物质浓度为2.0 mg/mL 时,细胞膜完整性失膜率最高,达到34%(图6)。
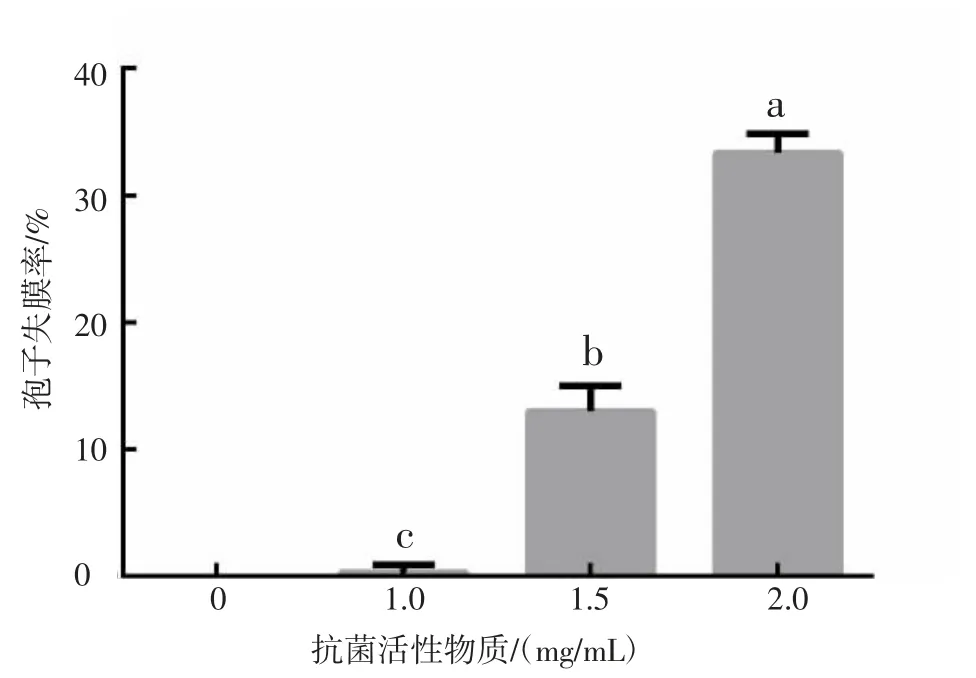
图6 抗菌活性物质对细胞膜完整性的影响
3 结论与讨论
已报道的生防细菌中,有较多关于芽孢杆菌属细菌的研究,该属细菌抑菌谱广、能产生大量的次生代谢物,且具有良好的抑制植物病原物生长的能力,因此,许多芽孢杆菌在生物防治和作为粮食产量增产剂上发挥重要作用。已报道的生防芽孢杆菌主要有枯草芽孢杆菌(Bacillus subtilis)、蜡样芽孢杆菌(B.cereus)和解淀粉芽孢杆菌(B.amyloliquefaciens)等,而芽孢杆菌(B.velezensis)是2005年由RUIZ-GARCÍA[16]新命名的芽孢杆菌种,中文名为贝莱斯芽孢杆菌,近年来此类生防菌的报道日益增加。本研究拮抗细菌中筛选到一株对稻瘟病防病效果好的生防菌5-8,通过16S rDNA 基因序列同源性分析和生理生化指标测定将其鉴定为贝莱斯芽孢杆菌(B.velezensis)。
目前,芽孢杆菌属细菌对病原菌的生防机制研究较多,如竞争作用、拮抗作用和诱导植物抗病性。其中,次生代谢产生的抗生素及挥发性物质产生的拮抗作用是生防细菌最主要的抗菌机制。该属细菌能产生非核糖体途径的脂肽类抗生素,如表面活性素、丰原素和伊枯草菌素;核糖体途径合成的肽类抗生素,如类羊毛硫抗生素和枯草菌素等[18-19]。此外,该属细菌还可产生抗菌蛋白、吲哚-3-乙酸、嗜铁素和NH3[20-21]。HONMA 等[22]研究发现,贝莱斯芽孢杆菌含有表面活性素和plipastatin 的编码基因,它们分别显示较强的抗细菌和抗真菌活性。LIM 等[23]从菌株G341 中分离出两种抗真菌化合物,并通过MS/MS分析鉴定为杆菌霉素L 和fengycinA。此外,菌株G341 产生的挥发性化合物能够抑制各种植物病原真菌的菌丝生长。XU 等[24]从B.velezensisZJ20 中提取的β-葡聚糖酶粗酶液可抑制杨树紫纹羽病菌菌丝的生长。B.velezensisB6 对黄瓜枯萎病和辣椒根腐病具有良好的防治效果。此外,B.velezensisB6可以抑制多毛虫的繁殖,并延缓黄曲霉中尖孢镰刀菌的传播,以抑制病害的扩展[25]。本研究发现,B.velezensis基因组中具有fenB和ituA基因,但活性物质经MALDI-TOF 检测,只得到产生伊枯草菌素的离子峰,可能目前的培养条件不利于丰原素产生。
已有报道指出,枯草芽孢杆菌T429[26]、侧孢短芽孢杆菌[27]、短小芽孢杆菌[28]等均对水稻稻瘟病有一定的防治效果。本研究测定了菌株5-8 代谢产物对稻瘟病菌的抑制作用,提取的伊枯草菌素浓度为1.0、1.5、2.0 mg/mL 对稻瘟病菌孢子的萌发均有一定的影响,以2.0 mg/mL 抑制作用最强,孢子完全不萌发,为该细菌代谢产物田间应用提供重要参考。
