不同耕作方式对土壤酶活性及微生物量和群落组成关系的影响
2021-08-26青格尔高聚林于晓芳胡树平薛红飞刘瑞枝刘爱业
冯 彪,青格尔,高聚林,于晓芳,胡树平,张 鑫,薛红飞,刘瑞枝,刘爱业
(1.内蒙古农业大学农学院,内蒙古呼和浩特 010019;2.内蒙古农业大学职业技术学院,内蒙古萨拉齐 014109;3.巴彦淖尔市乌拉特前旗农牧和科技局,内蒙古乌拉山 015400)
土壤酶和土壤微生物是衡量土壤质量状况的重要指标[1]。酶活性反映了土壤中生物的化学进程[2]。土壤微生物量与酶活性紧密联系,土壤微生物的种类数量与有机质分解、矿质元素转换有直接关系,进而影响了作物对营养元素的吸收利用[3]。耕作方式作为影响土壤酶活性的一种重要因素,不仅导致土壤理化指标及生物学指标发生改变,也会使土壤微生物群落组成发生改变,并且使耕作方式的响应速度加快[4]。同时,由于土壤中微生物数量的改变也会使酶活性发生变化[5]。耕作方式既可通过改变土壤结构调节微生物的数量[6],也可通过改变土壤的矿化和养分吸收影响土壤微生物的数量[7]。梁金凤等[8]研究表明,深松可降低土壤容重、提高孔隙度,进而促进微生物的活化和矿质元素的分解,增加细菌、放线菌的数量。刘红杰等[9]研究表明,深翻耕作可通过增加土壤微生物的数量,进而使土壤磷酸酶和蔗糖酶活性提高。高旭梅等[10]研究得出,深耕方式显著增加土壤脲酶、碱性磷酸酶和蔗糖酶活性。张志政等[11]通过研究深松对根际土壤养分及微生物群落功能多样性得出,深松可通过改善微生物的生存环境,提高土壤微生物群落组成。
针对土默川平原灌区土壤肥力低的问题,本研究开展了不同耕作方式长期定位试验,旨在明确不同耕作方式下土壤酶活性、微生物数量及微生物量碳、微生物量氮的变化,分析土壤酶活性的变化及其与土壤微生物量的关系,并采用16S rRNA 扩增子测序技术对不同耕作方式下土壤细菌群落组成进行分析,以确定不同耕作方式下土壤细菌群落的菌种组成情况,从而建立合理的耕作模式,为土默川平原灌区土壤质量提升提供生物学基础,为当地采取适宜的耕作方式提供理论依据及技术支撑。
1 材料和方法
1.1 试验时间与地点
于2018—2019年在内蒙古农业大学玉米中心试验地进行土壤耕作方式定位试验,位于内蒙古土默特右旗沟门镇北只图村(40°32′N,110°28′E)。该地区属半干旱中温带大陆性季风气候,年均气温6~8 ℃,年降水总量400 mm,无霜期140 d,海拔1 015 m,年日照时数2 806 h,年活动积温为3 000~3 500 ℃。试验田为沙壤土,未采取耕作方式前土壤基础肥力为有机质含量22.04 g/kg、碱解氮含量57.82 mg/kg、速效磷含量3.57 mg/kg、速效钾含量84.97 mg/kg,前茬作物为春玉米。试验期间的气象因子见图1。

图1 试验地气象因子变化
1.2 试验设计
本试验采用大区设计,共设5 个不同耕作方式处理,分别为农户浅旋对照(CK),条深旋(SC,旋耕深度为20 cm),深松(SS,深松深度为35 cm 和深松铲间距为60 cm),深翻(DP,深翻深度为45 cm),免耕(NT),每个处理800 m2,种植玉米品种为先玉696,施肥量:N 475 kg/hm2、P2O5210 kg/hm2、K2O 202.5 kg/hm2,其中,N 按3∶7 分别于拔节期、大喇叭口期追施,P2O5和K2O 作种肥一次性施入,其他管理同一般大田。
1.3 土壤样品取样方法
播种前土样采用“S”形取样法,在每个大区采集0~45 cm 土壤样品后均匀地混合在一起,3 次重复,过2 mm 筛除去动植物残体等杂物,四分法去除多余土样,装入密封袋,立即运回实验室,分成3 份:第一份土样风干后,用于测定土壤酶活性;第二份土样保存于4 ℃冰箱中,用于土壤微生物量碳、微生物量氮和土壤微生物数量的测定;第三份土样保存于-80 ℃冰箱,用于土壤细菌群落组成及多样性的测定。
1.4 测定指标与方法
1.4.1 土壤酶活性测定 蔗糖酶和纤维素酶活性采用3,5-二硝基水杨酸比色法测定[12];脲酶活性采用靛酚蓝比色法测定[12];过氧化氢酶活性采用高锰酸钾滴定法测定[12];碱性磷酸酶活性采用磷酸苯二钠比色法测定[12];蛋白酶活性采用茚三酮比色法测定[12]。土壤酶活性综合指数(GME)测定:求取土壤蔗糖酶、碱性磷酸酶、脲酶、过氧化氢酶、蛋白酶、纤维素酶活性集合平均数,作为衡量土壤质量的综合酶活性指标[13],计算公式

1.4.2 土壤微生物量碳、微生物量氮的测定 采用氯仿熏蒸K2SO4提取法测定[14-15]土壤微生物量碳、微生物量氮,土壤微生物量碳计算公式

土壤微生物量氮计算公式

式中,0.38 和0.45 分别为土壤微生物量碳和微生物量氮的系数;EC和EN分别为熏蒸和未熏蒸土壤K2SO4浸提液有机碳和全氮含量的差值。
1.4.3 土壤微生物数量测定 采用稀释平板涂抹培养计数法。细菌采用牛肉膏蛋白胨琼脂培养基37 ℃培养2 d;放线菌采用改良的高氏一号培养基(每300 mL 培养基中加3%重铬酸钾1 mL)28 ℃培养7 d;真菌采用PDA 培养基(每100 mL 培养基加1%链霉素溶液0.3 mL)培养3 d[12]。
1.4.4 土壤微生物群落结构测定 根据E.Z.N.A.soil DNA kit(Omega Bio-tek,Norcross,GA,U.S.)说明书进行微生物总DNA 提取,使用1%的琼脂糖凝胶电泳检测DNA 的提取质量,使用NanoDrop2000测定 DNA 浓度和纯度; 使用 338F(5′ -ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)[15]对16S rRNA基因V3~V4 可变区进行PCR 扩增,扩增程序如下:95 ℃预变性3 min,27 个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),然后72 ℃稳定延伸10 min,最后在4 ℃进行保存(PCR 仪:9700 型)。PCR 反应体系为:5×TransStart FastPfu缓冲液4 μL,2.5 mmol/L dNTPs 2 μL,上游引物(5 μmol/L)0.8 μL,下游引物(5 μmol/L)0.8 μL,TransStart FastPfu DNA 聚合酶0.4 μL,模板DNA 10 ng,补足至20 μL。每个样本3 个重复。
1.5 数据处理与统计分析
采用Microsoft Excel 2010 软件进行数据整理和初步处理,用SPSS Statistics 22.0 软件进行差异显著性和主成分分析。采用SigmaPlot 12.5 和R 语言(R3.6.1)作图。使用UPARSE 软件(version 7.1,http://drive5.com/uparse/)对16S rRNA 序列用Gold 数据库[17]进行嵌合体检验与去除,根据97%的相似度对序列进行 OTU 聚类并剔除嵌合体。利用RDP classifier(http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,与Silva 数据库(SSU128)比对,设置比对阈值为70%。构建好的扩增子测序文库送至上海美吉生物医药科技有限公司使用Illumina Miseq PE300 测序平台进行序列测定。
2 结果与分析
2.1 不同耕作方式对土壤酶活性的影响
由表1 可知,在耕作方式间,土壤过氧化氢酶、脲酶、蔗糖酶、碱性磷酸酶、蛋白酶和纤维素酶活性差异极显著(P<0.01);在年份间,土壤脲酶、蔗糖酶、碱性磷酸酶、蛋白酶和纤维素酶活性差异极显著(P<0.01),土壤过氧化氢酶活性差异不显著(P>0.05);在年份×耕作方式间,土壤蔗糖酶、碱性磷酸酶、蛋白酶和纤维素酶活性差异极显著(P<0.01),土壤过氧化氢酶、脲酶活性差异不显著(P>0.05)。

表1 不同耕作方式土壤酶活性 单位:mg/g
2018年,土壤过氧化氢酶活性DP、SS 处理较CK 处理分别提高了22.31%和35.06%,NT、SC 与CK 处理差异不显著(P>0.05),SS 处理较DP 处理显著(P<0.05)提高了10.42%;土壤脲酶活性NT、DP、SS 和SC 处理较CK 处理分别提高了30.80%、54.97%、63.68%和17.42%,DP、SS 处理较NT、SC 处理分别显著(P<0.05)提高18.48%、31.98%和25.14%、39.39%;土壤蔗糖酶活性NT、DP、SS 和SC处理较CK 处理分别提高了27.28%、37.47%、40.22%和32.45%,SS 处理较NT、SC 处理分别显著(P<0.05)提高10.17%、5.87%,DP 处理较NT 处理显著(P<0.05)提高7.97%,较SC 处理提高3.77%;土壤碱性磷酸酶活性NT、DP、SS 和SC 处理较CK 处理分别提高了4.33%、25.74%、38.39%和12.22%,SS处理较NT、DP、SC 处理分别显著(P<0.05)提高32.64%、10.06%、23.32%,DP 处理较NT 和SC 处理分别显著(P<0.05)提高20.51%和12.05%;土壤蛋白酶活性DP、SS 处理较CK 处理分别提高了5.17%和11.06%,NT、SC 与CK 处理差异不显著(P>0.05);土壤纤维素酶NT、DP、SS 和SC 处理较CK 处理分别提高了16.71%、11.47%、23.44%和5.49%,SS 处理较NT、DP、SC 处理分别显著(P<0.05)提高5.77%、10.74%和17.02%。2019年与2018年趋势一致,2019年土壤过氧化氢酶、脲酶、蔗糖酶活性SS 处理较NT、DP、SC、CK 处理分别显著(P<0.05)提高33.37%、7.48%、18.90%和34.36%,18.29%、5.67%、32.52%和38.91%,17.90%、5.91%、28.79%和55.69%。土壤碱性磷酸酶和蛋白酶活性DP 和SS 处理较NT、SC、CK 处理分别显著(P<0.05)提高15.30%、24.58%、30.46%和18.15%、27.67%、33.69%,21.60%、23.16%、56.36%和21.20%、22.76%、55.85%;土壤纤维素酶活性DP 处理较NT、SS、SC 和CK 处理分别显著(P<0.05)提高了11.80%、1.33%、14.92%和18.21%。综上所述,各耕作处理均可明显提高土壤酶活性,尤以SS 处理提高效果最为显著。
2.2 不同耕作方式对土壤酶活性综合指数(GME)的影响
不同耕作处理下土壤酶活性综合指数见图2,2018年各处理土壤GME 表现为SS>DP>NT>SC>CK,NT、DP、SS 和SC 处理较CK 处理分别显著(P<0.05)提高11.48%、25.06%、34.29%和11.49%,SS 处理较NT、DP 和SC 处理分别显著(P<0.05)提高20.46%、7.38%和20.45%,各处理均显著(P<0.05)高于CK 处理;2019年各处理土壤GME 表现与2018年基本一致,以SS 处理GME 最高。年际间表现为2019年高于2018年,2019年GME 表现为NT、DP、SS、SC 和CK 处理较2018年分别增加19.10%、23.05%、18.34%、15.07%和16.85%,其中DP 处理提高幅度最明显。综上所述,NT、DP、SS 和SC 处理均可明显提高土壤GEM 活性,其中SS 处理提高效果最为显著。

图2 不同耕作方式土壤GME 变化
2.3 不同耕作方式对土壤微生物数量及微生物量碳、微生物量氮含量的影响
由表2 可知,土壤微生物数量在耕作方式和年份间均呈显著或极显著差异(P<0.01),在耕作方式×年份间互作差异不显著(P>0.05);微生物量碳含量在耕作方式间存在极显著差异(P<0.01),在年份及耕作方式年份互作间差异不显著(P>0.05);微生物量氮在年份间存在极显著差异(P<0.01),在耕作方式及耕作方式×年份互作间差异不显著(P>0.05)。2018年,NT、DP、SS、SC 处理土壤细菌数量较CK 处理分别显著(P<0.05)提高54.55%、107.27%、61.82%和67.27%,DP 处理较NT、SS 和SC 处理分别显著(P<0.05)提高96.67%、73.53%和59.46%,NT、SS 和SC 处理间差异不显著(P>0.05),但均显著(P<0.05)高于CK 处理。NT、DP、SS、SC 处理土壤真菌和放线菌数量较CK 处理分别提高57.58%、84.85%、81.82%、36.35%和12.50%、31.25%、15.63%、25.00%,其中,NT、DP、SS 处理土壤真菌数量与CK 处理差异显著(P<0.05),DP、SC 处理土壤放线菌数量与CK处理差异显著(P<0.05);NT、DP、SS 和SC 处理差异不显著(P>0.05)。NT、DP、SS、SC 处理土壤微生物量碳较CK 处理分别提高9.78%、14.65%、15.31%和6.36%,其中,DP、SS 处理土壤微生物量碳与CK 处理差异显著(P<0.05);NT、DP、SS 和SC 处理差异不显著(P>0.05)。DP、SS、SC 处理土壤微生物量氮较CK 处理分别提高9.50%、10.95%和0.27%,其中,DP、SS 处理土壤微生物量氮与CK 处理差异显著(P<0.05);DP 和SS 处理较NT 和SC 处理分别显著(P<0.05)提高10.23%、9.20%和11.71%、10.65%。2019年与2018年趋势一致,2019年DP 和SS 处理均显著(P<0.05)高于NT、SC 和CK 处理,且年际间2019年细菌、真菌、放线菌数量和微生物量碳、微生物量氮较2018年分别增加19.84%和49.03%、14.34%和34.92%、25.23%和43.68%、9.89%和4.08%、20.79%和21.00%。综上所述,各耕作处理均可明显提高土壤微生物量,其中DP、SS 处理提高效果最为显著。
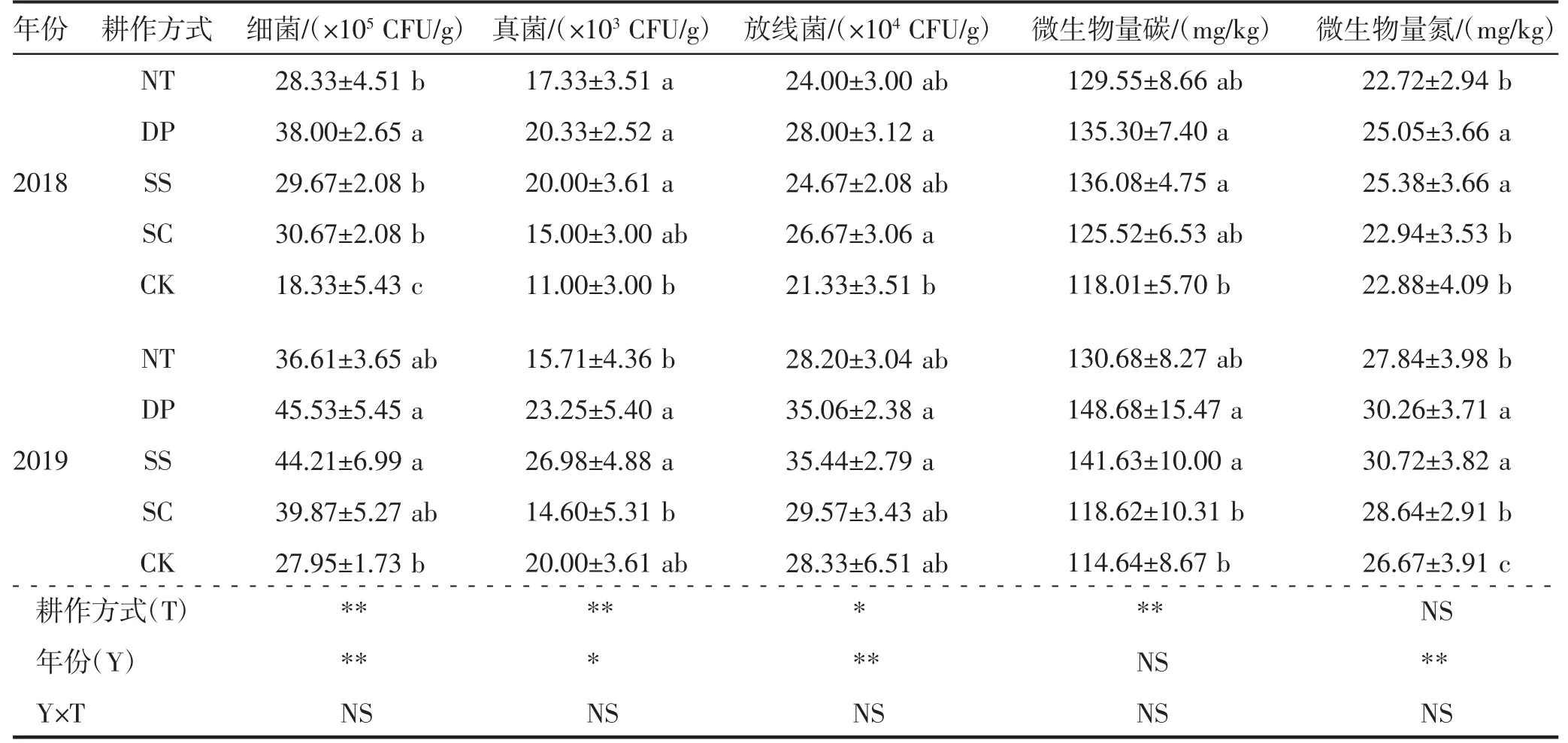
表2 不同耕作方式土壤微生物数量
2.4 土壤酶活性与土壤微生物量碳、微生物量氮及数量相关性分析
由表3 可知,土壤细菌数量与土壤过氧化氢酶、脲酶、蔗糖酶、碱性磷酸酶、蛋白酶和纤维素酶活性呈显著或极显著正相关关系,相关系数分别为0.660、0.864、0.857、0.824、0.739 和0.790,土壤真菌、放线菌数量和微生物量碳、微生物量氮与脲酶、蔗糖酶和碱性磷酸酶活性呈显著或极显著正相关关系;细菌、放线菌数量和微生物量碳、微生物量氮与蛋白酶活性的相关系数分别为0.739、0.704、0.858 和0.679,细菌、真菌、放线菌数量和微生物量氮与纤维素酶的相关系数分别为0.790、0.672、0.857 和0.957。

表3 土壤酶活性与土壤微生物数量相关性分析
2.5 耕作方式对土壤细菌群落结构组成特性分析
2.5.1 不同耕作方式对土壤细菌门水平群落结构组成的影响 不同耕作方式土壤细菌门水平分类主要由Actinobactera(放线菌门,28.90%~48.22%),Proteobacteria(变形菌门,16.72%~20.70%),Chloroflexi(绿弯菌门,14.37%~28.00%),Acidobacteria(酸杆菌门,9.42%~16.98%),Gemmatimonadetes(芽单胞菌门,2.71%~4.58%),Firmicutes(厚壁菌门,1.91%~3.47%),Bacteroidetes(拟杆菌门,1.30%~1.92%)等组成(图3),但各个类群在不同耕作方式中所占比例存在差异。Actinobacteria 表现为NT 处理显著(P<0.05)高于其他处理,丰度为48.22%;SS 处理Chloroflexi、Acidobacteria 丰度为28.00%、16.97%,显著(P<0.05)高于其他处理;Proteobacteria 表现为DP 处理显著(P<0.05)高于其他处理,丰度为20.69%。

图3 不同耕作方式优势细菌门水平组成及丰度
2.5.2 不同耕作方式对土壤细菌属水平群落结构组成的影响 不同耕作方式土壤属水平细菌群落结构较为相似(图4),Arthrobacter(节杆菌属)、Gaiella(盖氏菌属)、Blastococcus(牙球菌属)、Bacillus(芽孢杆菌属)、RB41、Nocardioides(类诺卡氏菌属)为优势菌属,但各个类群在不同耕作方式中所占比例存在差异。5 种耕作方式中,DP 处理的Arthrobacter(节杆菌属)相对丰度最大,在2.06%~5.97%;NT 处理主要由Arthrobacter(4.56%)、Streptomyces(4.95%)、Gaiella(2.38%)、MND1(2.91%)和Sphingomonas(2.23%)组成;与其他处理相比,SS 和SC 处理分布较多的为Arthrobacter(2.06%、2.49%)、Nordella(2.14%、1.40%)、Bacillus(1.47%、1.66%)和Sphingomonas(2.11%、3.35%);DP 处理分布较多的为Arthrobacter(5.96%)、Gaiella(1.41%)、Sphingomonas(1.93%)、MND1(1.25%);CK处理中Arthrobacter、Gaiella、Sphingomonas、MND1、Nordella等菌属丰度较高,分别为3.62%、2.14%、2.50%、2.50%、1.78%。Arthrobactre、Bacillus属在DP处理中相对丰度显著(P<0.05)高于其他处理,而在NT 和CK 处理间差异不显著(P>0.05);Gaiella、MND1属在NT 处理中的相对丰度显著(P<0.05)高于DP、SS 和SC 处理,但NT 和CK 处理差异不显著(P>0.05);Sphingomonas在SC 处理中的相对丰度最高,显著高于其他处理(P<0.05);Streptomyces表现为NT 处理丰度较高,在DP 和SS 处理中差异不显著(P>0.05)。
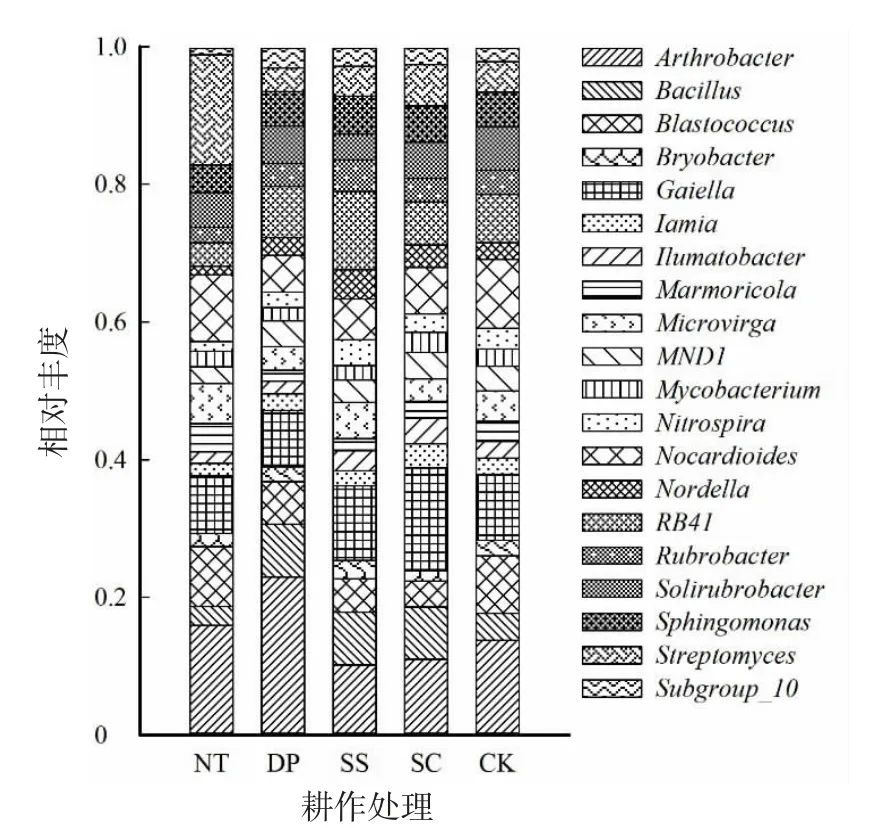
图4 不同耕作方式优势细菌属水平组成及丰度
2.6 不同耕作方式下土壤酶活性、微生物量与菌群相关性分析
为进一步明确不同耕作方式土壤酶活性、微生物量与细菌群落组成的关系,对土壤样品中优势细菌门与酶活性、微生物量及菌群数量进行的相关性分析(图5),Chloroflexi 与土壤过氧化氢酶、蔗糖酶活性和细菌数量呈极显著正相关关系,相关系数分别为0.61、0.54 和0.54;Firmicutes 与土壤过氧化氢酶、蛋白酶活性和细菌数量呈显著正相关关系,相关系数分别为0.63、0.61 和0.58;土壤真菌数量与Acidobacteria 呈显著正相关关系,相关系数为0.55;土壤过氧化氢酶活性与Planctomycetes 呈显著正相关关系,相关系数为0.59,Actinobactera 与过氧化氢酶活性、细菌和真菌数量呈显著负相关。由此可知,土壤过氧化氢酶活性显著影响Chloroflexi、Firmicutes 和Planctomycetes 的分布,细菌数量显著影响Chloroflexi、Firmicutes 的分布,真菌数量显著影响Acidobacteria 的分布。
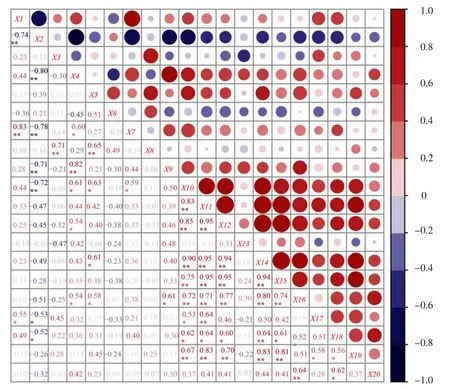
图5 土壤酶活性、微生物量与菌群相关性分析
3 讨论
3.1 不同耕作方式下土壤酶活性与微生物量的关系
土壤过氧化氢酶、蔗糖酶、脲酶、碱性磷酸酶、蛋白酶和纤维素酶活性在土壤碳、氮等养分循环中发挥重要作用。本研究表明,与农户浅旋(对照)处理相比,各耕作方式均显著提高了土壤酶活性,深松处理提高效果最佳。微生物量碳、微生物量氮与脲酶、纤维素酶、蔗糖酶、蛋白酶活性呈显著或极显著正相关关系,细菌、真菌、放线菌数量和微生物量碳、微生物量氮与脲酶、蔗糖酶和碱性磷酸酶活性呈显著正相关关系。PIOVANELLI 等[17]研究表明,深耕能够通过改变耕层土壤结构,利于土壤有机质的积累,改善了微生物生存的环境,进而影响土壤微生物数量[17]。李忠和[18]研究土壤微生物及酶活性对土壤碳变化影响发现,土壤中微生物量碳含量与微生物数量呈正相关。土壤微生物量是评价土壤养分有效性和土壤微环境变化的敏感指标之一[19]。土壤微生物量碳作为土壤有机碳中最活跃的部分,参与土壤中养分的转化和腐殖质的形成和分解过程[20]。张洁等[21]研究表明,深松处理能够提高土壤微生物量碳、微生物量氮。杨敏芳等[22]研究表明,深翻处理较浅旋处理显著提高土壤微生物量碳、微生物量氮含量。本研究结果表明,深翻和深松处理的整体微生物量碳、微生物量氮均高于农户浅旋处理,且深翻和深松处理土壤中微生物数量较高,与梁金凤等[8]、张向前等[23]和张继光等[24]的研究结果一致。
3.2 不同耕作方式下土壤微生物群落组成的变化
在门分类水平上,不同耕作方式土壤细菌群落主要由Actinobactera、Proteobacteria、Chloroflexi、Acidobacteria、Gemmatimonadetes、Firmicutes 等菌门组成,Proteobacteria、Actinobactera 和Acidobacteria丰度较高,且Proteobacteria 和Acidobacteria 在各处理中差异不显著,说明对耕作方式的改变反应不敏感,这与傅敏等[25]的研究结果一致。Proteobacteria 和Actinobacteria 是土壤中最优势菌群。Proteobacteria可以在碳源较丰富的土壤环境中快速增长[26],含有的代谢菌群较多,菌群丰度高低可以表征土壤代谢能力的强弱,Proteobacteria 也是固氮能力较强的菌种之一,能够一定程度上提高土壤中的氮素含量。本研究中,免耕、深翻和深松处理中Actinobactera、Chloroflexi、Acidobacteri、Proteobacteria 菌门的相对丰度较高,表明免耕、深翻和深松处理土壤中有益微生物居多,更利于土壤质量提升。土壤酶活性的变化是由于土壤微生物对动植物残体的分解引起的[28],因此,土壤酶活性与细菌的活动和繁殖有密切联系[27]。本研究发现,Chloroflexi、Planctomycetes、Gemmatimonadetes、Firmicutes 和Rokubacteria 的相对丰度与土壤酶活性和微生物量碳、氮存在显著正相关关系,这些菌门在含碳量充足的环境中表现较多[29]。本研究发现,深翻和深松方式由于改变了土壤质地,改善了土壤通气和营养状况,从而增加了土壤酶活性、微生物量和细菌种类的相对丰度。
4 结论
不同耕作方式对土壤微生物数量、微生物量碳、微生物量氮和土壤酶活性存在显著交互作用,且年际间差异显著,在几种耕作方式中,深翻和深松处理显著提高了土壤微生物量和土壤酶活性,且各耕作方式以Actinobactera、Proteobacteria、Chloroflex、Acidobacteria 等菌门为主,属水平,以Arthrobacter、Gaiella(盖氏菌属)、Blastococcus、Bacillus、RB41、Nocardioides等属为主。深翻和深松处理显著提高土壤过氧化氢酶、蔗糖酶、蛋白酶、纤维素酶活性和细菌数量、微生物量碳、微生物量氮,进而使得Chloroflexi、Firmicutes 和Planctomycetes 等菌门增加,而Nocardioides、Mycobacterium、Ilumatobacter、MND1和Solirubrobacter等在CK 中富集的菌属却对生物学指标的变化表现出不敏感。总之,合理的耕作方式能够通过影响土壤微生物群落组成改善土壤质量。
