基于Dusp9介导的ASK1-JNKp38信号通路探讨当归芍药散对非酒精性脂肪肝模型小鼠的作用机制
2021-08-16施凯舜
施凯舜 徐 峥 陈 岩 黄 洁
(浙江中医药大学附属第二医院老年科,浙江 杭州 310005)
非酒精性脂肪肝(non-alcoholic fatty liver,NAFL)是一种与胰岛素抵抗和遗传易感密切相关的代谢应激性肝病,大约15%的NAFL患者会进展为相关的肝纤维化[1],有效控制NAFL的发生发展对延缓疾病进程至关重要。研究发现,当归芍药散加减治疗NAFL疗效显著,故进一步研究当归芍药散对NAFL的药理机制对于指导临床、优化制剂有较大意义。
双特异性磷酸酶(dual specificity phosphatase-9,Dusp9)是近十年发现的一类酪氨酸特异性的磷酸酶。最新研究发现,Dusp9可通过抑制肝细胞凋亡信号调节激酶1(apoptosis signal-regulating kinase 1,ASK1)活性,调控p38丝裂酶原活化蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)和c-jun氨基末端激酶(JNK)的磷酸化而显著改善非酒精性脂肪性肝炎(NASH)[2]。我们运用转录组芯片分析技术,对高脂高糖饮食诱导的NAFL小鼠进行了肝组织转录组表达谱分析,发现当归芍药散组Dusp9基因mRNA表达量较模型组显著升高,是模型组的数倍。故本研究基于Dusp9介导探讨当归芍药散对NAFL模型小鼠肝脏ASK1-JNKp38信号通路的影响,现报告如下。
1 实验材料
1.1 动物 C57BL/6雄性小鼠,体质量16~20 g,SPF级,购于中国科学院上海实验动物中心。动物生产许可证号:SCXK2018(沪)-0062。动物使用许可证号:SYXK(沪)2018-0167。所有动物均饲养于中国科学院上海实验动物中心SPF级动物房,温度20~26 ℃,相对湿度40%~70%,光照循环条件是12 h明12 h暗。饲料采用实验室等级颗粒料,鼠采食量一般为5~6 g/d,通过水瓶自由饮水,饮水量一般为8~10 mL/d。
1.2 药物与试剂 当归芍药散药液制备:取当归9 g、芍药20 g、茯苓12 g、白术12 g、泽泻20 g、川芎12 g(药材购于上海雷允上药业有限公司),参照授权专利ZL200610009140.0制备工艺制备成浓度分别为1.29、2.58及5.16 g/mL的低、中、高剂量药液,冰箱冷藏备用。ASK1抑制剂Selonsertib,购于美国MCE公司(批号:00057884)。
RNAiso Plus(货号9109),TAKARA公司;Prime Script™ RT Master Mix Perfect Real Time,货号RR036A),TAKARA公司;Power SYBR Green PCR Master Mix(货号4367659),Thermo公司;RIPA裂解液(货号P0013B),碧云天公司;PMSF(货号ST506),碧云天 公 司;Dusp9抗 体(货 号10826-1-AP),Proteintech公司;p-ASK1抗体(货号ab278547),Abcam公司;ASK1抗体(货号28201-1-AP),Proteintech公司;p-JNK抗 体(货 号4168s),CST公 司;p-P38抗 体(货 号ab170099),Abcam公司;1×PBS(货号B548117-0500),生工生物公司;EGFR抗体(货号10826-1-AP),Proteintech公司;Goat anti-rabbit IgG(H+L)-HRP二抗(货号111-035-003),Jackson Immuno Research公司;封闭用羊血清(货号ZLI-9056),北京中杉金桥公司;DAB显色液(货号ZLI-9018),北京中杉金桥公司;苏木精染液(货号BA-4097),珠海贝索生物公司。
1.3 仪器 离心机(型号:5810R),德国Eppendorf公司;荧光定量PCR仪(型号:ViiA7),美国ABI公司;漩涡混合器(型号:QL-901),海门齐林贝尔公司;紫外可见分光光度计(型号:BioPhotometer),德国Eppendorf公司;烘箱(型号:DHG-9140A),上海精宏有限公司;小型高速冷冻离心机(型号:5417R),德国Eppendorf公司;电泳仪(型号:EPS300),上海天能科技公司;化学发光仪(型号:4600),上海天能科技公司;石蜡包埋机(型号:KD-BM),浙江科迪仪器设备;石蜡切片机(型号:FINESSEME),美国Thermo公司;烤片机(型号:ZPJ-1A),天津天利航空机电公司。
2 实验方法
2.1 分组与造模、给药 取雄性C57BL/6小鼠参照文献[3]的方法制作小鼠NAFL模型,予高反式脂肪酸高果糖饲料复合高糖饮水诱导10周(在此期间自由进食与饮水)。高脂饲料每克热量为5.56 kcal,其中58%的能量来源于脂肪;高糖饮水按照42 g/L浓度配制,糖配方为55%果糖∶45%蔗糖。另取10只小鼠作为正常组,饲以对照低脂饲料,自由进食与饮水。对照饲料每克热量为4.07 kcal,其中11%的能量来源于脂肪,饮水为正常饮用水。10周后取造模小鼠检测血清丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST),血清和肝脏甘油三酯(TG),肝脏组织HE染色观察病理变化,血清ALT、AST,血清和肝脏TG浓度明显升高,肝脏组织有不同程度的脂肪变性、炎细胞浸润和肝细胞的气球样变,肝细胞因脂肪变性肿胀呈椭圆形或圆形,大量的脂肪空泡充斥于胞浆内,混合的中性粒细胞及单核细胞浸润可见于肝小叶,提示造模成功。
取造模成功的大鼠50只,按照随机数字表随机分为模型组、ASK1抑制剂组和当归芍药散低、中、高剂量组,每组10只。当归芍药散低、中、高剂量组每日分别灌胃给予1.29、2.58、5.16 g/kg体质量的当归芍药散药液,小鼠用药剂量根据《金匮要略》临床用药剂量按照小鼠体表面积比例换算[4];ASK1抑制剂组每日灌胃给予30 mg/kg体质量的ASK1抑制剂药液,用药剂量参照文献[5];模型组与正常组每日灌胃等量饮用水。各组均每日灌胃1次,连续6周,此期间各组继续给予相应饲料及饮水。
2.2 取材 实验第16周末,各组小鼠禁食12 h后,用2%戊巴比妥钠(3 mL/kg)腹腔注射麻醉,打开腹腔,在同一肝叶和位置切取两小块组织,一块置入10%中性福尔马林缓冲液中固定,另一块用OCT包埋后于液氮内冷冻,-70 ℃低温保存,用于冰冻切片,另定位取肝组织分装于离心管中,于-70 ℃条件下低温保存。
2.3 观察指标
2.3.1 肝组织Dusp9基因表达 采用Real-time PCR检测肝组织Dusp9基因表达。取组织样本,加1 mL RNAiso Plus(Trizol)充分裂解,混匀后室温放置5 min;5000×g离心15 min,吸取上层水相,至另一离心管中;加入1 mL 75%乙醇,温和颠倒离心管,4 ℃,7500×g离心5 min,弃上清;室温晾干10 min,用20 μL DEPC H2O溶解RNA沉淀;检测RNA纯度和浓度后进行mRNA反转录,按照试剂盒说明书,配制mRNA逆转录反应体系20 μL,反应条件为37 ℃、60 min,85 ℃、5 s,反转录产物放在冰上备用;荧光定量PCR扩增,用ABI ViiA7荧光定量PCR仪进行Real time PCR反应。引物信息见表1。
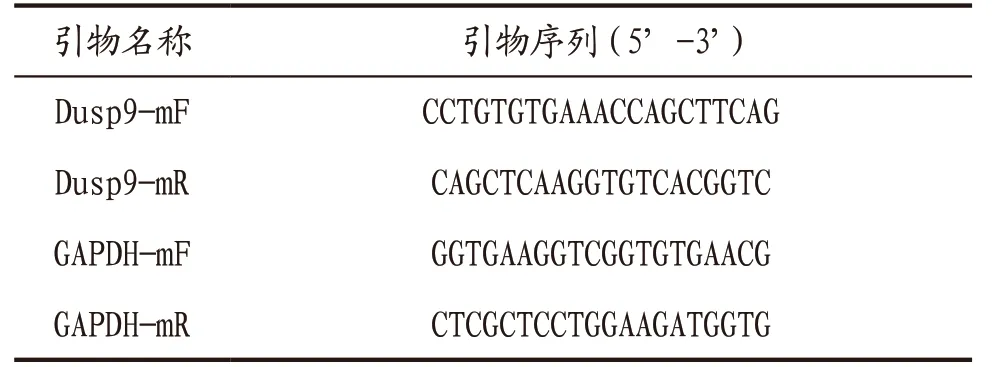
表1 引物信息
2.3.2 肝组织Dusp9、p-ASK1、p-JNK以及p-p38蛋白表达水平 用Western blot检测相关蛋白质的表达水平。取出组织,加入RIPA裂解液使组织充分裂解后离心收集上清,即为提取的总蛋白;测好浓度的蛋白放于-80 ℃保存,将蛋白与loading buffer一起混匀后,放入100 ℃水浴5~6 min;12 000×g离心15 min,放置冰上,待上样;电泳结束后将凝胶中的蛋白质转移至膜上,PBS中浸泡3~5 min,剪膜;用5%脱脂牛奶在37 ℃封闭1~2 h;洗膜3次;按抗体说明书稀释一抗,4 ℃,摇床过夜;加二抗,37 ℃,2 h,摇床;洗膜5次;将蛋白化学发光显影,记录、拍照、扫描和保存。
2.3.3 免疫组化检测肝组织Dusp9蛋白表达 取出经4%多聚甲醛固定后的小鼠肝脏组织,脱水、包埋、切片、烤片;进行抗原修复后PBS洗3次;孵化抗体,一抗,用PBS以1∶100稀释,滴加抗体,4 ℃过夜后室温孵育30 min;辣根酶标记的二抗[Goat anti-Rabbit IgG(H+L)],用PBS以1∶1000稀释,37 ℃孵育30 min;PBST浸洗3次,每次5 min;DAB显色,自来水终止显色,镜检;苏木素复染;经4个浓度乙醇脱水,中性树胶封片。
2.4 统计学方法 采用SPSS 19.0统计软件对数据进行统计处理。计量资料以()表示,采用One-way ANOVA分析,组间多重比较采用LSD(方差齐)或Dunnett(方差不齐)法。P<0.05为差异有统计学意义。
3 实验结果
3.1 各组小鼠肝组织Dusp9基因表达 结果见图1。模型组小鼠肝组织Dusp9基因表达较正常组显著降低(P<0.01),当归芍药散中、高剂量组Dusp9基因表达较正常组显著升高(P<0.01);当归芍药散各剂量组以及ASK1抑制剂组Dusp9基因表达均显著高于模型组(P<0.01);各给药组组间比较见图1,当归芍药散中、高剂量组组间比较差异无统计学意义(P>0.05)。
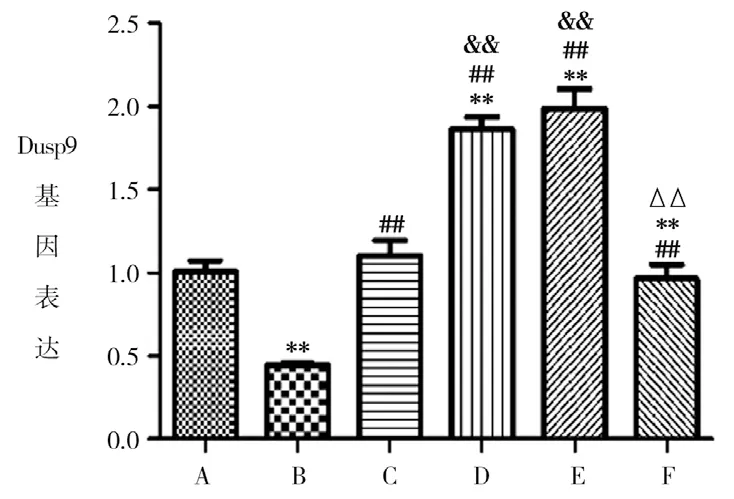
图1 各组小鼠肝组织Dusp9基因表达比较(n=10)
3.2 各组小鼠肝组织Dusp9、p-ASK1、p-JNK及p-p38蛋白表达比较
3.2.1 各组小鼠肝组织Dusp9和p-ASK1蛋白表达比较 结果见图2。模型组和当归芍药散中、高剂量组小鼠肝组织Dusp9蛋白表达与正常组比较有极显著性差异(P<0.01),当归芍药散低剂量组和ASK1抑制剂组Dusp9蛋白表达与正常组比较有显著性差异(P<0.05);当归芍药散各剂量组以及ASK1抑制剂组Dusp9蛋白表达均显著高于模型组(P<0.01),且随着当归芍药散浓度的增加,Dusp9蛋白表达也逐渐增加,有剂量依赖性。

图2 各组小鼠肝组织Dusp9、p-ASK1蛋白表达western blot检测结果比较(n=10)
模型组和当归芍药散各剂量组小鼠肝组织p-ASK1蛋白表达明显高于正常组(P<0.01),ASK1抑制剂组p-ASK1蛋白表达明显低于正常组(P<0.01);各给药组p-ASK1蛋白表达均显著低于模型组(P<0.01);当归芍药散各剂量组组间比较,低剂量组和中剂量组无显著性差异(P>0.05),高剂量组显著低于中、低剂量组(P<0.01)。
3.2.2 各组小鼠肝组织p-JNK及p-p38蛋白表达比较 见图3。模型组和当归芍药散各剂量组小鼠肝组织p-JNK蛋白表达显著高于正常组(P<0.01);当归芍药散各剂量组p-JNK蛋白表达均显著低于模型组(P<0.01),且随剂量升高,p-JNK蛋白表达逐渐降低,组间比较差异有统计学意义(P<0.05,P<0.01);ASK1抑制 剂组p-JNK蛋白表达较其他各组均显著降低(P<0.01)。

图3 各组小鼠肝组织p-JNK及p-p38蛋白表达western blot检测结果比较(n=10)
模型组与当归芍药散各剂量组小鼠肝组织p-p38蛋白表达均显著高于正常组(P<0.01);当归芍药散中、高剂量组p-p38蛋白表达显著低于模型组和低剂量组(P<0.01),中、高剂量组组间比较差异无统计学意义(P>0.05);ASK1抑制剂组p-p38蛋白表达明显低于模型组和当归芍药散各剂量组(P<0.01),但与正常组比较差异无统计学意义(P>0.05)。
3.3 免疫组化检测各组小鼠肝组织Dusp9蛋白表达比较 见图4。模型组小鼠肝组织Dusp9蛋白表达较正常组显著降低(P<0.01),当归芍药散高、中剂量组Dusp9蛋白表达较正常组显著升高(P<0.01);当归芍药散各剂量组Dusp9蛋白表达均明显高 于 模 型 组(P<0.05,P<0.01),中、高剂量组明显高于低剂量组(P<0.01),而中、高剂量组组间比较差异无统计学意义(P>0.05);ASK1抑制剂组Dusp9蛋白表达明显低于当归芍药散中、高剂量组(P<0.01)。

图4 免疫组化检测各组小鼠肝组织Dusp9蛋白表达比较(n=10)
4 讨论
在我国,由于生活水平的提高,生活方式和饮食结构的改变,NAFL发病率快速上升。NAFL具有高患病率、低龄化趋势以及可诱发心血管事件和肝细胞癌等特点,日益显示出其临床预防和治疗的重要性。然而,NAFL的治疗仍缺乏有效的药物,以饮食结构调整为基础的生活方式干预是治疗NAFL的基本措施,但在临床实践中难以被患者广泛接受,且治疗效果也难以得到重复[6]。因此,开发有效的治疗NAFL的药物是我们面临的重要课题。
当归芍药散源于经典名著《金匮要略》,由白芍、当归、白术、茯苓、泽泻、川芎等药物组成。初步临床观察其治疗NAFL有良好的效果,对实验性脂肪肝尤其是脂肪性肝炎治疗的药物效应强度相当理想[7]。该方以祛湿化瘀为法,组方中的6味中药为临床多种疾病常用药,安全可靠。若能阐明其药理作用机制,有望为当归芍药散治疗NAFL提供循证医学证据,并为促进经方现代开发应用奠定基础。
Dusp9也称为丝裂酶原活化蛋白激酶磷酸酶4(MKP-4),是ASK1上游重要的抑制因子。YE P团队[8]最新发表于《Hepatology》的研究表明:高脂饮食诱导NAFL小鼠肝组织中Dusp9蛋白表达显著低于正常小鼠;肝脏特异性Dusp9基因敲除小鼠给予高脂喂养,肝脏甘油三酯含量显著高于未敲除小鼠,且肝脏脂肪变性、胰岛素抵抗和炎性细胞浸润程度较未敲除鼠更加严重;但若过表达肝脏Dusp9基因,这些相关病理表现均显著缓解。进一步机制研究证实,肝细胞Dusp9通过其201-384氨基酸结构域与ASK1蛋白上的1-678氨基酸结构域直接绑定结合,抑制ASK1磷酸化激活,进而降低肝细胞p38和JNK的磷酸化水平,缓解胰岛素抵抗、肝脏脂肪沉积、炎症,改善实验性NAFL[9]。鉴于此,Dusp9有望成为治疗NAFL的重要靶点。
当归芍药散治疗NAFL疗效确切,结合我们前期对NAFL小鼠进行的肝组织转录组表达谱分析,结果显示,当归芍药散组Dusp9基因mRNA表达量较模型组显著升高。本实验发现,造模后模型组小鼠肝组织Dusp9基因表达较正常组显著降低(P<0.01),说明非酒精性脂肪肝小鼠Dusp9基因表达受到抑制。而除ASK1抑制剂组外,经当归芍药散灌胃的模型小鼠出现了Dusp9基因表达较模型组显著升高(P<0.01),且当归芍药散中、高剂量组Dusp9基因表达较正常组也显著性升高(P<0.01),说明即使非酒精性脂肪肝Dusp9基因表达受到抑制,中、高剂量当归芍药散对Dusp9基因表达的影响也能超过正常肝脏Dusp9基因表达。进一步对Dusp9蛋白表达进行Western blot检测,结果显示当归芍药散各剂量组Dusp9蛋白表达均较模型组显著升高,且随着当归芍药散浓度的增加,Dusp9蛋白表达也逐渐增加,表明剂量依赖性。我们还对Dusp9蛋白进行了免疫组化实验,结果也显示和Western blot检测结果相似:当归芍药散各剂量组小鼠肝组织Dusp9蛋白表达均较模型组显著升高。以上说明当归芍药散治疗非酒精性脂肪肝的作用靶点是Dusp9。
ASK1作为MKKK家族成员之一,是调节JNK、p38的重要激酶[10],ASK-1控制的蛋白激酶级联通路也被称为ASK1-JNK/p38通路。在NAFL患者中,此通路是高度激活的,且这种过度激活与胰岛素抵抗、脂肪沉积和炎症呈正相关[11]。ASK1抑制剂被证实可显著改善NAFL模型小鼠相关代谢参数以及肝脂肪变性、炎症和肝纤维化程度[12]。从p-ASK1蛋白水平实验结果来看,模型组和当归芍药散各剂量组p-ASK1蛋白表达较正常组显著升高(P<0.01),证实了非酒精性脂肪肝模型小鼠肝组织ASK1是高度激活的。进一步与模型组比较,当归芍药散各剂量组p-ASK1蛋白表达显著降低(P<0.01),且高剂量组较中、低剂量组下降更为明显(P<0.01),也进一步证实了当归芍药散是通过蛋白激酶级联通路作用于非酒精性脂肪肝。
JNK及p38 MAPK(简称p38)作为MAPK家族中两个重要的成员,参与NAFL“首次打击”和“第二次打击”过程,在肝脏胰岛素抵抗、脂肪沉积、炎症、坏死及纤维化等病理过程中发挥重要作用[13]。本实验结果显示,NAFL模型小鼠JNK蛋白和p38蛋白表达较正常组显著升高(P<0.01),但和模型组相比,经当归芍药散灌胃处理的各组小鼠JNK蛋白和p38蛋白表达均有不同程度降低,且JNK蛋白表达显示出随当归芍药散浓度的增高表达逐渐降低的趋势。研究结果说明当归芍药散的确是通过ASK1-JNKp38信号通路控制NAFL的胰岛素抵抗、炎症及纤维化等病理过程。
综上,本实验验证当归芍药散是通过上调Dusp9抑制ASK1的磷酸化,进而调控NAFL的脂肪代谢、胰岛素抵抗及炎症,揭示该方治疗NAFL的关键药理机制。本课题组拟进一步研究当归芍药散是如何通过信号通路上调Dusp9基因表达,以彻底揭示当归芍药散治疗NAFL的药理机制。
