壳聚糖/木质素磺酸钠吸附剂的制备及其除Pb2+和Cd2+
2021-08-13郝冬亮王琪琳毛欣宇梁雅丽邵孝候
郝冬亮,王琪琳,毛欣宇,梁雅丽,邵孝候
(1 河北环境工程学院,河北 秦皇岛 066102;2 河海大学 农业科学与工程学院,南京 210098;3 山西省生物研究院有限公司,太原030006)
水是人类生存的基本必需品之一,地球上的生物都离不开水资源。然而,由于工业和生活用水处理的不当,造成了大量的水污染。重金属污染是一种非常严重的污染,由于其难降解、有毒性等特点,使其难以控制[1-3]。重金属离子随水流进入土壤,抑制植物的生长发育,甚至带来死亡的危险。如何有效去除重金属离子,净化环境,是国内外众多学者研究的一个热点。目前,氧化还原法、沉淀法、生物量法、透析法、离子交换法等对重金属离子的处理效果都很好,但也存在诸多制约因素:成本高、处理周期长、二次污染物量大等[4-8]。而吸附法操作简易、绿色、高效,被认为是目前最有潜力的技术之一[9]。
吸附性能的优良取决于吸附材料。吸附材料主要分为无机材料、有机材料和复合材料。无机材料具有耐高压、耐酸碱等优点,但其吸附容量相对较小、再生能力较弱。其中代表有活性炭、金属氧化物和矿物质等[10-11]。复合材料是多种材料通过物理或化学方法结合形成的一类材料[12-14],因具有吸附效率高、性能稳定而成为吸附材料研究和发展的趋势。有机材料大多以多孔、高吸附容量和重复利用性高等特点被广泛应用于处理重金属离子,但也极受其他因素影响,如溶解度、温度、pH值等。其中代表有树脂、壳聚糖、多糖类等[15-16]。近年来,天然有机材料成为学者研究的一个热点,如纤维素、多糖、蛋白质、天然橡胶等。这些材料来源广泛、生物相容性好、吸附能力强,被广泛应用于合成复合吸附剂[17-19]。水凝胶是一种有机材料,它与水高度亲和,具有良好的吸水能力,被广泛应用于农业灌溉、医疗美容、个人护理等方面。近年来,国内外专家热衷于将其与其他材料结合形成复合材料,其表面多孔、多褶皱,为吸附提供了更大的表面积。水凝胶复合天然有机化合物在许多方面改善了原材料的性能,其中最明显的效果是吸附性能。多官能团复合材料增加了与重金属的结合概率,增强了对重金属的吸附能力。木质素是继纤维素之后的第二大可再生能源,木质素每年有几十亿吨的产量,但利用率低。木质素磺酸盐是木质素的主要衍生物之一,是由工业造纸产生的副产物,与木质素一样利用率极低,造成大量的浪费。木质素磺酸钠比木质素溶解度高,引入磺酸基后其化学活性增加,将其应用于合成复合吸附剂后,扩展了木质素的应用,也降低了吸附剂的成本。壳聚糖是甲壳素的衍生物,具备良好的生物相容性,还有降脂、抑菌、无毒等功能,使其大量应用于农业、医用器材、化妆品、纺织、药物以及一些化工产业。同时壳聚糖也具有良好的吸附性能,这归功于醇羟基和氨基等基团,将壳聚糖改性,能够提高壳聚糖的吸附性能。
本工作以木质素磺酸钠和壳聚糖为原料合成木质素基水凝胶,采用正交实验设计法优化各反应物的用量,以得到性能最佳的吸附剂,并将其应用于去除Pb2+和Cd2+。木质素基水凝胶的合成方案简单,合成的原料来源广泛、成本低,能够为今后重金属离子的处理提供一种新思路。
1 实验材料与方法
1.1 实验试剂
丙烯酸(C3H4O2)、壳聚糖((C6H11NO4)n)、木质素磺酸钠(C20H24Na2O10S2)、过硫酸钾(K2S2O8)、N′N-亚甲基双丙烯酰胺(NMBA)、氢氧化钾(KOH)、乙醇(CH3CH2OH)、四水硝酸镉(Cd(NO3)24H2O)、硝酸铅(Pb(NO3)2)均为分析纯,购自国药集团化学试剂有限公司。
1.2 材料制备
1.2.1 木质素基水凝胶吸附剂的制备
称取2.744 g KOH溶解在5 mL去离子水中,将KOH溶液置于冰水浴中,在连续搅拌的同时加入5 mL丙烯酸。然后向50 mL烧杯中先后加入木质素磺酸钠、壳聚糖、过硫酸钾和N′N-亚甲基双丙烯酰胺,用10 mL水搅拌溶解。最后加入先前的KOH溶液并搅拌。将混合液放入超声波仪器中,70 ℃下反应1 h取出,加入无水乙醇浸泡过夜,真空干燥得到木质素基水凝胶样品。
实验中的木质素磺酸钠(LS),壳聚糖(CS),过硫酸钾以及N′N-亚甲基双丙烯酰胺在合成过程中的用量都影响样品的吸附性能,故需要讨论不同用量的合成方案以确定各物质的最佳用量。传统实验采用全因素实验方案来逐一讨论合成方案,再筛选出各物质的最佳用量,但这种方法实验次数多,耗费人力、物力和时间,当所考察的实验因素和水平较多时,研究者很难承受。正交实验设计是研究多因素、多水平的一种设计方法,它是根据正交性从全面实验中挑选出部分有代表性的点进行实验,这些有代表性的点具备“均匀分散、齐整可比”的特点。正交实验设计是分式析因设计的主要方法,同时也是一种高效率、快速、经济的实验设计方法。本实验采用正交法,设计基准由初始预实验得到:木质素磺酸钠(0.1~0.3 g),壳聚糖(0.1~0.3 g),过硫酸钾(0.07~0.11 g),N′N-亚甲基双丙烯酰胺(0.0085~0.0145 g)。采用正交设计助手Ⅱ(v 3.1)来设计实验方案,详细的正交设计方案如表1所示。
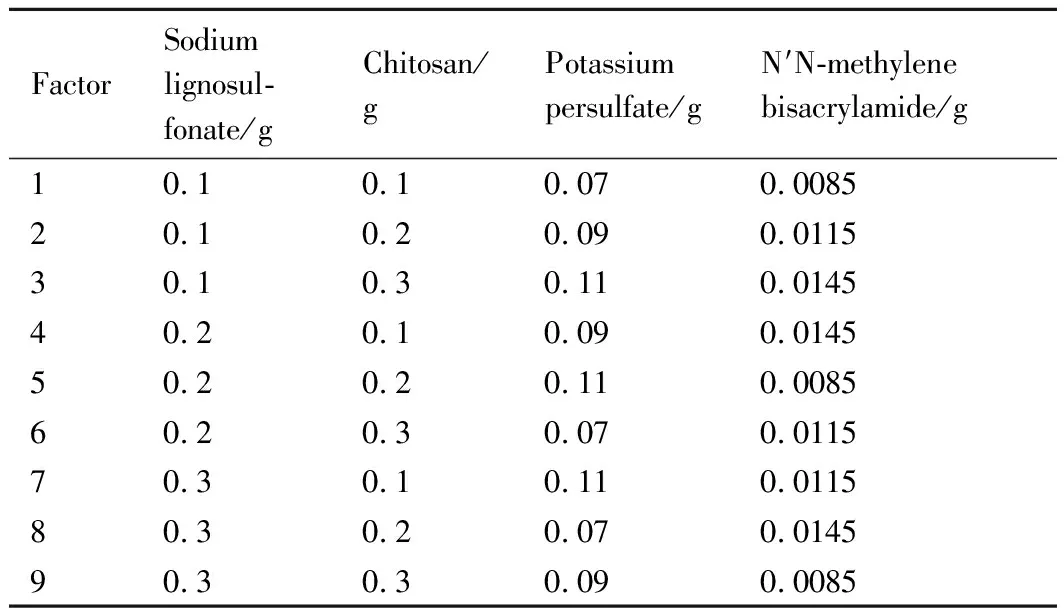
表1 正交实验设计方案Table 1 Orthogonal experimental design scheme
1.2.2 吸附剂的表征
采用JSM-7800F型场发射扫描电镜(FE-SEM)分析材料表面形貌;采用Nicolet Nexus 470光谱仪对材料的官能团进行表征;采用Nano ZS90电位分析仪测定样品的Zeta电位;采用STA 449C集成热分析仪对样品的热性质进行表征。
1.2.3 吸附剂吸附Pb2+和Cd2+
所有吸附实验均在50 mL盐溶液中进行。采用0.1 mol·L-1HCl和0.1 mol·L-1NaOH溶液调节溶液的pH值。在动力学实验中,使用100 mg·L-1重金属离子溶液,加入0.01 g木质素基水凝胶吸附剂进行吸附,直到吸附平衡(pH=7,温度20 ℃)。采用初始浓度为100~900 mg·L-1的M2+(M=Pb或Cd)加入0.01 g的木质素基水凝胶吸附剂,直到吸附平衡(pH=7,温度20 ℃),研究吸附等温线模型。探讨pH值和木质素基水凝胶用量对吸附性能的影响时,采用初始浓度为100 mg·L-1M2+溶液,加入0.01 g木质素基水凝胶吸附剂,至吸附平衡(pH=1~7,吸附剂用量0.01~0.07 g,温度20 ℃)。用TAS-986型原子吸收分光光度计测定残余M2+浓度。吸附容量为:
(1)
式中:Qe为平衡吸附容量,mg·g-1;Ce为平衡时浓度,mg·L-1;C0为初始浓度,mg·L-1;V为体系的体积,L;m为吸附剂的质量,g。
2 结果与讨论
2.1 正交实验结果
通过表1正交实验设计的实验进行合成实验,并将各组样品进行Pb2+吸附能力测试,将吸附结果输入正交设计助手中,输出的正交实验结果如表2所示。
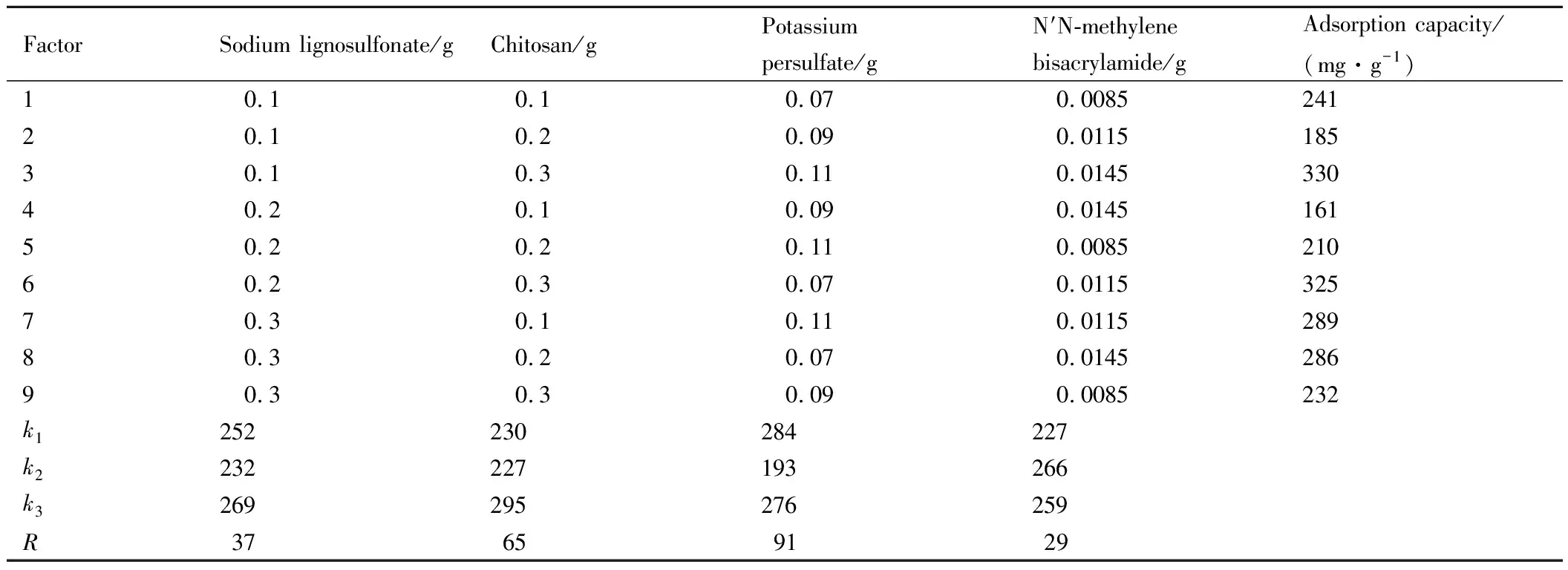
表2 正交实验结果Table 2 Results of orthogonal experiment
表2中ki为任意列上水平号为i时所对应的实验结果之和,R为极差(用最大的k值减去最小的k值)。实验结果发现,各因素对吸附的影响排序为:过硫酸钾>壳聚糖>木质素磺酸钠>N′N-亚甲基双丙烯酰胺。各因素的最佳水平:木质素磺酸钠0.3 g,壳聚糖0.3 g,过硫酸钾0.07 g,N′N-亚甲基双丙烯酰胺0.0115 g。将上述各组分的最佳水平加入实验中,合成样品,获得吸附容量最大的木质素基水凝胶。通过测量计算得到木质素基水凝胶吸附剂对Pb2+的吸附容量是367 mg·g-1。
2.2 木质素基水凝胶吸附剂的表征
图1是木质素基水凝胶和吸附了Pb2+后吸附剂的扫描电镜图和Mapping图。从图1(a)中可以看出,木质素基水凝胶表面分布大量微孔,且大小不一,孔径在1~3 μm之间。这种孔结构可能是烘干过程中水分的损失,在表面形成的出气孔(光亮的白色物质是碎小的木质素基水凝胶,由于喷金时间过长导致在电子显微镜下较亮)。图1(b)表明,在吸附Pb2+后表面的孔消失,取而代之的是层状结构,这是Pb2+被吸附到表面后形成的。由图1(c)可以看出,元素C,N,O,Na,K,S均匀分布,证明木质素基水凝胶成功合成。同时Pb也在Mapping图中出现,揭示木质素基水凝胶有效吸附了Pb。

图1 木质素基水凝胶(a)和吸附Pb2+后吸附剂(b)的扫描电镜图以及吸附Pb2+后吸附剂的Mapping图(c)Fig.1 SEM images of lignin-based hydrogel(a),adsorbent after Pb2+ adsorption(b) and Mappings of adsorbent after Pb2+ adsorption(c)

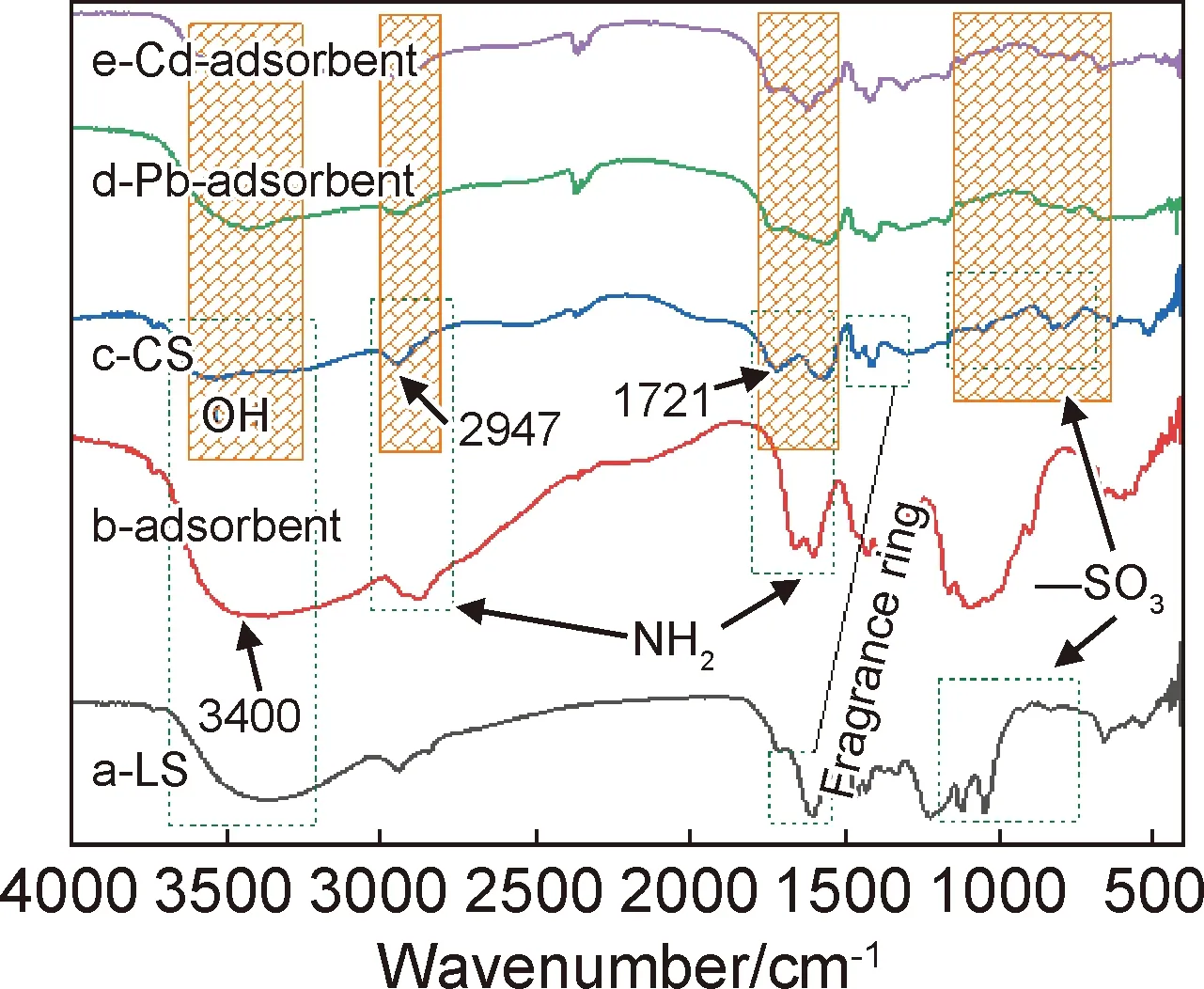
图2 木质素磺酸钠、木质素基水凝胶、壳聚糖、吸附Pb2+及Cd2+后木质素基水凝胶的红外光谱图Fig.2 Infrared spectra of sodium lignosulfonate,lignin-based hydrogel,chitosan,adsorbent after adsorption of Pb2+ and Cd2+
图2中有四处吸收峰存在明显的变化,分别对应的是羟基、氨基与磺酸基基团。吸附重金属离子后木质素基水凝胶红外吸收峰发生强度变化或位置变化,如—OH从3540 cm-1偏移到3441 cm-1。一些相近的吸收峰产生Fermi共振效应发生简并,例如—NH2特征吸收峰与芳香环吸收振动峰在1600 cm-1位置发生简并。这些吸收峰发生的偏移与简并等现象,是由于吸附过程中重金属离子Pb2+或Cd2+与这些官能团发生结合,使电子云密度发生变化,引起键的振动谱带位移。
图3是壳聚糖,木质素磺酸钠和木质素基水凝胶的热重曲线。由图3(a)可知,温度达到100 ℃时,壳聚糖会失去5%的水分;达到210 ℃后失重率达到最大,外部的小分子发生低温分解;随之发生高温热分解直至500 ℃,最终质量为原有质量的5%。由图3(b)可知,木质素磺酸钠在100 ℃左右失水,导致第一个峰的出现;在266 ℃时失重率达到最大,即表面小分子发生低温分解;而在800 ℃之后木质素磺酸钠仍有质量的损失,即内部分子高温分解,最终质量为原有质量的34%。图3(c)中木质素基水凝胶失水阶段和低温分解阶段没有明显的分界线,这是由于木质素磺酸钠的前两个阶段和壳聚糖的前两个阶段发生交错,导致两个阶段合并成一个大的阶段。500 ℃后木质素基水凝胶仍有质量损失的现象,是由于加入木质素磺酸钠后,只有在更高的温度内部分子才会发生热分解,证明木质素磺酸钠和壳聚糖成功结合,且木质素基水凝胶具有较高的热稳定性。
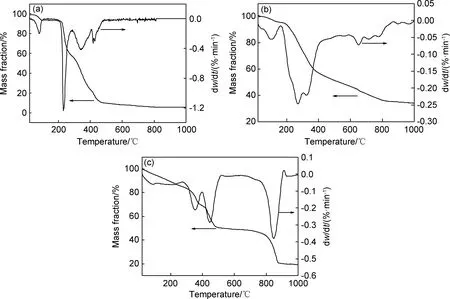
图3 壳聚糖(a),木质素磺酸钠(b)和木质素基水凝胶(c)的热重曲线Fig.3 Thermogravimetric curves of chitosan(a),sodium lignosulfonate(b) and lignin-based hydrogel(c)
2.3 木质素基水凝胶的吸附性能
图4为吸附剂的投放量和pH值对吸附性能的影响。由图4(a)可知,随着吸附剂投放量的增多,木质素基水凝胶对金属离子的吸附容量下降,当投放量为0.015 g时,吸附容量达到最大值(对Pb2+的吸附容量为367 mg·g-1,对Cd2+的吸附容量为296 mg·g-1)。当投放量为0.01~0.015 g时,金属离子浓度一定,吸附剂加入量增大,吸附位点不断增多,致使吸附容量增加。当投放量超过0.015 g 时,空余的吸附位点越来越多,吸附剂的平均吸附容量下降,致使曲线呈现下降趋势。
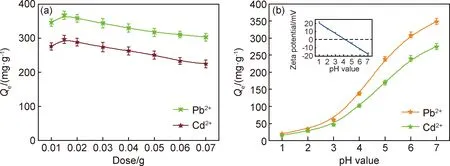
图4 吸附剂的投放量(a)和pH值(b)对吸附性能的影响(插图为不同pH值下木质素基水凝胶的Zeta电位)Fig.4 Effect of the dose of adsorbent(a) and pH value(b) on the adsorption performance(inset:lignin-based hydrogel Zeta potential under different pH values)
图4(b)是pH值对吸附性能的影响,插图为不同pH值下木质素基水凝胶Zeta电位。根据插图中的数据拟合得到电位零点的pH值为4.1。当pH值大于4时,木质素基水凝胶的表面呈现负电性,会吸引重金属离子,pH值越大,负电性越强,导致吸附容量增加。当pH值小于4时,木质素基水凝胶的表面呈现正电性,正电性会与重金属离子发生排斥,pH值越小,排斥越大,致使吸附容量减小。
图5是木质素基水凝胶对Pb2+和Cd2+的吸附容量随时间的变化,以及木质素基水凝胶吸附Pb2+和Cd2+颗粒内扩散动力学模型,插图为木质素基水凝胶吸附Pb2+和Cd2+拟二级动力学模型。由图5(a)可以看出,吸附速率并不是恒定值,而是先增加后减小,在150 min后达到最大值。吸附初期存在大量吸附位点,重金属离子快速与吸附剂结合,当占据大部分吸附位点后,吸附速率逐渐变小,木质素基水凝胶对Pb2+和Cd2+的吸附容量分别为367 mg·g-1和296 mg·g-1。吸附速率大小与吸附质和吸附剂结合密切相关。为了探究吸附剂与吸附质之间的关系,采用三种动力学模型来研究。
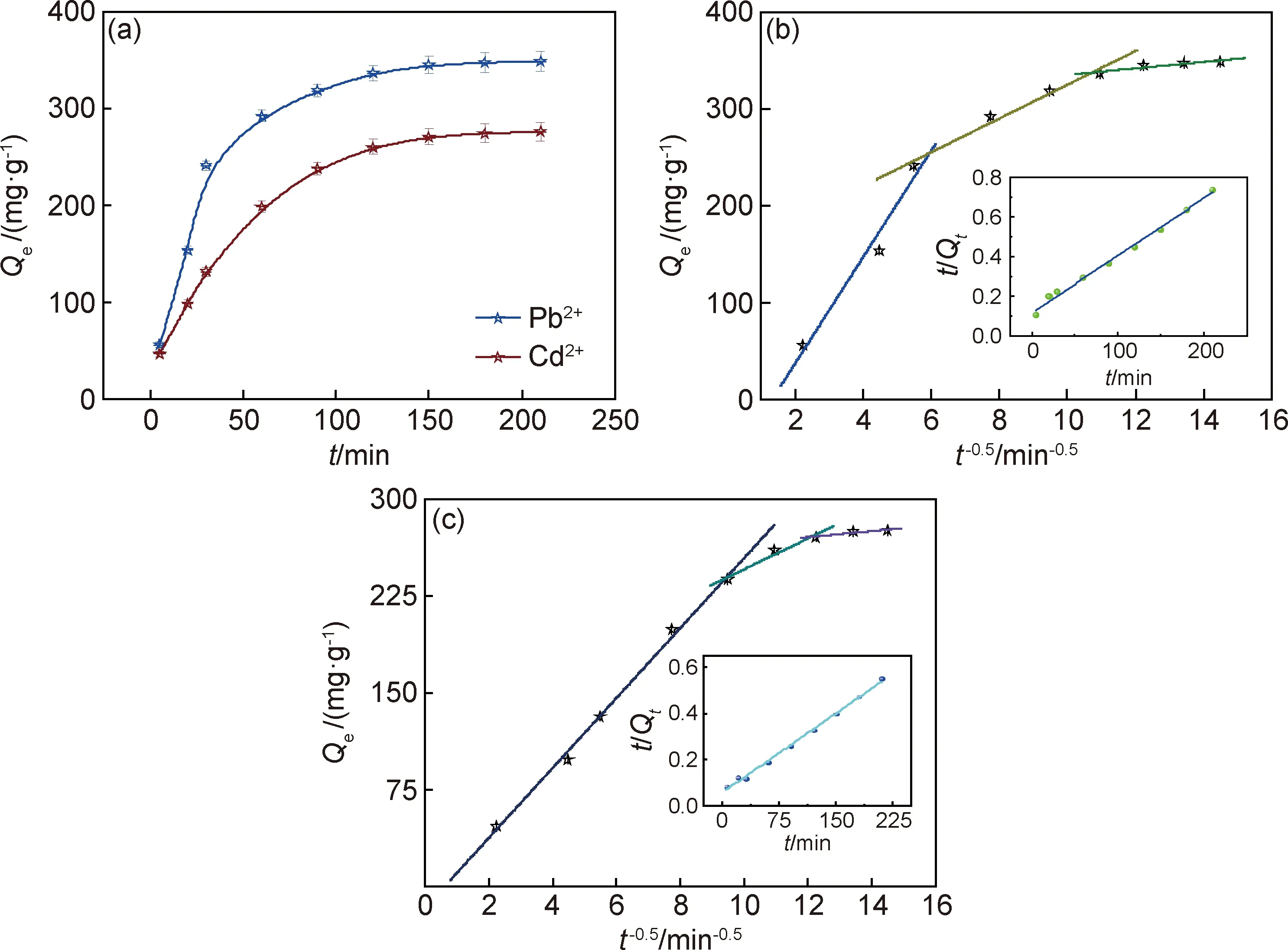
图5 木质素基水凝胶对Pb2+,Cd2+吸附容量随时间的变化(a),木质素基水凝胶吸附Pb2+(b)和Cd2+(c)颗粒内扩散动力学模型(插图为木质素基水凝胶吸附Pb2+,Cd2+拟二级动力学模型)Fig.5 Adsorption capacity of lignin-based hydrogel to Pb2+ and Cd2+ changes over time(a), adsorption kinetics in particles of Pb2+(b) and Cd2+ (c) (insets:pseudo second order kinetic models for adsorption of Pb2+ and Cd2+ by lignin-based hydrogel)
拟一级动力学:
ln(Qe-Qt)=lnQe-k1t
(2)
拟二级动力学:
(3)
颗粒内扩散:
Qt=kpt0.5+C
(4)
式中:Qt是t时刻吸附剂的吸附容量,mg·g-1;t是吸附时间,min;k1是拟一级动力学的速率常数,min-1;k2是拟二级动力学的速率常数,g·mg-1·min-1;kp是颗粒内扩散动力学的速率常数,mg·g-1·min-0.5;C是颗粒内扩散动力学相关的常数。
图5(b),(c)表明,吸附过程主要呈现三个阶段:第一阶段,金属离子从溶液中以对流扩散的形式传递到木质素基水凝胶的外表面;第二阶段,金属离子从木质素基水凝胶的外表面进入木质素基水凝胶的微孔内,然后扩散到木质素基水凝胶的内表面;第三阶段,金属离子在木质素基水凝胶表面上被吸附位点所吸附。木质素基水凝胶吸附重金属离子的数据通过动力学模型拟合,各参数列于表3中。对比拟一级和拟二级动力学发现,拟二级动力学的理论吸附容量更接近实验数据,且相关系数R2更加接近1,说明拟二级动力学所描述的过程更接近实际吸附。颗粒内扩散结果表明实际的吸附速率是受多个过程控制[19-22]。
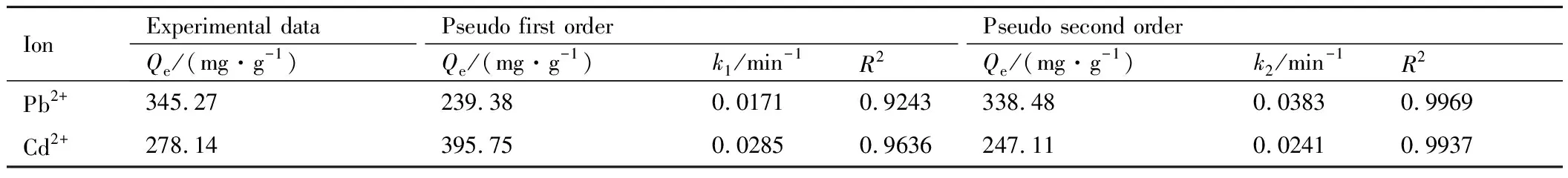
表3 动力学拟合参数Table 3 Kinetic fitting parameters
图6是初始浓度对吸附性能的影响以及Langmuir等温线模型。图6(a)表明,随着初始浓度增加吸附容量也随之增大,但会趋于一个极值。吸附是一个类似平衡的过程,初始浓度增加会使吸附平衡向吸附容量增加的方向移动。吸附剂上的吸附位点是定值,存在吸附容量极值,等温线图中最大值无限趋近于极值。为了探究木质素基水凝胶吸附Pb2+和Cd2+的机理,采用Langmuir和Freundlich等温线模型来研究吸附过程。
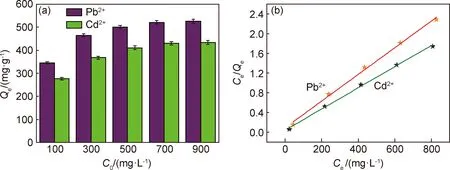
图6 初始浓度对吸附性能的影响(a)以及Langmuir等温线模型(b)Fig.6 Effect of initial concentration on the adsorption performance(a) and Langmuir isotherm model(b)
Langmuir等温线:
(5)
Freundlich等温线:
(6)
式中:Qm,L是Langmuir理论最大吸附容量,mg·g-1;KL是Langmuir相关系数常数,L·mg-1;KF是Freundlich相关系数常数,L·g-1;n为Freundlich常数,代表表面非均匀程度吸附位点能量分布。如果n>1,吸附过程容易发生,n<1/2,吸附过程不易发生。
吸附数据采用Langmuir和Freundlich等温线线性拟合,各参数列于表4中。通过对比Langmuir和Freundlich等温线的拟合参数,发现Langmuir等温线的理论吸附容量更接近实际吸附容量,拟合的数据点集中,且Langmuir等温线的相关系数R2更接近1,故吸附过程更符合Langmuir模型。Langmuir等温线模型假设吸附剂表面是均匀的,因而吸附热与覆盖度无关;吸附质分子间无相互作用,以及吸附是单分子层的[23]。推测木质素基水凝胶吸附重金属离子的吸附过程类似单分子层的化学吸附。

表4 等温线模型拟合参数Table 4 Fitting parameters of isotherm model
2.4 吸附机理分析
红外光谱图发现木质素基水凝胶吸附重金属离子与羟基、氨基和磺酸基有关,扫描电镜图结果得知重金属离子在吸附剂表面形成了层状结构,Zeta电位结果表明吸附剂表面带有负电荷,再结合动力学和等温线模型的结果,获得如图7所示的吸附机理假设。木质素基水凝胶加入金属离子溶液中,吸附剂通过静电吸引将金属离子吸附到表面,通过扩散作用与吸附位点结合,金属离子与相应的官能团发生结合作用。推测木质素基水凝胶对Pb2+和Cd2+的吸附过程是以化学吸附为主、静电吸附为辅。
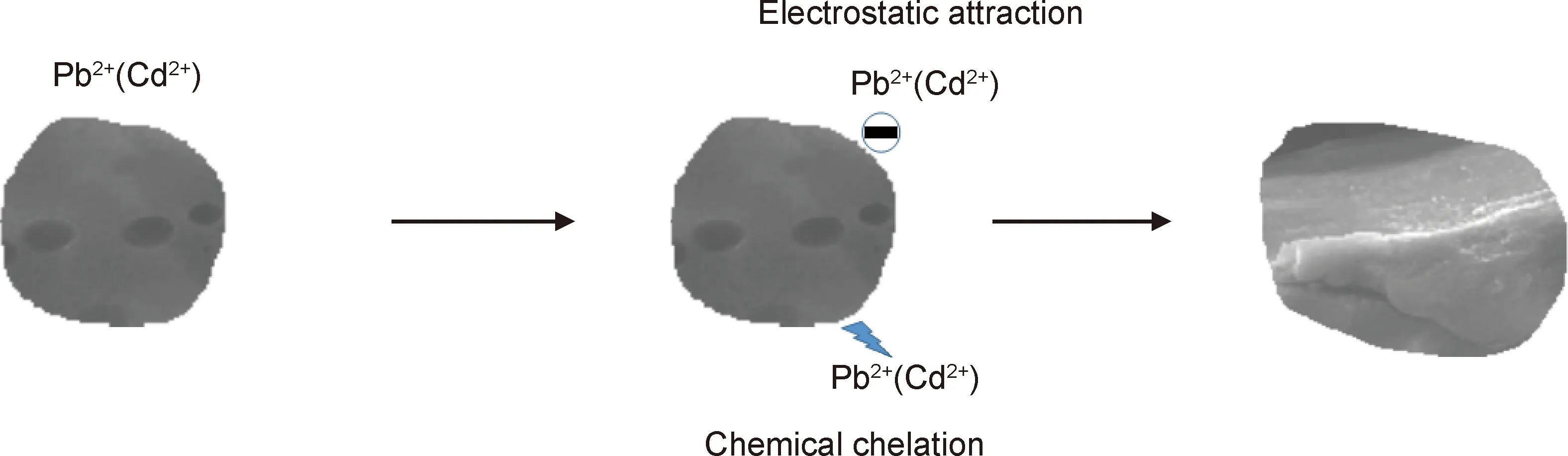
图7 木质素基水凝胶对Pb2+,Cd2+吸附的吸附机理Fig.7 Adsorption mechanism of Pb2+ and Cd2+ on lignin-based hydrogel adsorbent
3 结论
(1)采用自由基聚合法合成了木质素基水凝胶。
(2)0.015 g木质素基水凝胶在pH为7、重金属离子浓度为100 mg·L-1时,150 min后对Pb2+的吸附容量为367 mg·g-1,对Cd2+的吸附容量为296 mg·g-1,且吸附容量对重金属离子初始浓度有依赖性。
(3)木质素基水凝胶吸附Pb2+,Cd2+的过程符合拟二级动力学和Langmuir等温线模型,推测吸附过程是一种以化学吸附为主、静电吸附为辅的吸附过程。
