亚低温培养对猪肝细胞形态与功能的影响
2021-08-13张世昌顾春荣刘京萍
黄 蕾,张世昌,2,顾春荣,刘京萍,陈 黎
1.南京医科大学第一附属医院检验学部,江苏 南京 210029; 2.第三军医大学西南医院传染科;3.南京医科大学第一附属医院产科
随着生物人工肝的快速发展,肝细胞需求量的增加,同时生物人工肝治疗肝功能衰竭需要迅速提供大量高活性的肝细胞,有效地保存和运输肝细胞是其解决方法之一[1]。当前常用超低温冻存和4 ℃保存肝细胞的方法,在复温后肝细胞活力和功能均有较大程度的降低,复温时需要繁琐的步骤和严格的实验条件,也不方便肝细胞的长距离运输[2-4]。故亟需为生物人工肝细胞材料——肝细胞的保存和运输探索一种更方便有效的方法,以进一步促进生物人工肝的临床应用。
肝细胞的保存和运输是生物人工肝临床应用的重要条件之一,也是解决肝细胞材料短缺的有效方法之一。传统的细胞保存方法主要采用超低温-80 ℃、-196 ℃长期保存或在0~4 ℃短期保存[5-8]。在超低温长期冻存肝细胞的降温和复温过程中,通过-5~0 ℃时细胞内水分结冰导致冰晶损伤。温度下降时,细胞外的水分先结冰,未结冰溶液的电解质浓度升高,使细胞膜受损并发生渗漏,复温时即可因大量水分渗入而死亡[9]。虽然加入冻存保护剂和加快复温速率可部分减少这些损伤,但复温后的肝细胞活力和功能仍有较大程度的降低,而且在复温时要求复杂的实验步骤和严格的实验条件[10-11]。0~4 ℃短期保存的肝细胞复温后,肝细胞功能和细胞膜亦受到损伤,并诱导细胞凋亡[12]。以上方法不能完全满足生物人工肝和肝组织工程所需大量、高密度、高活性肝细胞的要求,需要为生物人工肝和肝组织工程细胞材料探索一种更方便有效的肝细胞保存和运输方法。有学者将新分离的肝细胞在37 ℃培养3 h后转入32 ℃培养12 h,结果显示,32 ℃培养不像4 ℃诱导肝细胞凋亡,而能有效地抑制Fas介导的细胞凋亡[13],但未评价肝细胞功能。如果以接近室温的亚低温(25~37 ℃[14-15])培养肝细胞能够维持其功能,亚低温培养肝细胞就有可能成为保存和运输肝细胞一种有效的方法。因此,本研究观察了亚低温培养对乳猪肝细胞形态功能的影响,探索亚低温培养肝细胞的可行性,为亚低温保存和运输肝细胞提供实验依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:中国实验小型猪购自第三军医大学实验动物中心,均为新生1~7 d的乳猪,无病原体感染,雌雄不限,实验前4 h断乳,清洁皮毛后备用。
1.1.2 主要试剂:实验所用试剂如表1所示。
表1 研究中使用的试剂
1.2 方法
1.2.1 猪肝细胞的分离和培养:腹腔注射戊巴比妥钠(30 mg/kg)麻醉新生实验小乳猪,按照我们已发表文章方法消化分离猪肝细胞[16]。台盼蓝拒染试验判断细胞存活率>90%可用于实验。
1.2.2 肝细胞培养分组方案:(1)对照组:乳猪肝细胞培养于含质量浓度为100 g/L新生小牛血清的无酚红RPMI-1640培养液中,细胞接种密度为2×105ml-1,培养温度始终为37 ℃,体积分数为5%的CO2,饱和湿度。(2)亚低温实验组:肝细胞37 ℃培养4 h,细胞贴壁后,按下列方案分组培养。① 25 ℃组:25 ℃培养24 h后,转入37 ℃培养24 h以上。② 28 ℃组:28 ℃培养24 h后,转入37 ℃培养24 h以上。③ 33 ℃组:33 ℃培养24 h后,转入37 ℃培养24 h以上。
1.2.3 亚低温对乳猪肝细胞活力的影响:将新分离的乳猪肝细胞接种于6孔培养板,按分组方案培养。各组肝细胞每24 h取3孔细胞用MTT法检测细胞活力。首先用PBS洗3遍,加200 μl MTT液,后置于37 ℃、体积分数为5%的CO2、饱和湿度条件下培养4 h,吸弃MTT液,加2 ml DMSO,轻摇10 min,吸200 μl加入96孔板,取空白DMSO作零,用酶标仪在490 nm波长测吸光度(OD)值。细胞相对活力(%)=(实验组OD值-空白OD值)/(对照组OD值-空白OD值)×100%。
1.2.4 亚低温对乳猪肝细胞乳酸脱氢酶(LDH)和天冬氨酸转氨酶(AST)漏出量的影响:将新分离的乳猪肝细胞接种于6孔培养板,按分组方案培养。每24 h每组收集培养液上清,3 000 r/min离心5 min,在自动生化分析仪上检测LDH和AST的含量。
1.2.5 亚低温对乳猪肝细胞尿素合成的影响:将新分离的乳猪肝细胞接种于6孔培养板,按分组方案培养。每24 h各组取3孔细胞,PBS洗3遍,加无血清RPMI-1640培养液培养24 h,收集培养液上清。在收集培养液上清的同时收集含质量浓度为100 g/L的新生小牛血清的培养液作为本底,用脲酶-波氏比色法分别检测培养液上清和本底中尿素的含量,上清中尿素含量减去本底中尿素含量即为每天乳猪肝细胞的尿素合成量。肝细胞尿素合成率(%)=实验组肝细胞每天尿素合成量/对照组肝细胞每天尿素合成量×100%。
1.2.6 亚低温对乳猪肝细胞白蛋白合成的影响:将新分离的乳猪肝细胞接种于6孔培养板,按分组方案培养。每天收集各组培养液上清。用特异性猪白蛋白抗体ELISA法检测乳猪肝细胞培养上清中的猪白蛋白含量。肝细胞白蛋白合成率(%)=实验组肝细胞每天白蛋白合成量/对照组肝细胞每天白蛋白合成量×100%。
1.2.7 亚低温对乳猪肝细胞氨清除率的影响:将新分离的乳猪肝细胞接种于6孔培养板,按分组方案培养。每24 h取3孔细胞,PBS洗3遍,加入含5 mmol/L氯化铵无血清RPMI-1640培养液培养4 h,收集培养液上清。用谷氨酸脱氢酶-紫外法检测上清中氨的浓度。肝细胞氨清除率(%)=实验组肝细胞每天氨清除量/对照组肝细胞每天氨清除量×100%。
1.2.8 亚低温对复温后乳猪肝细胞形态的影响:做上述各项实验时,同时采用倒置相差显微镜对实验组和对照组乳猪肝细胞形态进行动态观察,细胞培养时间最长7 d,同时照相记录。

2 结果
2.1 亚低温对乳猪肝细胞形态的影响倒置相差显微镜观察乳猪肝细胞形态,结果显示,置于亚低温培养前即接种培养4 h后,乳猪肝细胞大部分已经贴壁,细胞多呈圆形,细胞核明显并见少量双核细胞;在亚低温培养24 h后,28 ℃组肝细胞未完全伸展开,较亚低温培养前细胞增殖不明显,可见双核细胞;25 ℃组肝细胞与28 ℃组基本相似,但见少许漂浮细胞,胞膜周围可见少量棘状突起,33 ℃组肝细胞较亚低温培养前进一步伸展开,但未完全展开,可见细胞增殖。在恢复37 ℃培养24 h后,各组肝细胞完全展开,体积明显增大,可见许多双核细胞,细胞数量增殖明显,尽显典型的、较均匀一致的多角形,肝细胞与肝细胞之间的边界清晰、明亮(见图1)。
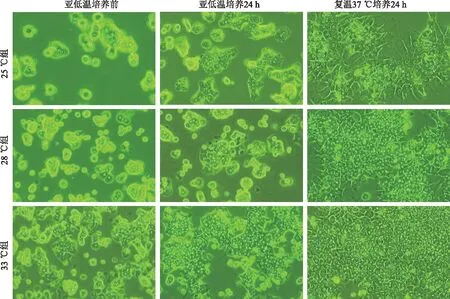
图1 亚低温培养对肝细胞形态的影响(放大200倍)
2.2 亚低温对乳猪肝细胞活力的影响在亚低温培养24 h后,各组肝细胞活力均有不同程度的降低。其中25 ℃组肝细胞只有对照组的58.8%,差异有显著统计学意义(P<0.01);28 ℃组和33 ℃组与对照组相比,差异无统计学意义(P>0.05)。复温24 h后,各组肝细胞活力较复温前显著升高(P<0.05),与对照组相比,25 ℃组肝细胞活力仍显著低于对照组(P<0.01),28 ℃组和33 ℃组肝细胞活力显著高于对照组(P<0.05),28 ℃组和33 ℃组均显著高于25 ℃组(P<0.01),28 ℃组与33 ℃组之间差异无统计学意义(P>0.05)(见图2)。
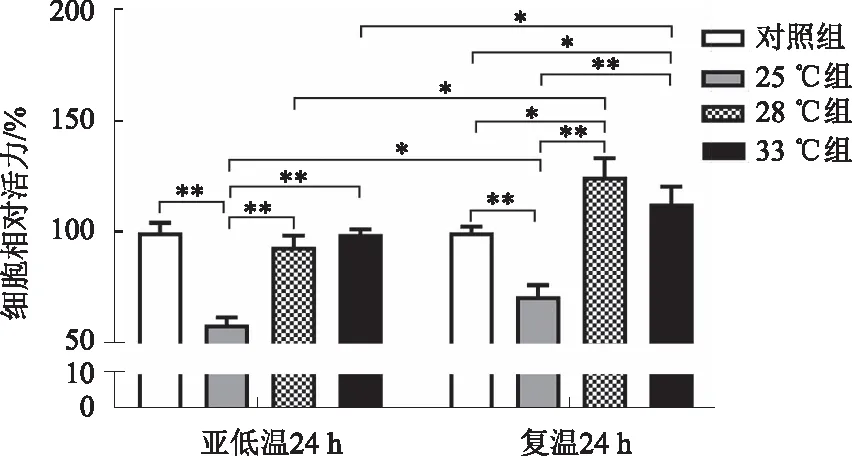
注:*P<0.05,**P<0.01。
2.3 亚低温对乳猪肝细胞LDH和AST漏出量的影响亚低温培养24 h过程中,各组肝细胞LDH和AST漏出量与对照组相比,差异无统计学意义(P>0.05),各组之间差异也无统计学意义(P>0.05);在复温培养24 h过程中,各组肝细胞LDH和AST漏出量较对照组和复温前差异均无统计学意义(P>0.05)(见表2)。
表2 复温前后肝细胞LDH和AST漏出量的变化
2.4 亚低温对肝细胞尿素合成的影响亚低温培养过程中,各组肝细胞尿素合成率均有所降低,与对照组相比,25 ℃组差异有显著统计学意义(P<0.01),28 ℃组和33 ℃组差异无统计学意义(P>0.05)。恢复37 ℃培养24 h,28 ℃组和33 ℃组肝细胞尿素合成率较亚低温培养时显著升高(P<0.01),25 ℃组与对照组比较,差异无统计学意义(P>0.05),28 ℃组和33 ℃组与对照组相比显著升高(P<0.05)。复温后组间比较,28 ℃组和33 ℃组均高于25 ℃组(P<0.05),两组之间差异无统计学意义(P>0.05)(见图3)。
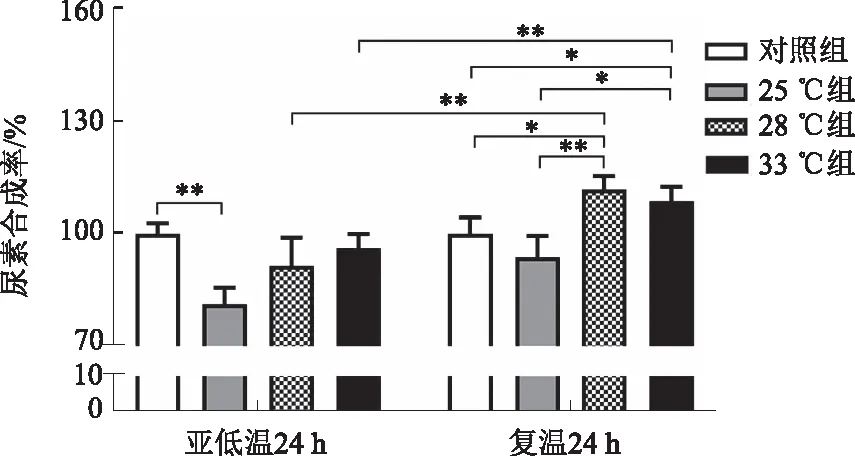
注:*P<0.05,**P<0.01。
2.5 亚低温对肝细胞白蛋白合成的影响亚低温培养各组肝细胞白蛋白合成率较对照组均显著降低(P<0.05)。在复温培养24 h后,25 ℃组肝细胞白蛋白合成率较复温前升高不显著(P>0.05),28 ℃组和33 ℃组较复温前有显著升高(P<0.01),与对照组相比,25 ℃组显著低于对照组(P<0.01),28 ℃组与对照组相比,差异无统计学意义(P>0.05),33 ℃组显著高于对照组(P<0.01),并且28 ℃组与33 ℃组之间差异无统计学意义(P>0.05)(见图4)。
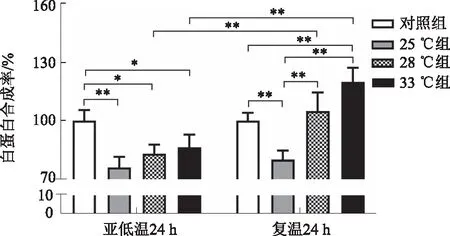
注:*P<0.05,**P<0.01。
2.6 亚低温对肝细胞氨清除率的影响经亚低温培养24 h后,各组肝细胞氨清除率均显著降低(P<0.05)。复温培养24 h后,各组肝细胞氨清除率较亚低温培养时均显著升高(P<0.05),与对照组相比,25 ℃组和28 ℃组的氨清除率差异无统计学意义(P>0.05),而33 ℃组显著升高(P<0.01),并显著高于25 ℃组和28 ℃组(P<0.01)(见图5)。
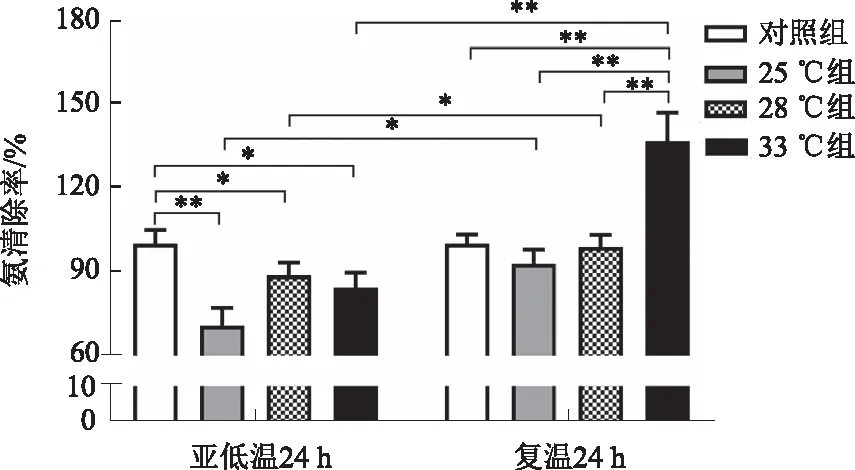
注:*P<0.05,**P<0.01。
3 讨论
众多研究显示,在超低温和4 ℃左右保存的肝细胞复温后,其细胞形态受损,细胞活力显著下降[17-18]。也有研究显示,在10 ℃和20 ℃培养肝细胞均造成细胞形态损伤和活力的丢失[19]。因此,本实验在25~37 ℃之间选择多个温度进行亚低温培养实验,通过评价亚低温培养复温后肝细胞的形态和功能,筛选适合保存和运输肝细胞的温度,了解温度变化可能对细胞造成的影响。
传统肝细胞保存方法研究结果显示,经超低温长期冻存或4 ℃左右短期保存的肝细胞复温培养后,细胞出现细胞颗粒增粗、胞浆变薄、胞膜皱缩等现象,并迅速老化[20-21]。而本实验结果显示,在亚低温条件下,各组乳猪肝细胞未见明显增殖,生长缓慢,细胞未完全展开,与Fu等[13]在32 ℃观察到的肝细胞形态一致,与对照组肝细胞快速增殖的生长特性相比,亚低温下的乳猪肝细胞的增殖和生长代谢能力受到明显抑制。而在25 ℃下肝细胞胞膜周围可见少量棘状突起,少许漂浮细胞,说明25 ℃可能对肝细胞有一定的损伤,影响未完全贴壁的细胞进一步贴壁。复温后乳猪肝细胞迅速增殖,形态典型,说明经亚低温培养的肝细胞复温后仍具有较强的增殖能力,维持正常的肝细胞形态。Fisher等[22]的研究结果也显示,将肝细胞置于32 ℃短期保存,肝细胞的增殖受到抑制,复温后可继续增殖。亚低温抑制肝细胞增殖的机制,可能是亚低温下肝细胞DNA、RNA等大分子合成代谢降低,细胞分裂受到抑制。
肝细胞分离过程酶的消化使肝细胞膜对冻存复温过程中渗透压的变化更敏感[23]。传统的保存方法不能很好地保持细胞膜的稳定性,冻存和低温保存均可诱导细胞膜损伤,造成细胞活力降低和膜大疱的形成,大疱破裂引起细胞内酶漏出,使培养液中LDH、AST等酶活性显著升高[24-25]。本实验采用亚低温培养肝细胞结果显示,亚低温培养和复温后肝细胞的LDH和AST漏出量差异均无统计学意义,提示亚低温培养对肝细胞膜未造成明显损伤。有研究[24]显示,32 ℃培养的肝细胞LDH和AST漏出量明显减少,有利于维持肝细胞膜的稳定。关于亚低温抑制肝细胞LDH和AST漏出的机制,可能是亚低温通过抑制细胞色素C的释放,从而阻止Fas介导的肝细胞凋亡[13],减少由于肝细胞分离过程诱发的细胞凋亡[24],有利于受损肝细胞膜的修复。
肝细胞活力是评价肝细胞保存和运输效果的重要指标之一。研究[26]发现,经亚低温(25~33 ℃)培养的肝细胞复温后,其肝细胞活力接近100%。本实验结果显示,25 ℃组肝细胞活力在复温前后均显著低于对照组,提示25 ℃培养对肝细胞活力有较大的影响,经28 ℃和33 ℃培养的肝细胞复温后其活力显著高于37 ℃对照组,提示28 ℃和33 ℃培养能较好地提高肝细胞的活力,与Fisher等[22]报道一致。其可能原因是亚低温抑制肝细胞凋亡,减少由于肝细胞分离过程诱发的细胞凋亡[23],为肝细胞修复损伤提供更长的时间,使更多的受损肝细胞恢复细胞活力。在众多肝细胞长期冻存和0~4 ℃短期保存的研究中,虽然采用球形体、共培养、微囊包裹等方法可以部分提高复温后肝细胞活性,但复温后肝细胞活力依然不到85%[25,27-28]。因此,从肝细胞活力角度考虑,亚低温培养肝细胞要优于超低温冻存和0~4 ℃短期保存,有望为生物人工肝细胞材料的保存和运输提供一种较好的方法。
肝细胞的保存和运输必须维持有效的细胞功能,这也是生物人工肝和组织工程肝治疗肝衰竭的基本要求。本实验结果显示,亚低温培养肝细胞的尿素合成率、白蛋白合成率、氨清除率较对照组均显著下降(除33 ℃组尿素合成外),提示亚低温抑制肝细胞的合成和生物转化功能。复温后肝细胞的尿素合成率、白蛋白合成率、氨清除率较复温前均显著升高,说明复温后肝细胞的功能能够迅速恢复,并且复温后肝细胞的部分功能显著高于对照组。组间比较显示,经28 ℃和33 ℃培养肝细胞复温后功能均高于25 ℃组,提示28 ℃和33 ℃培养能更好地维持肝细胞的功能,这与肝细胞活性检测结果一致。
以往大量研究显示,在超低温冻存和0~4 ℃保存肝细胞过程中,产生的溶质、冰晶损伤和诱发的细胞凋亡进一步加重肝细胞消化分离过程的细胞损伤,复温后肝细胞从低氧转入高氧状态,产生大量氧自由基和脂质过氧化物,再次造成细胞损伤和凋亡,使复温后肝细胞功能显著下降[29-30]。而本实验亚低温培养能较好地维持复温后肝细胞功能,并提高肝细胞的部分功能。其可能原因是亚低温培养不产生渗透压、氧张力变化,不形成冰晶,能够抑制细胞凋亡[13,15],减少了因肝细胞的损伤和细胞凋亡导致的细胞数量损失。同时亚低温部分抑制肝细胞代谢,肝细胞处于低代谢水平,减少了代谢产物的毒性作用,为肝细胞修复肝细胞损伤提供更多的时间。因此,本研究表明亚低温培养有可能为临床生物人工肝治疗提供一种较好的肝细胞保存和运输方法。
