48份玉米自交系抗病性的精准鉴定
2021-08-12赵子麒赵雅琪林昌朋赵永泽余宇潇孟庆立曾广莹薛吉全杨琴
赵子麒,赵雅琪,林昌朋,赵永泽,余宇潇,孟庆立,曾广莹,薛吉全,杨琴✉
1西北农林科技大学农学院/旱区作物逆境生物学国家重点实验室/农业农村部西北旱区玉米生物学与遗传育种重点实验室,陕西杨凌 712100;2宝鸡市农业科学研究院,陕西岐山 722499;3镇坪县农业科学研究所,陕西镇坪 725600
0 引言
【研究意义】玉米是全世界种植范围最广、总产量最高的作物。在全球气候变化的背景下,由于耕作制度、栽培方式的转变和新品种的推广,中国玉米病害发生呈现新的动态,特别是茎腐病(stalk rot)、穗腐病(ear rot)、大斑病(northern leaf blight)、小斑病(southern leaf blight)、灰斑病(gray leaf spot)等发生频率增加,影响范围扩大,给玉米产量和品质带来巨大威胁[1-6]。收集和鉴定重要玉米种质的综合抗性,明确种质中的优良抗病等位基因,对抗病育种意义重大。【前人研究进展】茎腐病当前已成为全国性的重大病害,近年来,在中国西北、东北、黄淮海部分地区重度发生,高感品种的发病率达到 40%—100%[2-3]。镰孢穗腐病在全国不同玉米产区均有发生,感病品种的发病率可高达50%,致病菌在籽粒中产生的毒素直接威胁人畜健康[4]。大斑病在中国东北、华北北部、西北东部、西南山区等地发病势头严重,一般造成减产 20%[5]。小斑病在温暖潮湿的气候条件下发病严重,感病品种在严重发生年份减产 20%—30%[3]。灰斑病主要在中国东北、西南地区发生,近几年扩展迅速,严重发生时产量损失达10%—60%[6]。种植抗病品种是病害防治最经济有效的措施,开展抗病性和抗病基因鉴定是选育抗病品种的前提。国内外学者针对不同玉米病害开展了大量的抗病性鉴定工作,筛选出一系列抗病种质[1,3-4,7-18]。然而,大部分研究只针对1种或2种病害进行种质资源抗性评价,很少开展多年多点的鉴定,难以解决当前多种病害同时混合发生的问题。利用抗病基因培育抗病品种是更加经济有效的途径,分子标记辅助育种可以大大缩短育种年限,在抗病主基因的导入方面有明显的优势[19]。目前,针对玉米茎腐病、穗腐病、大斑病、小斑病和灰斑病,已克隆的基因有 5个,包括抗大斑病Htn1(ZmWAK-RLK1)[20],多抗玉米小斑病、灰斑病qMdr9.02(ZmCCoAOMT2)[21],抗禾谷镰孢茎腐病qRfg1(ZmCCT)[22]和qRfg2(ZmAuxRP1)[23],以及抗炭疽茎腐病Rcg1[24]。利用抗病基因的功能分子标记,开展自交系基因型鉴定,结合抗病性精准评价,将为抗病育种提供优良的抗病性改良靶点。目前,玉米中已报道的抗病位点鉴定主要利用与抗病基因连锁的分子标记,由于玉米自交系之间遗传变异丰富,位点间重组率高,如果分子标记与抗病基因相距较远,可能会导致分子标记鉴定结果与抗病性不符[25-27]。目前还没有针对这些已知抗病基因开展种质资源精准鉴定的研究。【本研究切入点】病害是影响玉米产量和品质的重要因素,选育综合抗性优良的品种对保障玉米高产稳产至关重要。对重要玉米自交系开展多年多点多个病害的综合鉴定,对已知抗病基因进行准确鉴定,将为玉米抗病性遗传改良提供材料基础和技术支撑,然而目前仍然缺乏这方面的系统研究。【拟解决的关键问题】本研究收集陕A群、陕B群30份核心自交系和 18份国内外优良种质,分别于 2019年和2020年在陕西省杨凌区、岐山县、三原县、镇坪县鉴定禾谷镰孢茎腐病、禾谷镰孢穗腐病、大斑病、小斑病和灰斑病的抗性,分析种质对不同病害抗性水平及其相关性,明确材料的综合抗性及已知抗病基因数目,为抗病育种提供材料基础。
1 材料与方法
1.1 供试材料和田间试验设计
陕A群、陕B群是由西北农林科技大学玉米遗传育种课题组构建的2个杂种优势群,依据“二群论”理论,以国内外优良种质形成的综合种为基础群体,以提高适应性为主线,采用两边推、两向分群的育种思路,强化逆境选择(高密、低氮、干旱),通过多点联合持续改良,育成了一批早熟、耐密、高产、宜机收的自交系。选择11份陕A群核心玉米自交系:KA064、KA081、KA103、KA105、KA106、KA109、KA115、KA147、KA203、KA225、KA327;19 份陕B群核心自交系:KB019、KB020、KB024、KB025、KB043、KB052、KB062、KB081、KB089、KB102、KB106、KB107、KB109、KB128、KB204、KB207、KB227、KB243、KB588;18份国内外重要种质:1145、2082、AMD43、B110、B73、CML170、Mo17、NW-H537、PH4CV、PH6WC、PHK42、PHN11、PHT60、X178、昌 7-2、黄早四、沈 137、郑 58。大斑病、小斑病和灰斑病选取1145为抗病对照,B73为感病对照;茎腐病选取1145为抗病对照,黄早四为感病对照;穗腐病选择昌7-2为感病对照。
1.2 病原菌及田间接种鉴定方法
1.2.1 供试病原菌 大斑病病原菌为大斑凸脐蠕孢(Exserohilumturcicum),分离自陕西省岐山县田间采集的大斑病样;小斑病病原菌为玉蜀黍平脐蠕孢(Bipolarismaydis),由中国农业科学院作物科学研究所段灿星副研究员惠赠;灰斑病病原菌为玉米尾孢(Cercosporazeina),分离自陕西省镇坪县采集病样;禾谷镰孢菌(Fusariumgraminearum)由西北农林科技大学龙书生副研究员惠赠。
1.2.2 病原菌接种方法 采用高粱粒接种法[28]接种小斑病和大斑病。将马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基上活化的大斑凸脐蠕孢/玉蜀黍平脐蠕孢切成小块,接种到含有灭菌高粱粒的锥形瓶中,26℃黑暗条件下静置培养,培养期间,定期摇晃锥形瓶,保证菌丝充分生长。待菌丝长满高粱粒后,将高粱粒接种物倒出,自然晾干备用。在玉米苗期6—8叶期,将制备好的带菌高粱粒投入植株心叶中,每株接种15—20粒,接种时间选择在傍晚或阴天进行。灰斑病为田间自然发病。
采用田间土埋伤根接种法[29]接种禾谷镰孢茎腐病。将PDA平板上活化的禾谷镰孢菌接种于经高压灭菌的玉米粒培养基进行扩繁。26℃黑暗培养10—14 d后,菌丝布满玉米粒,即可用于田间接种。在玉米抽雄期,距离植株茎基部约5 cm处,向下剖开土壤并切断毛细根,将培养好的带菌玉米70—80粒埋入根系处,接种后覆土并进行浇灌,保证土壤湿润。
采用花丝通道法和针刺果穗法分别进行2次接种禾谷镰孢穗腐病[30-31]。将PDA平板上活化的禾谷镰孢菌切成小块,接种到液体绿豆培养基中,25℃黑暗条件180 r/min震荡培养7—10 d,过滤菌丝,收集孢子悬浮液,配置孢子浓度为1×106个/mL的接种液,加入表面活性剂吐温20,浓度为2 µL·mL-1,混匀待用。在玉米吐丝后7 d进行第1次接种,采用花丝通道法将2 mL孢子悬浮液注射到玉米果穗顶端,在吐丝后14 d进行第2次接种,采用针刺果穗法将2 mL孢子悬浮液注射到玉米果穗中部。
1.2.3 抗病性鉴定方法 小斑病/灰斑病:玉米进入乳熟期开始调查,重点调查穗位叶及果穗的上部和下部各1叶,根据叶片的感病面积进行病情分级,分级方法参考1—9级鉴定标准[32],其中,1为高抗,9为高感。共调查3次,每次间隔7—10 d,以3次的结果对发病情况进行综合判断(表1)。
大斑病:玉米进入乳熟后期开始调查,针对感病叶片面积占整株叶片面积的比例进行病情分级,分级方法参考《玉米抗病虫性鉴定技术规范NY/T 1248.1-2006》(表1)。
禾谷镰孢茎腐病:在玉米生理成熟后进行劈茎调查,将植株沿茎秆纵向劈开,根据茎秆内坏死组织的长度和坏死程度进行病情分级(图1和表1)[29]。
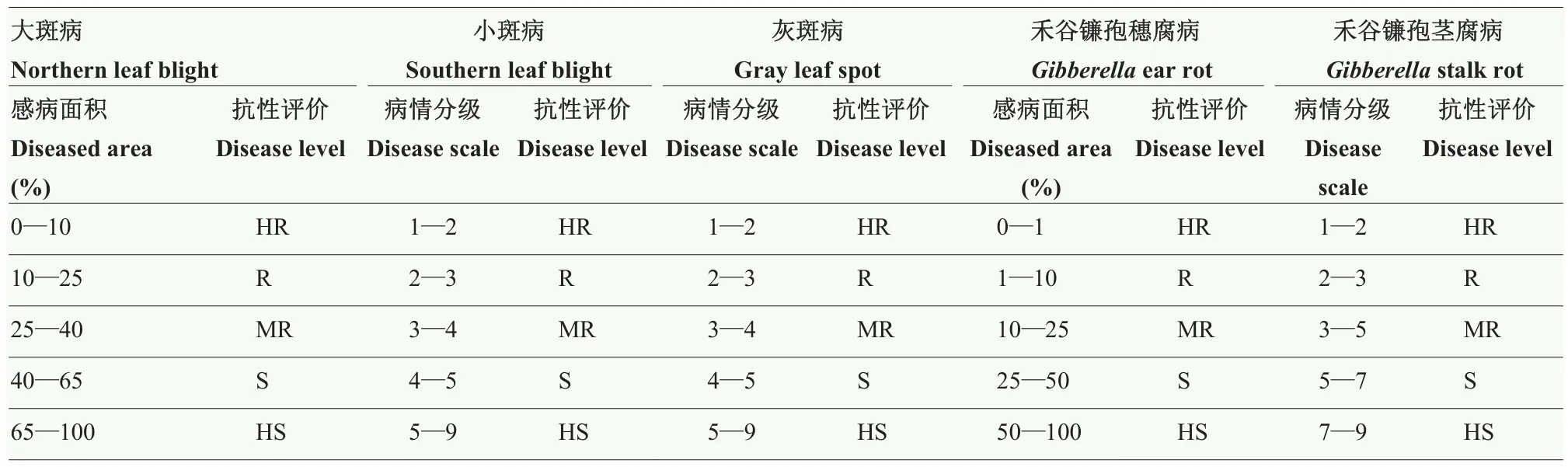
表1 玉米大斑病、小斑病、灰斑病、穗腐病及茎腐病病情级别与抗性评价Table 1 Disease rating scale and evaluation of northern leaf blight, southern leaf blight, gray leaf spot, ear rot and stalk rot in maize
禾谷镰孢穗腐病:在玉米生理成熟后,采收接种的玉米果穗,逐穗进行病情分级调查(表 1)。分级方法参考《玉米抗病虫性鉴定技术规范 NY/T 1248.8-2016》。
2)随着泵进口压力的降低,气泡在叶片表面的分布逐渐增加,并且逐渐由叶片的背面低压区向流道内扩展;气泡随着液流向出口处扩散时,由于压力的升高又会破灭而对叶片产生侵蚀,严重时会造成泵外特性曲线的下降。
1.3 数据分析
采用整行调查法进行大斑病、小斑病、灰斑病的病情分级,采用sAUDPC(standardized area under disease progress curve)[33]计算最终表型值,计算公式为:
其中,yi为每次调查的病情分级,ti+1—ti为相邻 2次调查相隔的天数,n代表总共调查的次数。
禾谷镰孢茎腐病和穗腐病采用单株调查法,每行调查除第1株之外的所有植株,取平均值用于分析。多年多点的表型数据使用最佳线性无偏预测值(best linear unbiased prediction,BLUP)来估算。利用SAS软件PROC MIXED模型计算[34],将基因型作为固定效应,将环境、基因型与环境互作、重复、散粉期都作为随机效应,获得不同病害抗病性的BLUP值。利用R软件计算不同病害之间的相关性。
1.4 抗病基因鉴定方法
在玉米 8—10叶期取样,每个材料随机选 5—8株混合取新鲜叶片,用 SDS法提取叶片基因组DNA[35]。检测4个抗病基因的引物见表2。使用全式金高保真酶(TransStart®FastPfu DNA Polymerase)对每个基因进行PCR扩增,通过琼脂糖凝胶电泳或PCR产物测序,进行基因型鉴定。
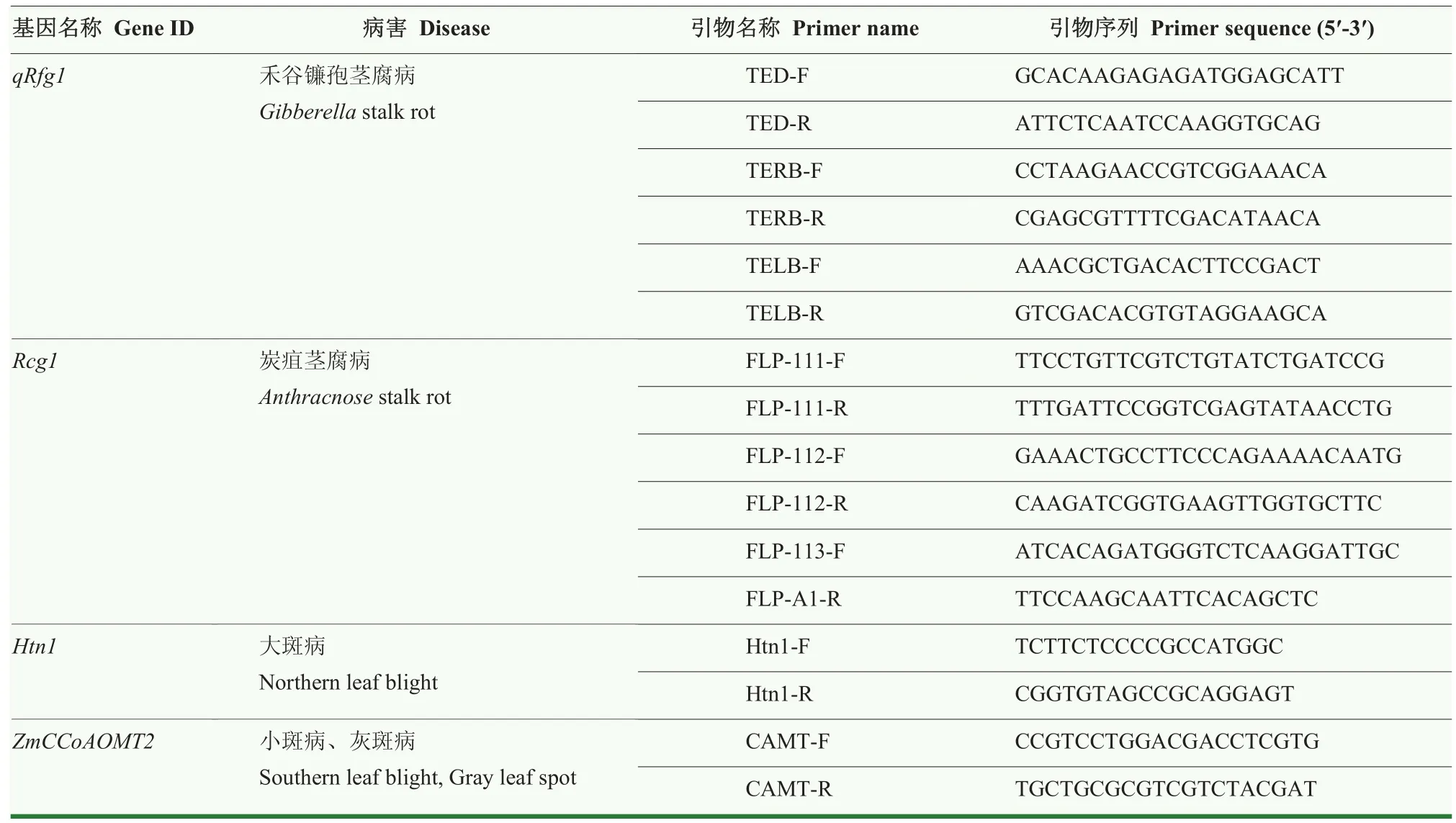
表2 已克隆抗病基因鉴定引物Table 2 Primers used to identify the cloned disease resistance genes
2 结果
2.1 5种病害抗病性表型分析
2年的接种鉴定结果表明,大斑病的感病对照B73的感病面积 BLUP值为 45.63%,抗病对照 1145为3.48%(图2-a);小斑病、灰斑病的感病对照B73的病情级别BLUP值分别为5.59和5.19,抗病对照1145为2.33和2.57(图2-b和图2-c);茎腐病的感病对照黄早四的病情级别BLUP值为7.03,抗病对照1145为1.11(图2-d);穗腐病感病对照昌7-2的发病面积BLUP值达到54.1%(图2-e)。抗感材料抗病性差异明显,表明接种鉴定条件可以显著区分抗病材料和感病材料。
48份自交系对不同病害的抗病性表型均呈正态分布,表型变异范围很大(图 2)。方差组分分析表明,大斑病、小斑病、灰斑病和禾谷镰孢茎腐病的基因型效应差异极显著,重复、环境差异不显著,基因型与环境互作效应显著(表 3)。禾谷镰孢穗腐病基因型与环境互作效应极显著,试验残差极大,导致基因型效应不显著(表3)。
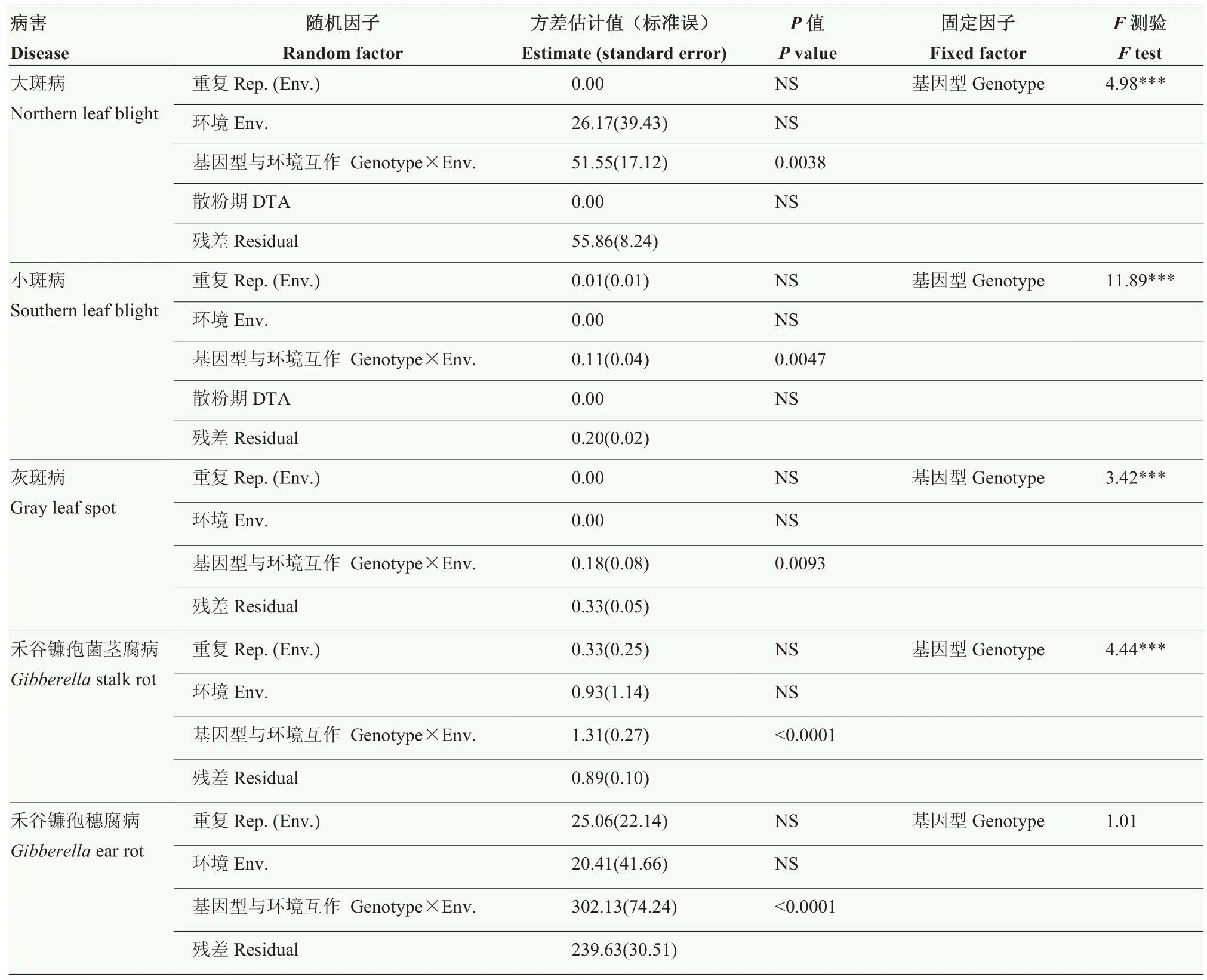
表3 48份玉米自交系对不同病害抗性方差组分分析Table 3 Variance component analysis for resistance to different diseases on 48 maize inbred lines
对5种病害分别进行抗性评价,获得高抗、抗、中抗大斑病的材料分别为9份(占18.75%)、18份(37.5%)和 14份(29.2%);高抗、抗、中抗小斑病的材料分别为2份(4.2%)、16份(33.3%)和15份(31.25%);抗、中抗灰斑病的材料分别为 10份(20.8%)和 23份(47.9%);高抗、抗、中抗禾谷镰孢茎腐病的材料分别为5份(10.4%)、14份(29.2%)和18份(37.5%);抗、中抗禾谷镰孢穗腐病的材料分别为5份(10.4%)和26份(54.2%);无高抗灰斑病和穗腐病材料(表4)。
兼抗3种叶斑病的材料有1145、CML170、KA103、KA327、KB102、X178、沈137和郑58共8份材料,对 5种病害综合抗性表现优良的自交系有 1145、CML170、KA105、KB020、X178、沈137和郑58共7份材料(表4)。
2.2 5种病害抗病性相关性分析
对48份自交系的5种病害抗性BLUP值进行成对相关性分析(图3),结果表明,灰斑病与大斑病抗性相关性最高,相关系数达到 0.74(P<0.001),灰斑病与小斑病抗性的相关系数为 0.67(P<0.001),大斑病与小斑病抗性的相关系数为0.61(P<0.001)。禾谷镰孢茎腐病与3个叶斑病的抗性也呈极显著正相关,相关系数介于0.37—0.57(P<0.01),其中,大斑病与茎腐病抗性的相关性最高。禾谷镰孢穗腐病与其他4个病害的抗性之间无显著相关性。
2.3 4个已知抗病基因分子标记鉴定结果
针对本研究鉴定的5种病害,目前已报道的图位克隆的抗病基因有5个,抗禾谷镰孢茎腐病位点qRfg2的抗病基因功能变异位点尚不清楚,因此,无法进行抗病等位基因的准确鉴定。选择抗禾谷镰孢茎腐病主效位点qRfg1、抗炭疽茎腐病主效位点Rcg1、抗大斑病位点Htn1和多抗小斑病与灰斑病的ZmCCoAOMT2,利用已发表的引物或根据已知基因序列信息设计引物(表2),对48份自交系进行抗病位点基因型检测。结果表明(表5),1145、KA081和沈 137带有抗病的qRfg1等位基因,只有 1份材料KB109带有抗病的Rcg1等位基因,KA081、KA115、KA147、KA327、KB020、KB043、KB052、KB106、KB128、KB207、KB243、PH6WC和沈137共13份材料带有抗病的Htn1,1145、KA064、KA106等 25份自交系带有抗病的ZmCCoAOMT2等位基因。其中,沈137带有3个抗病等位基因,包括qRfg1、Htn1和ZmCCoAOMT2。
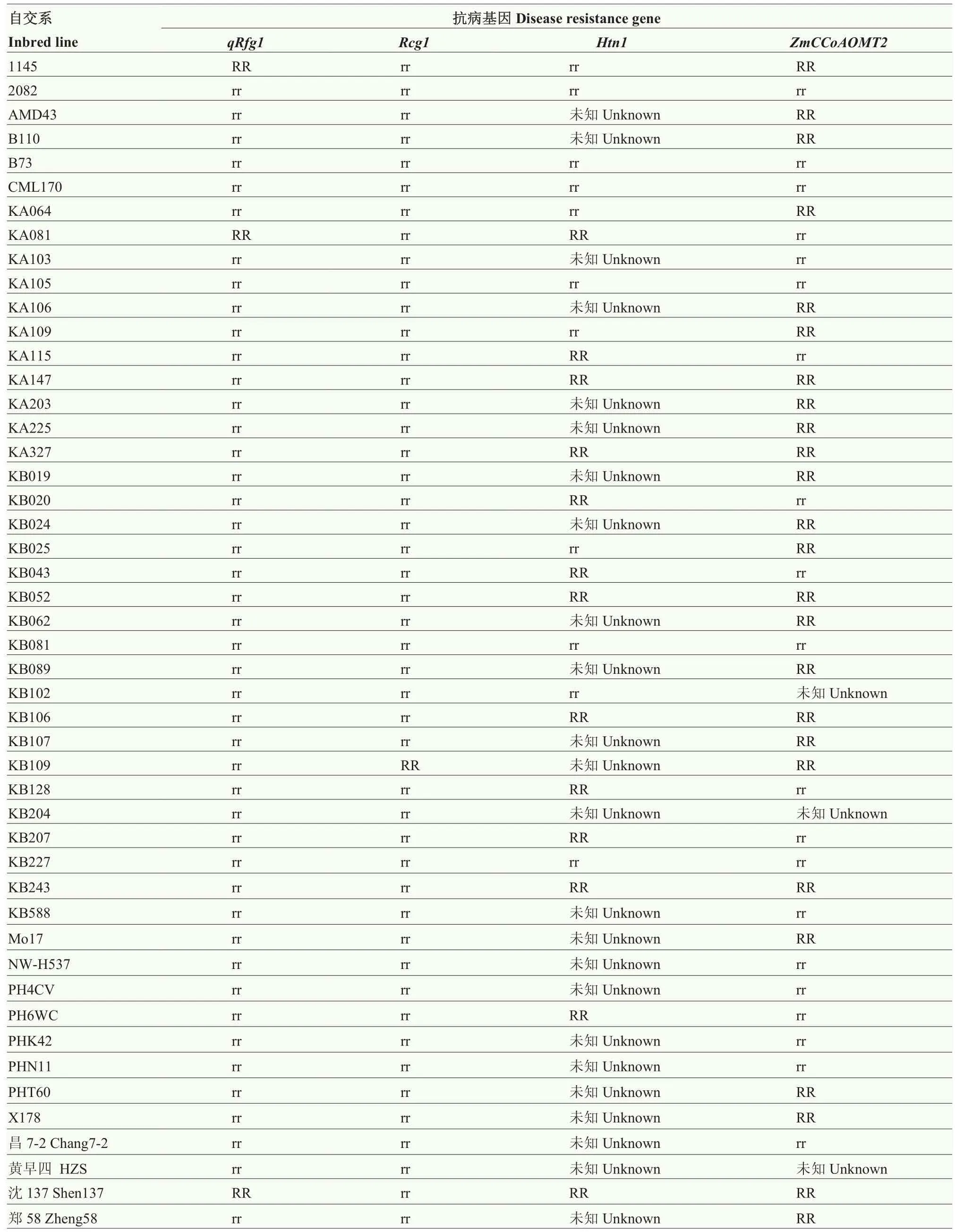
表5 玉米自交系已克隆抗病基因基因型检测结果Table 5 Test results of the cloned resistance genes in maize inbred lines
3 讨论
茎腐病、穗腐病、大斑病、小斑病和灰斑病是世界范围内重要的玉米病害[36-37]。大部分研究针对单一病害开展种质资源的自然发病鉴定或人工接种鉴定,缺乏对多个病害的多年多点重复接种鉴定[3,7-8]。玉米对这些病害的抗性都是复杂的数量抗性,鉴定结果受环境条件影响较大,自然发病条件下可能存在发病不充分的现象,影响鉴定结果的准确性。本研究对国内外48份优良自交系开展多个环境下大斑病、小斑病、禾谷镰孢茎腐病、禾谷镰孢穗腐病的田间接种鉴定和灰斑病自然发病鉴定,发现测试群体中抗叶斑病的种质较为丰富,茎腐病、穗腐病的抗原不多,一方面,可能由于叶斑病比茎腐病、穗腐病抗性更容易在育种中被选择;另一方面,可能由于茎腐病、穗腐病缺乏主效抗性基因,很难通过传统育种选择,同时聚合多个抗病位点。大斑病、小斑病和灰斑病抗性之间呈极显著正相关,相关系数高达0.61—0.74,暗示这3种叶斑病抗性可能有共同的遗传基础,可进一步挖掘多抗叶斑病的数量性状位点。此外,研究发现一些兼抗2种或2种以上病害的材料,其中,1145、CML170、KA105、KB020、X178、沈137和郑58对5种病害的综合抗性表现良好,可作为供体亲本进行自交系的综合抗性改良。与抗病基因紧密连锁的分子标记可用于抗病性辅助育种,加快抗病育种进程。玉米抗丝黑穗病主效位点qHSR1和抗禾谷镰孢茎腐病主效位点qRfg1已被成功用于分子标记辅助改良不同玉米材料的抗病性[38-39]。玉米种质资源遗传变异丰富,明确不同材料中携带的抗病基因类型,可为抗病分子育种提供准确的抗原信息,优化抗性改良的策略。本研究发现,1145、KA081和沈137共3份材料携带抗病的qRfg1等位基因,对茎腐病表现均为抗病以上级别;只有KB109这1份材料带有抗炭疽茎腐病的Rcg1等位基因,其对禾谷镰孢茎腐病也表现为抗病,该结果暗示qRfg1、Rcg1这些茎腐病数量抗性位点可能对不同病原真菌引起的玉米茎腐病均有抗性,同时也表明qRfg1和Rcg1在测试群体中属于稀有等位基因,可通过分子标记辅助选择导入感病材料进行茎腐病抗性改良。带有抗大斑病的Htn1的材料有13份,其中,9份自交系对大斑病表现为抗病以上级别,4份表现为中抗,说明Htn1对大斑病的抗性改良效果明显。具有抗病的ZmCCoAOMT2等位基因的材料有25份,其中12份对小斑病表现中抗以上表型,14份对灰斑病表现中抗以上表型,10份材料同时对小斑病和灰斑病表现中抗以上表型,说明ZmCCoAOMT2作为一个微效抗病基因,在进行小斑病和灰斑病抗性改良时,必须与其他基因聚合使用,才能达到理想的效果。沈137对5种病害的综合抗性表现良好,同时携带qRfg1、Htn1和ZmCCoAOMT2共3个抗病等位基因,可利用这 3个基因的功能分子标记同时进行3种病害的辅助改良。
目前,在玉米中克隆的抗病基因还很少,针对本研究鉴定的 5个病害,只克隆了 3个抗茎腐病基因(qRfg1、qRfg2和Rcg1)、1个抗大斑病基因(Htn1)和1个兼抗小斑病和灰斑病的基因(ZmCCoAOMT2)。qRfg2的功能变异位点还不清楚,因此,无法进行抗病基因的准确鉴定。目前还没有克隆穗腐病的抗病基因。研究表明这些病害的抗性都是复杂的数量性状,由多个遗传位点控制,因此,需要进一步挖掘新的抗病基因。本研究发现,对茎腐病表现中抗及以上表型的材料有37份,而带有抗病qRfg1等位基因的材料只有 3份;对大斑病表现中抗及以上表型的材料有41份,带有抗病Htn1等位基因的材料只有13份;对小斑病、灰斑病表现中抗及以上表型的材料各有33份,而带有抗病ZmCCoAOMT2等位基因的材料仅有10份对小斑病和灰斑病均表现中抗以上表型。这些结果充分说明,大部分抗病材料中还有未知抗病基因亟待发掘。例如,本研究发现有一些综合抗性表现良好的自交系如 CML170和KA105,并不携带任何已知的抗病基因,但对 5种病害均表现出良好的抗性,因此,可以进一步从中挖掘新的抗病位点。
茎腐病、穗腐病致病菌复杂多样,发病程度与环境条件密切相关[7,40]。本文只选择了禾谷镰孢菌进行接种鉴定,后续研究将对关键材料进行肿囊腐霉菌、拟轮枝镰孢菌等多个致病菌的接种鉴定,通过多年多点数据明确种质对不同病原菌的综合抗性,确保材料抗病性的稳定性和持久性。另外,由于茎腐病和穗腐病表型鉴定的复杂性,建议设置多个重复,提高鉴定的准确性。灰斑病目前还没有成熟的人工接种鉴定的统一标准,采用自然发病取决于选择的鉴定地点和当年的气候条件,陕西省镇坪县是玉米尾孢灰斑病的高发区[6,41],有研究表明,不同玉米种质对玉米尾孢和玉蜀黍尾孢菌的抗性可能不一样,因此需要进一步对玉蜀黍尾孢灰斑病进行抗性鉴定。
4 结论
1145、CML170、KA105、KB020、X178、沈 137和郑 58这 7份材料的综合抗性表现良好,KA081、KA115、KB207等多份材料抗2种以上病害。大斑病、小斑病、灰斑病和禾谷镰孢茎腐病抗性之间呈极显著正相关,与禾谷镰孢穗腐病无显著相关。自交系沈137同时携带抗病的qRfg1、Htn1和ZmCCoAOMT2等位基因,可用于分子标记辅助改良。CML170和KA105不携带已知的4个抗病位点,但对5种病害均表现出良好的抗性,可用于挖掘新的抗病基因。
