铁细菌培养过程中低分子有机酸钠盐对含硫酸根铁矿物形成的影响
2021-07-29姜艾伶熊慧欣
花 敏,张 笛,姜艾伶,熊慧欣
(扬州大学 环境科学与工程学院, 江苏 扬州 225127)
嗜酸性氧化亚铁硫杆菌(Acidithiobacillusferrooxidans, 简称A.ferrooxidans)是一种典型的化能自养菌,主要通过氧化Fe2+、单质S及还原态硫化物来获取生命活动所需能量(Xiongetal., 2008)。在富含A.ferrooxidans的酸性矿山废水等自然环境中普遍存在的生物成因铁的氢氧化合物等矿物可以降解环境介质中的重金属等污染物(Bighametal., 1994)。如施氏矿Fe8O8(OH)6SO4和黄钾铁矾KFe3(SO4)2(OH)6等生物诱导而形成的铁沉淀矿物可以清除酸性矿山废水环境中的铜、铬等重金属(Songetal., 2015; Lietal., 2016)。故A.ferrooxidans等铁细菌作用下生物成因铁矿物的形成及其相互作用日益被人们所重视(Xiongetal., 2008; 徐轶群等, 2013),并具有良好的环境应用前景(Burtonetal., 2012; Zhuetal., 2013)。
众所周知,土壤中普遍存在植物根系分泌物和微生物分解的腐殖质,腐殖质的分泌过程中常伴随着溶解性低分子量有机酸(最常见的有柠檬酸、草酸、酒石酸和苹果酸)的生成,这些低分子量有机酸的浓度一般不高,为微摩尔至毫摩尔数量级(王永壮等, 2018)。低分子量有机酸可以通过配位络合的方式参与土壤重金属迁移转化以提高重金属的生物有效性(Sullivanetal., 2012)。如Chiang等(2011)利用柠檬酸、草酸、酒石酸、乙酸等低分子量有机酸处理放射性物质137Cs污染土壤时发现,有机酸释放的H+和酸根离子易与土壤矿物表面发生反应;有机配体在酸性环境条件下与土壤矿物相互作用可形成相关复合物,从而缓慢释放土壤中的137Cs。同时,低分子量有机酸可被土壤胶体和矿物质吸附,有机酸离子的存在可使土壤ζ电位降低,从而导致土壤组分的表面性质发生变化(Xuetal., 2004; Gaoetal., 2010)。可见这些低分子量有机酸与土壤矿物间的相互作用,对土壤重金属的净化和治理有着非常重要的意义。低分子量有机酸常与铁的氧化物共存(Wangetal., 2007; Moradietal., 2012),如二元羧酸草酸容易与矿物表面Fe(Ⅲ)结合形成 Fe(Ⅲ)-草酸盐络合物吸附在黄钾铁矾表面,形成稳定络合物(Wangetal., 2017)。低分子量有机酸不仅对铁的地球生物循环有较大影响,而且对环境中重金属的迁移转化起着极为重要的作用(Xieetal., 2017)。草酸盐会影响含As(V)黄钾铁矾的稳定性和共沉淀As(V)的迁移,如草酸盐于pH=2.5条件下结合矿物表面的Fe(Ⅲ)形成络合物,从而促进含As(Ⅴ)黄钾铁矾的溶解(唐苑君等, 2020);有研究证实在草酸盐存在下,反应溶液pH=3.0时会促进As(V)从矿物相迁移至溶液相(Renetal., 2018)。此外Li等(2014)研究亦发现,pH=1.6~2.2时,添加柠檬酸可减少表观基质饱和常数,从而降低铁离子的竞争性,减少产物的抑制作用。
环境介质中的重金属和铁矿物间的相互作用,常与铁细菌的生物矿化作用密不可分(党政等, 2018)。低分子量有机酸的存在会影响铁细菌的代谢和生物矿化(Tuetal., 2019),如低分子量有机酸的浓度过高会抑制A.ferrooxidans的活性及其Fe2+氧化和溶液(初始pH=2.0~3.0)的酸化程度,从而导致生物酸化速度减慢和重金属去除效率降低(宋永伟等, 2016)。基于低分子量有机酸在铁细菌的代谢过程和生物矿化环境意义中的重要作用与影响,本文主要探讨了低分子有机酸钠盐对A.ferrooxidans培养液体中铁矿物产物形成的影响,并对主要铁矿物产物进行表征与观察。其获得结果可为A.ferrooxidans存在的相关污染环境和工程环境介质中铁矿物的形成及其物相转化机理提供理论参考。
1 材料与方法
1.1 铁细菌和培养介质
实验用铁细菌为A.ferrooxidansHX3(其基因数据库登入号为HQ009292)。细菌培养介质为改进型9 K培养液,即由(NH4)2SO43.5 g、K2HPO40.058 g、KCl 0.116 g、MgSO4·7 H2O 0.58 g和Ca(NO3)2·4 H2O 0.016 8 g 溶解于1 L去离子水中配置而成,并用1∶1 的H2SO4调节pH值为3.0±0.2,于121℃下湿热灭菌15 min,待用;铁细菌所需能量由FeSO4·7 H2O 44.2 g铁盐提供。
1.2 细菌培养过程中铁矿物的形成实验
3组铁矿物形成实验a、b和c, 分别于500 mL锥形瓶中加入300 mL改进型9 K培养液,外源加入系列摩尔浓度(表1)的低分子有机酸钠盐草酸钠(sodium oxalate: 简写为SO,Na2C2O4)、柠檬酸钠(sodium citrate: 简写为SC, C6H5Na3O7·2 H2O)和苹果酸钠(sodium malate: 简写为SM, C4H4Na2O5); 然后接种5%的A.ferrooxidansHX3菌液,用1∶1的H2SO4调节初始pH值至2.8±0.1,置于28℃ 和180 r/min转速的摇床中振动。另外,一致反应条件下,设置对照处理(即未加低分子有机酸钠盐的A.ferrooxidansHX3培养液,简称CK),其初始pH值约为2.8。上述处理均设置3个平行样。
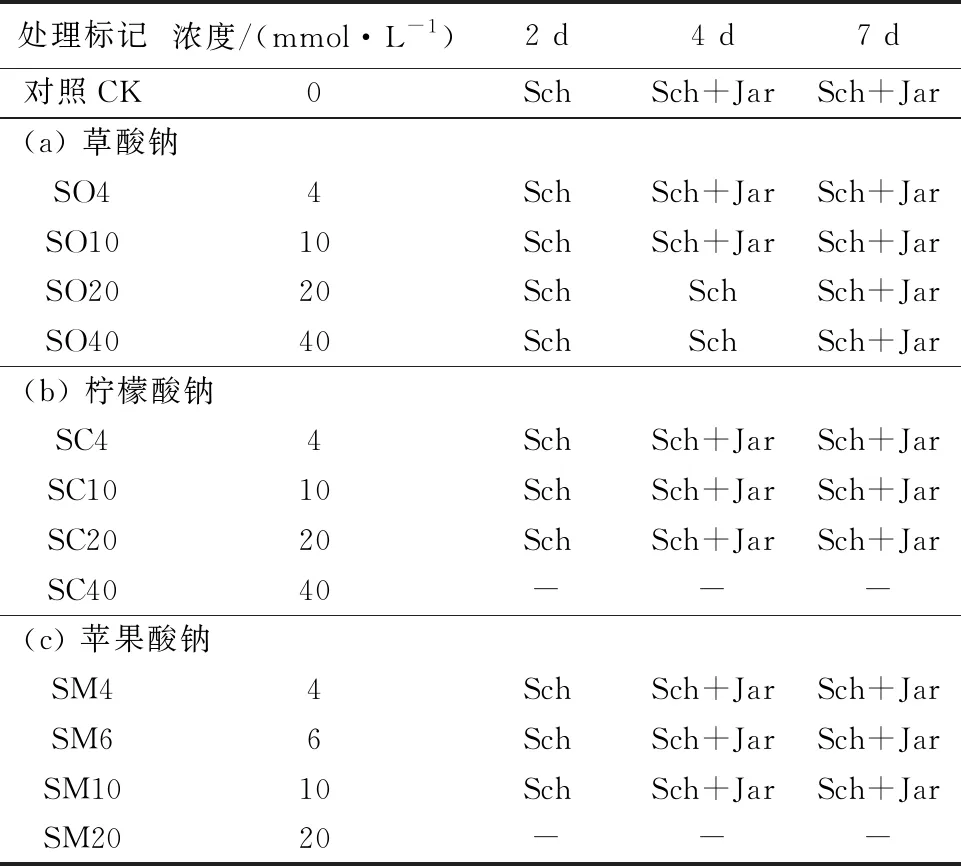
表 1 低分子有机酸钠盐的浓度及形成的铁沉淀物Table 1 Concentrations of low molecular organic sodium salts and the formed iron precipitates
0~168 h反应期间,每隔12 h拍照记录A.ferrooxidans培养液的颜色和浊度变化情况;测试溶液pH值(采用pHS-3C型数字pH计测定); 取2 mL溶液在10 000 r/min离心去沉淀后的上清液酸化后于4℃保存,待测Fe2+浓度(采用邻菲罗啉比色法测定; APHA)。每次取样前,用称重法补充因蒸发等损失的水分。另将分别培养至2、4 和7 d的含A.ferrooxidans菌液中形成的铁沉淀物离心取出,并用去离子水反复洗涤以去杂质离子,40℃烘干后保存于干燥器皿,待表征分析。
1.3 矿物样品的表征测试方法
晶型在扬州大学测试中心由德国Bruker公司的D8 Advance型多晶X-ray衍射仪测定(工作条件为CuKα线、40 kV、200 mA,扫描速度4°/min,扫描范围10°~80°);对照JCPDS卡片确定测试样品衍射特征峰对应d值。在扬州大学化学与化工学院采用德国Bruker公司的Tensor 27傅立叶变换红外光谱仪测定颗粒的表面结构组成及键合情况;该仪器配有一个带有KBr分光镜的DTGS检波器,测试背景值400 mg KBr,分辨率为4 cm-1。形貌结构与能谱元素分析在扬州大学测试中心由日本日立公司Hitachi S-4800和Zeiss Supra55场发射扫描电子显微镜测定。
2 结果与讨论
2.1 细菌培养过程中溶液颜色变化
A.ferrooxidans培养过程中溶液的颜色随时间的变化如图1所示。未加低分子有机酸钠盐对照处理(CK)和含有草酸钠(a组)的所有处理SO4~SO40的溶液颜色在初始48 h内由淡黄色转变为红棕色,并伴随有铁沉淀物形成。含有柠檬酸钠(b组)的SC40处理中未观察到有铁沉淀形成,溶液颜色在初始36 h内由黄绿色转变成黄棕色,而后逐渐转变为棕红色;其余处理SC4~SC20在初始48 h内溶液颜色由黄绿色转变成橘色或红棕色,且伴随有铁沉淀物形成。含有苹果酸钠(c组)的SM20处理中无沉淀形成;其余处理SM4~SM10在初始24 h内溶液的颜色由深黄色转变成红棕色,且伴随有铁沉淀物形成。
2.2 溶液pH值及Fe2+浓度的变化
细菌培养处理的溶液pH值和Fe2+溶度变化情况见图2。溶液pH值随着培养时间的延迟整体呈下降趋势,于132 h后均趋于平稳(图2);其中含有草酸钠盐处理中溶液pH值(除SO40于120 h后)均于60 h后由初始值2.8下降至平稳值1.8~2.1范围内;含有柠檬酸钠和苹果酸钠处理(除SM20外)与对照处理(CK)变化一致,于初始60 h内快速下降,然后波动缓慢下降至平稳值1.6~1.9范围内(SM20处理的溶液pH值为2.2)。

图 1 含不同浓度低分子有机酸钠盐的细菌培养液颜色随时间的变化Fig. 1 Color changes of bacterial cultures containing the low molecular organic acid salts at their different concentrations with time
培养液pH值下降主要是由于Fe2+被生物催化氧化成的Fe3+水解形成铁沉淀过程中伴随有H+释放至溶液中(Xiong and Guo, 2011; 宋永伟等, 2018)。pH值波动趋于平稳过程中略有上升可能是因为在铁矿物沉淀动态形成过程中矿物沉淀的溶解速度比其生成速度快,导致反应溶液中OH-略升高;亦可能是随着反应时间的延续,形成的矿物逐渐稳定,吸附在矿物表面不稳定的Fe3+水合物逐步解吸并释放到液相,使Fe3+和OH-略升高(梁剑茹等, 2011)。所加外源低分子有机酸钠盐种类不同,溶液pH值变化呈现一定差异,这可能与不同结构酸根离子对铁细菌活性的影响和铁矿物沉淀形成的存在差异有关(Renetal., 2009; 宋永伟等, 2016)。
溶液中Fe2+浓度随着细菌培养时间的延迟变化趋势如图2所示。对照处理(CK)和含低浓度有机酸钠盐处理在48 h内Fe2+均被完全氧化成Fe3+。而含高浓度低分子有机酸钠盐SO40处理中Fe2+完全被生物催化氧化所需时间延迟了72 h; 含SC40和SM20的处理中7 d后溶液中Fe2+氧化率仍低于30%。显然,高浓度低分子有机酸钠盐对细菌氧化Fe2+的能力有明显的抑制。3种低分子有机酸钠盐对细菌氧化Fe2+能力的抑制影响从大到小的顺序为:苹果酸钠>柠檬酸钠>草酸钠。
2.3 铁沉淀产物的表征与分析
2.3.1 EDS元素分析与XRD、FTIR图谱

图 2 溶液 pH值和 Fe2+浓度随细菌培养时间的变化Fig. 2 Changes of solution pH values and Fe2+ concentrations with bacterial cultivation time
依据细菌培养溶液中的Fe2+氧化情况,分别对培养至2、4和7 d后形成的铁沉淀产物进行了表征和分析。低分子有机酸钠盐的加入使细菌培养液中外源引进了大量的Na+。故进一步检测了部分处理SO10、SC20和SM10中细菌培养至4 d时的铁沉淀产物的元素组成,其EDS分析见表2。结果证实这些铁矿物产物主要由Fe、O、S和K元素组成,并未检测到Na元素。在含有500 mmol/L Na+的A.ferrooxidans培养液中, 11周后的铁矿物沉淀产物中几乎未检测到黄钠铁矾(Grampetal., 2008)。这一致表明在A.ferrooxidans培养液中,即使Na+含量远大于K+的含量,但初始矿物相施氏矿依旧优先转化形成黄钾铁矾,而不是黄钠铁矾。
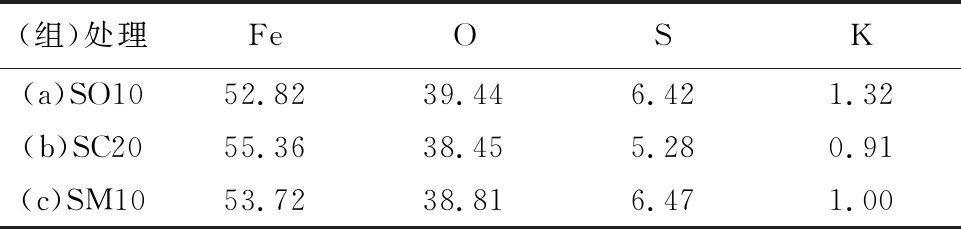
表 2 4 d后获得铁矿物的元素分析 wB/% Table 2 Elemental analysis for iron minerals obtained after 4 d
XRD和FTIR结果分别见图3和图4。参照文献(Liaoetal., 2009; Xuetal., 2014; 张笛等, 2018)中报道的施氏矿(PDF47-1775)和黄钾铁矾(PDF36-0427)的XRD谱线,相关处理中沉淀产物对应的XRD谱线结果见图3。其中,2 d后形成铁沉淀产物的XRD谱线只呈现了施氏矿的主要特征峰, 对应d值为5.09、 3.39、2.55、2.28、1.95、1.66、1.51、1.48。4 d含苹果酸钠的沉淀产物和7 d所有产物的XRD谱线(主要特征峰d值为5.80、5.08、3.63、3.12、2.56、2.27、1.98、1.83)均显示,它们主要为黄钾铁矾矿相;其他XRD谱线存在施氏矿和黄钾铁矾矿的主要特征峰,这表明4 d后其他处理中铁沉淀产物为施氏矿和黄钾铁矾的混合相。
此外,细菌培养介质中形成的2、4和7 d的铁矿物产物的FTIR谱线见图4。细菌培养至2 d时获得铁沉淀的FTIR谱线于693 cm-1处出现O—H…SO4的振动峰,1 122、981和605 cm-1处出现了典型的SO4基团振动峰的吸收峰。与文献(Xieetal., 2017)报道的施氏矿的红外光谱线基本一致。细菌继续培养至第4 d时,除了SO20和SO40处理中铁矿物产物的FTIR谱线与纯施氏矿基本一致外,其余处理产物的FTIR谱线中均存在黄钾铁矾的结构基团对应的吸收峰。7 d铁沉淀的FTIR谱线于1 195和630 cm-1处出现了SO4伸缩振动峰,1 087和1 005 cm-1处出现了黄钾铁矾的SO4吸收峰,在508 cm-1处出现了FeO6正八面体的振动峰,这证实7 d铁矿物产物的主要矿相为黄钾铁矾。

图 3 铁沉淀产物的X射线衍射图Fig. 3 XRD patterns of the iron precipitate products

图 4 铁沉淀产物的红外光谱图Fig. 4 FTIR spectra of the iron precipitate products
2.3.2 FESEM形貌分析
含有机酸钠盐各处理组(即含有草酸钠、柠檬酸钠和苹果酸钠的a、b和c 3组处理)中部分铁矿物的FESEM形貌结构如图5所示。Fe2+氧化趋势与对照处理一致的含有机酸钠盐处理(SO10、SO20、SC20和SM10)形成铁矿物产物的形貌结果显示,除SO20的产物中只有少量黄钾铁矾块状颗粒(直径约0.4~2 μm),主要为施氏矿(呈现为针垫-聚集球颗粒,直径约2.5~5 μm);其余3个处理的铁沉淀产物在第4 d时已观察到大量黄钾铁矾颗粒。SC20处理中形成的施氏矿(直径约0.5~0.8 μm)和黄钾铁矾的颗粒尺寸(约0.4~1.5 μm)明显小于SO10和SM10中形成的铁沉淀物(施氏矿的颗粒直径约1~2 μm;黄钾铁矾颗粒尺寸约1~2.5 μm)。SO10和SM10处理中形成施氏矿的颗粒形貌极为相似,但它们转化形成的黄钾铁矾的颗粒形貌存在明显差异(前者颗粒尺寸不如后者均一,且大量颗粒为不规则菱形状)。

图 5 铁矿物沉淀的动态形貌Fig. 5 Dynamic morphologies for the iron mineral precipitates
此外,观察含草酸钠(a组)细菌培养液SO10、SO20和SO40这3个处理中2、4和7 d产物的形貌变化情况时发现,随着草酸钠浓度的升高,初始铁沉淀产物针垫球状施氏矿(图A2、B2和C2; 图C4)向菱形块状黄钾铁矾(图A4和 B4; 图A7、B7和C7)的转化抑制会明显增强。综合XRD、FTIR和FESEM结果,可证实SO40处理中铁矿物产物的矿相转化明显被抑制,其主要原因可能是Fe2+被完全氧化的时间较该组其他处理延迟了72 h所致。进一步观察了细菌培养至第4 d时含草酸钠组SO4~SO40(插图、A4、B4和C4)和含苹果酸钠处理SM4(插图)和SM10(图E4)形成铁矿物的形貌,也发现菱形块状黄钾铁矾颗粒的转化形成随着外加有机酸钠盐浓度的升高受到抑制。
综上,在含有A.ferrooxidans的反应溶液中,当Fe2+被完全氧化成Fe3+后(48 h后),利于施氏矿向黄钾铁矾相的转化(Nazarietal., 2014)。苹果酸钠较草酸钠(或柠檬酸钠)更能显著促进施氏矿向黄钾铁矾转化。此外,高浓度的有机酸钠盐(SO40和SC20处理)会抑制这两种矿相的转化(Renetal., 2009)或不利于铁矿物的形成(SC40和SM20处理中无铁沉淀产生)。故含细菌培养液中形成的铁矿物产物矿相和形貌结构均会受到外加低分子有机酸钠盐的种类和浓度的影响。
3 结论
(1) 加入低分子有机酸钠盐的浓度较低时对细菌氧化Fe2+的能力作用不明显;其浓度较高时(苹果酸钠、柠檬酸钠和草酸钠依次为20、40和40 mmol/L)则会产生明显的抑制(从大到小的顺序为苹果酸钠>柠檬酸钠>草酸钠)。
(2) 有机酸钠盐浓度较低时,利于针垫类球状施氏矿向菱形黄钾铁矾转化。其中铁沉淀产物在细菌培养初始阶段(2 d内)主要为施氏矿,在细菌培养结束(7 d)后主要为黄钾铁矾;在Fe2+完全被氧化后(2~7 d),铁沉淀产物初始相施氏矿易向黄钾铁矾转化。
(3) 有机酸钠盐浓度较高时,铁沉淀产物主要为施氏矿;此外施氏矿的形成与黄钾铁矾的转化形成均会受到抑制。
(4) 苹果酸钠的加入比草酸钠和柠檬酸钠的加入更易促进黄钾铁矾的转化。
