质粒介导的产NDM-1 肠杆菌科细菌分子水平研究
2021-07-29董世雷张亚培范芳华
王 选 董世雷 张亚培 范芳华 朱 杰
浙江医院医学检验科,浙江杭州 310013
新德里金属β 内酰胺酶(New Delhi metallo-βlactamase,NDM)是2008 年首次发现的一种新型碳青霉烯酶[1]。随后其便以惊人的速度在世界范围内播散流行。目前认为南亚、欧洲以及中东为NDM 最为流行的地区[2]。2011 年浙江省发现首例产NDM-1 鲍曼不动杆菌患者[3],随后NDM 便在细菌中蔓延开来[4-8]。NDM 国内虽多有研究,但菌株大多呈分散分布[9]。关于blaNDM-1基因分子水平研究,目前国内还比较欠缺。本研究拟通过对2015 年1 月—6 月分离的29 株产NDM-1 肠杆菌科细菌进行同源性分析,了解其在该地区的流行情况;通过周围序列分析,阐明该基因所处的周围环境。
1 材料与方法
1.1 菌株来源
29 株产NDM-1 肠杆菌科细菌分离自浙江医院碳青霉烯类抗生素耐药菌株,包括9 株阴沟肠杆菌(Eo),6 株产气肠杆菌(EA),4 株大肠埃希菌(EC),4 株弗劳地枸橼酸杆菌(FC),2 株肺炎克雷伯菌(KP),2 株产酸克雷伯菌(KO)和2 株摩根摩根菌(MM)。本研究经浙江医院医学伦理委员会批准。
1.2 试剂与仪器
Vitek2 compact 全自动细菌鉴定系统和药敏系统(法国梅里埃公司,型号:VITEK®2 COMPACT 30);VITEK MS 质谱仪(法国梅里埃公司,型号:VITEK®MS);哥伦比亚血琼脂平板(郑州贝瑞特生物制品有限公司,批号:0052020);Taq 酶及PCR 相关试剂(日本Takara 公司,批号:R007WZ);质粒抽提试剂盒(美国Axygen 公司,批号:12318KA1);PCR 仪器及紫外成像系统(德国Biometra 公司,型号:Bio-1000F);脉冲场凝胶电泳仪及成像系统及相关试剂(德国Biometra 公司,型号:Biometra-Rotaphor®6.0)。
1.3 菌株鉴定及耐药检测
Vitek2 compact 全自动细菌鉴定系统和药敏系统进行菌株鉴定和药敏试验,VITEK MS 质谱仪对鉴定结果进行确认。
1.4 特异性PCR 扩增和测序
质粒提取试剂盒提取菌株DNA 为模板,分别扩增碳青霉烯酶耐药基因和超广谱β-内酰胺酶(ESBLs)耐药基因,引物参照文献[10-11]。阳性产物测序分析,确定耐药基因类型。
1.5 脉冲场凝胶电泳
采用脉冲场凝胶电泳技术对携带blaNDM-1基因肠杆菌科细菌进行同源性分析。具体操作流程和判定标准参考文献[12]。
1.6 多位点序列分型
对EC、KP 和Eo 进行多位点序列分型。管家基因引物序列及扩增条件参见参考文献[13-15]。PCR 扩增产物进行测序比对,以确定该菌株的多位点序列分型(MLST)型别。
1.7 接合试验
受体菌为利福平耐药大肠埃希菌EC600,供体菌为携带blaNDM-1菌株。接合子用VITEK MS 进行质谱鉴定,PCR 扩增接合子blaNDM-1确认。
1.8 以PCR 为基础的质粒复制子分型(PBRT)
方法为以接合子DNA 为模板,PCR 扩增特异性引物来确定质粒型别。扩增阳性产物进行测序,根据测序结果进行质粒复制子分型。
1.9 目的基因周围序列分析
提取接合子质粒DNA,根据国内携带blaNDM-1质粒pNDM-HN380 的全质粒测序序列(GenBank,JX10476 0.1),设计引物PCR 扩增接合子该基因周围序列(8828 bp)。PCR 阳性结果测序,测序所得DNA 序列进行拼接,绘制开放阅读框架示意图。
2 结果
2.1 耐药基因检测结果
29 株携带blaNDM-1基因菌株中,86.9%(26/29)合并ESBLs 或其他碳青霉烯酶耐药基因。其中,3 株EA,2 株FC,1 株Eo 和1 株KP 同时含有blaNDM-1和blaKPC-2基因;1 株Eo 同时携带blaNDM-1和blaIMP-4基因;1 株KP 同时携带blaNDM-1和blaVIM-1基因。耐药基因检测结果见表1。
2.2 脉冲场凝胶电泳(PFGE)和MLST 分析结果
PFGE 分析发现,6 株EA,5 株Eo,2 株EC 及2 株KO 分别具有同源性,见图1。MLST 发现3 株大肠埃希菌为ST167,5 株阴沟肠杆菌为ST114,见表1。
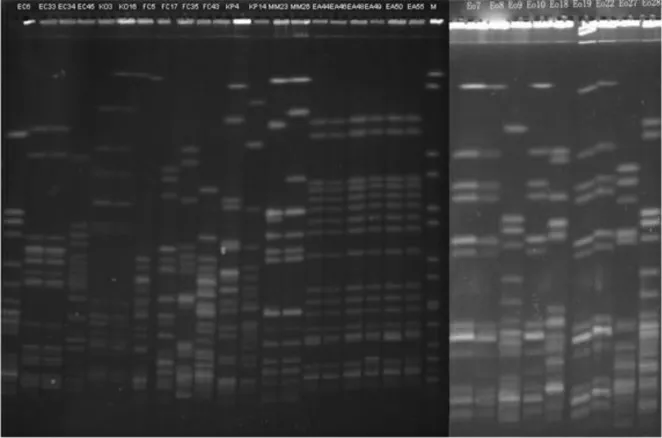
图1 菌株PFGE 示意图
2.3 接合实验与PBRT 质粒分型结果
27 株菌株接合成功,见表1。接合子进行PBRT 质粒分型发现,其中16 株为IncX3 型质粒,7 株为无法区分的型别,2 株为IncN 型质粒,2 株为IncF 型质粒。
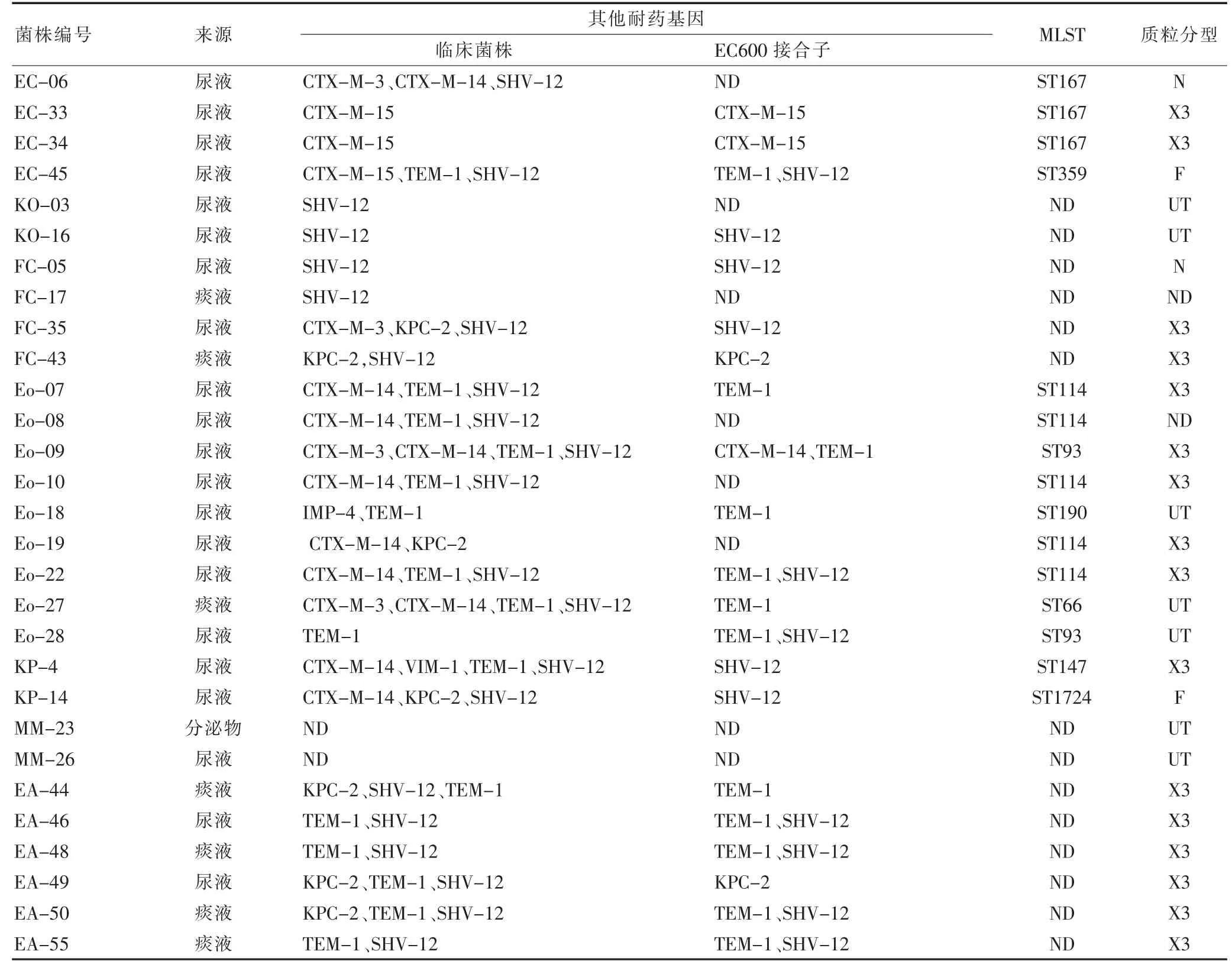
表1 29 株产NDM-1 肠杆菌科细菌及其结合子菌株信息表
2.4 基因周围环境分析
基因周围环境分析见图2。其中菌株KO-03、FC-05、EC-06 和Eo-09 的开放阅读框架同已公开序列的KP 质粒pNDM-HN380(GenBank 登录号JX104760.1)完全一致,基因片段blaNDM-1-bleMBL-trpF 存在于所有已测序成功的16 株菌株中。
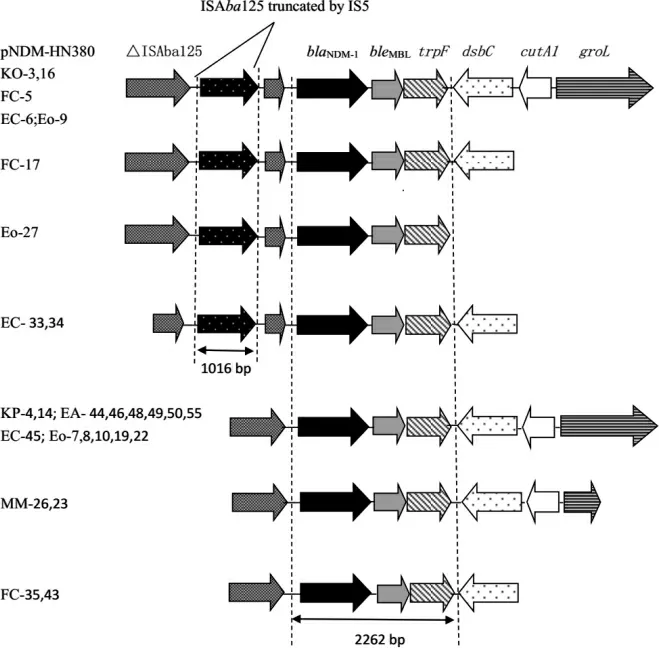
图2 blaNDM-1 基因及其周围环境的开放阅读框架示意图
3 讨论
两种碳青霉烯酶存在于同一菌株中,在国内外极少出现[16-17]。本研究结果显示,9 株菌株携带两种碳青霉烯酶。多种耐药基因的合并存在,给产NDM-1 菌株的治疗带来更大挑战。在国内,极少出现同一克隆株的传播流行现象[18-19]。本研究通过PFGE 分析发现部分菌株具有同源性,提示需加强院内感控,关注多重耐药菌的传播流行现象。质粒是介导blaNDM-1基因传播转移的主要载体。目前世界上可以携带该基因的质粒有IncX3、A/C、L/M、FI/FII、I1 等型别[20-21]。其中,IncX3 型质粒认为是国内介导该基因传播转移的主要载体[22-23]。本研究对接合子进行PBRT 质粒分型发现,59.3%(16/27)的质粒为IncX3 型别,提示IncX3 型质粒同样是介导本地区blaNDM-1基因转移的主要质粒。
本研究对所获菌株blaNDM-1基因周围序列进行测序拼接发现,测序成功菌株中均存在基因片段blaNDM-1-bleMBL-trpF,这与国内报道一致[24-25]。本研究所有该基因上游均存在至少一个插入序列ISAba125。提示与ISAba125 相关的初始动员机制可能是blaNDM-1-bleMBL- trpF 基因获得的原因。但是,trpF 下游区域基因序列
是多样的,这提示浙江省blaNDM-1基因的获得可能有多种来源。
综上所述,本研究从菌株、质粒以及基因3 个水平对NDM-1 的传播方式进行分析发现,多种传播转移方式的共同作用加速了该酶在肠杆菌科细菌中的流行。因此,院内感染控制科迫切需要监测肠杆菌科细菌中的碳青霉烯酶,特别是NDM-1,以控制和预防这类细菌的传播流行。
