湿热处理下富含γ-氨基丁酸芸豆品种的选择及筛选方法的建立
2021-07-28王中磊马玉玲王丽丽刘丽娅周素梅佟立涛
王中磊 马玉玲 王丽丽 刘丽娅 周素梅 佟立涛
(中国农业科学院农产品加工研究所,北京 100193)
γ-氨基丁酸(γ-aminobutyric acid,GABA)是一种四碳非蛋白氨基酸,作为信号传递物质广泛的存在于动植物体中[1]。GABA在人体中不仅作为一种重要的神经递质存在,而且具有抗抑郁、降血压、降血糖、改善睡眠等作用[2-4]。GABA支路和多胺降解途径是植物中GABA合成的两条途径,前者通过GAD催化游离谷氨酸(glutamate,Glu)脱羧合成GABA,后者通过二胺氧化酶(diamine oxidase,DAO)、多胺氧化酶(polyamine oxidase,PAO)分别催化二胺(putrescine,Put),亚精胺(spermidine,Spd)和精胺(spermine,Spm)后再经脱氢生成GABA[5,6]。
随着人体年龄增长,自身合成GABA的能力下降,且植物组织中GABA含量仅为0.03~2.00 μmol/g (DW),无法通过正常的饮食满足机体需求[7]。近年来,有研究利用糙米、大豆、鹰嘴豆、蚕豆等谷物通过发芽、发酵等方式进行GABA富集[8-11],但该途径耗时长、成本高、破坏了籽粒完整性,不利于多种形式产品的开发。本课题组前期研究发现,湿热处理可高效提升食用豆中GABA含量,且所需设备简单、成本低廉、能较好保持籽粒的完整性。
芸豆,学名菜豆(Phaseolusvulgaris),营养丰富,具有提高免疫力、降血糖、抗氧化等多种功能作用[12]。我国芸豆种植面积广阔,资源丰厚,但加工精度较浅,利用程度较低,常以原粮形式流入市场。韩晶[13]分析了3个不同品种芸豆的氨基酸组成,发现谷氨酸含量最高,约占芸豆干质量的2.81%~4.58%;梁珊等[14]也发现5个不同品种芸豆中谷氨酸含量最高,占总氨基酸的9.5%~11.39%。而谷氨酸是合成GABA的重要前体物质,因此芸豆具有较高的GABA富集潜力。目前,芸豆GABA富集的研究相对较少,且主要利用发芽、发酵等方式[15-17]。研究发现番茄[18]、蚕豆[9]等植物品种不同,GABA富集能力也有所不同,但关于芸豆品种对GABA富集能力影响的研究鲜见报道。
本研究以芸豆为供试材料,经湿热处理筛选出富含GABA的芸豆品种。通过GABA、底物、酶之间的相关性分析及线性回归揭示芸豆GABA富集能力与品种间差异性的关系,从而建立高GABA富集能力芸豆品种的筛选方法,为开发新型芸豆健康食品、提高芸豆附加值提供参考。

图1 芸豆图片
1 材料与方法
1.1 材料
18种芸豆信息如图1、表1。Y1~Y15由国家现代农业产业技术体系食用豆体系提供,其余为市售,保存于4 ℃备用。分别采用旋风磨和冷冻研磨仪制备全粉,保存于-20 ℃。
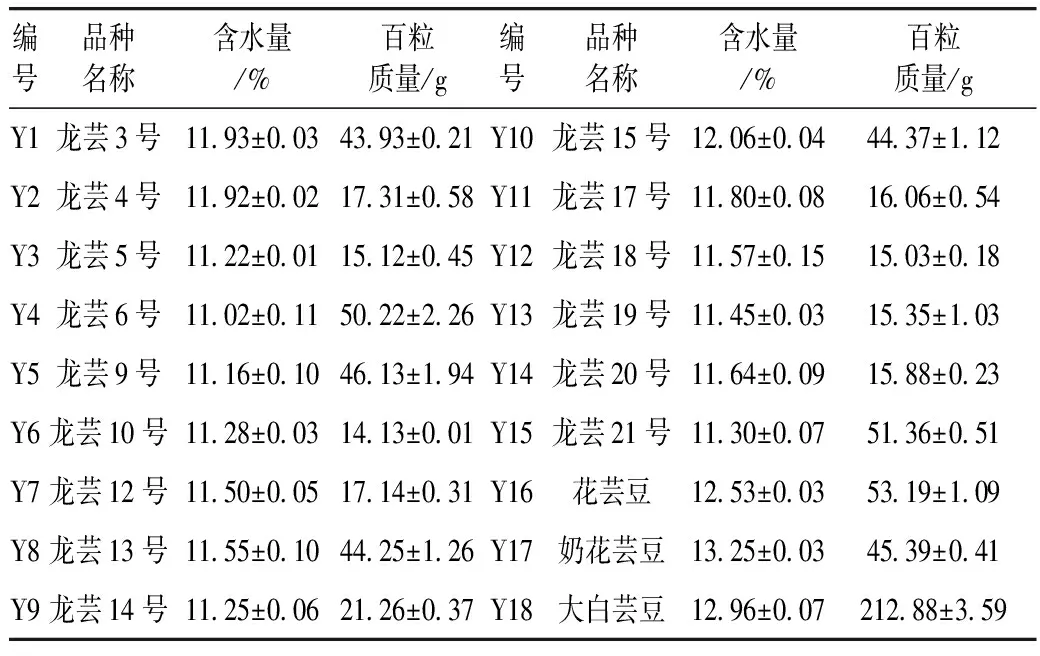
表1 芸豆品种名称与特性
1.2 仪器与设备
GABA、腐胺、亚精胺、精胺为色谱纯试剂;丹磺酰氯;4-氨基安替比林;N-N二甲基苯胺;辣根过氧化物酶;碳酸氢钠、盐酸为常规分析用试剂。
Agilent 1260高效液相色谱仪(Agilent 1260 VWD检测器),SP-Max 2300A光吸收型全波长酶标仪;TGL-16台式高速冷冻离心机,Kieltec Analysister全自动凯式定氮仪,MM400冷冻混合型研磨仪。
1.3 方法
1.3.1 湿热处理条件
参照GB 5009.3—2016测定芸豆原籽粒含水量,定量着水调节芸豆含水量为30%,密封后置于室温下并混匀以保证均匀吸水。待芸豆吸水完全后,将该密封容器置于60 ℃烘箱中热处理5 h。处理结束后迅速置于液氮冷冻终止反应,冻干磨粉后测定GABA含量。
1.3.2 指标测定方法1.3.2.1 GABA含量的测定
采用HPLC测定GABA含量。按1∶10向样品中加入体积分数为70%的乙醇溶液,室温振荡提取1 h后10 000 g冷冻离心10 min,取上清。重复操作3次,收集上清液并定容。避光条件下,反应体系含上清液1 mL,0.04 g/mL NaHCO3溶液0.2 mL、2 mg/mL丹磺酰氯乙腈溶液0.4 mL,振荡混匀后置于70 ℃水浴20 min,冷却至室温,过0.22 mL滤膜供试。色谱条件:ZORBAX SB-C18色谱柱(4.6 mm×250 mm,5 μm),等度洗脱,流动相组成及比例为A(30 mmol/L乙酸钠)∶B(乙腈)=73∶27,流速1 mL/min,柱温箱温度30 ℃,检测波长436 nm。GABA质量浓度C(μg/mL)与峰面积A之间线性回归方程为y=69.618x-36.977(R2=0.999 4)。
1.3.2.2 粗蛋白、可溶性蛋白含量的测定
粗蛋白含量测定参照GB/T 5009.5—2003;可溶性蛋白含量测定采用考马斯亮蓝法。
1.3.2.3 GAD活性测定
GAD提取与活性测定参考Bai等[19]并做修改。GAD粗酶提取:向冷冻研磨的芸豆粉中按1∶5加入预冷磷酸钾缓冲溶液(pH 5.8、0.1 mol/L,含2 mmol/L β-巯基乙醇,2 mmol/L EDTA、0.2 mmol/L PLP),涡旋振荡后置于冰水浴中提取1.5 h。10 000 g冷冻离心20 min,上清液即为GAD粗酶溶液。GAD酶测定:反应体系含0.5 mL GAD粗酶液,0.2 mL底物溶液(含10 g/L Glu)。混合液置于40 ℃水浴2 h,90 ℃热水终止反应。按方法1.3.2.1测定GABA含量。以每克芸豆在40 ℃下每小时生成1 mg GABA(由添加的Glu生成)定义为1个酶活力单位。
1.3.2.4 生物胺含量测定
采用HPLC测定游离生物胺含量,测定方法参考Flores等[20]。Put、Spd、Spm质量浓度C(μg/mL)与峰面积A之间线性回归方程分别为y=77.483x-6.235 3(R2=0.998 7)、y=54.441x-10.662(R2=0.999 3)、y=41.144x-12.598(R2=0.999 2)。
1.3.2.5 DAO、PAO活性测定
DAO、PAO提取与测定方法分别参考穆文静[21]、汪天等[22],并修改。粗酶提取:按1∶10向冷冻研磨芸豆粉中添加预冷磷酸钠缓冲液(70 mmol/L、pH 6.5),混匀后冰水浴提取1.5 h,10 000 g冷冻离心20 min,上清液即为DAO、PAO粗酶混合液。活性测定:反应体系含酶粗提液200 μL、辣根过氧化物酶10 μL、显色液(每100 mL磷酸钠缓冲液中含有10 mg 4-氨基安替比林,25 μL N-N二甲基苯胺)20 μL。混合液置于30 ℃水浴锅中5 min,加入10 μL 反应启动液(DAO活性测定启动液为50 mmol/L put,PAO活性测定启动液为20 mmol/L Spd、Spm混合液),用酶标仪立即于555 nm下测定吸光度,30 ℃水浴30 min后二次测定吸光度。以每克芸豆每分钟吸光值变化0.01计为1个酶活力单位(U)。
1.4 数据处理
实验结果以平均值±标准差的形式表示。变异系数=标准偏差/平均值×100%。实验数据整理及显著性分析(P<0.05为显著性差异)分别采用Excel 2010、SPSS 25.0,作图采用Origin 2018、R 3.6.3。
2 结果与讨论
2.1 湿热处理下富含GABA的芸豆品种选择
植物中GAD含有CaM结合区,Ca2+浓度影响GAD活性。植物受到外界热刺激时,细胞液中Ca2+浓度升高,从而激活GAD活性,促进植物组织中GABA的合成[23]。湿热处理前后芸豆中GABA含量见图2,处理前芸豆中GABA含量很低,在2.83~8.16 mg/100 g之间。经过湿热处理后,芸豆中GABA含量均显著上升,在68.64~131.55 mg/100 g之间,其中Y18、Y7、Y11 GABA含量均大于120 mg/100 g,可作为富含GABA的芸豆品种。Kim等[24]发现米糠含水量30%时,于40 ℃下储藏12 h后GABA含量最高,含水量与本实验一致,可能是30%的含水量有利于激活GAD,促进Glu向GABA的转化。
Li等[11]对10个不同品种蚕豆发芽处理,发现蚕豆品种不同,发芽后GABA积累量最大相差25倍。由图2知芸豆品种不同,经湿热处理后GABA积累量差异显著,其变异系数为19.1%。其中Y18 GABA积累量最高,为128.13 mg/100 g,是GABA积累量最低者Y5的2.01倍。说明芸豆品种不同,其GABA富集能力存在差异性,这可能与参与GABA合成的底物、酶的不同有关。
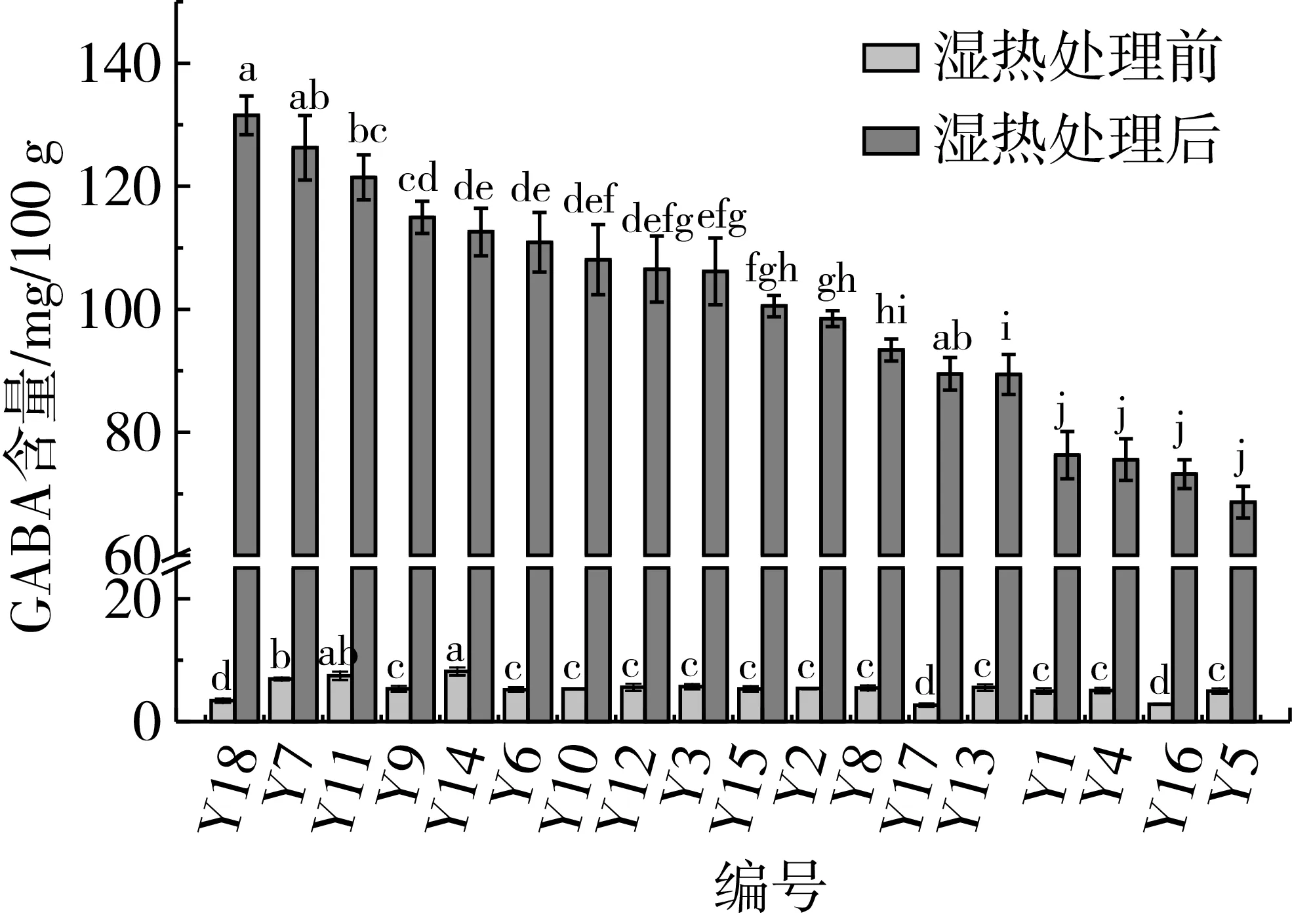
注:不同字母表示差异显著(P<0.05)。图2 湿热处理前、后芸豆中GABA含量
2.2 与GABA合成相关底物含量、酶活性
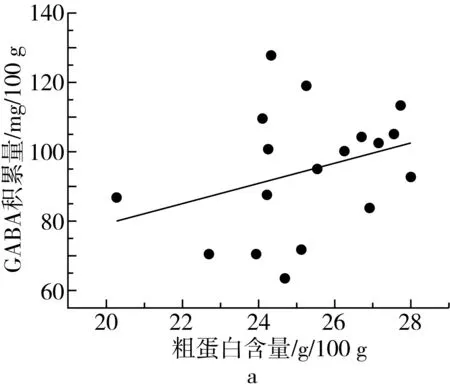
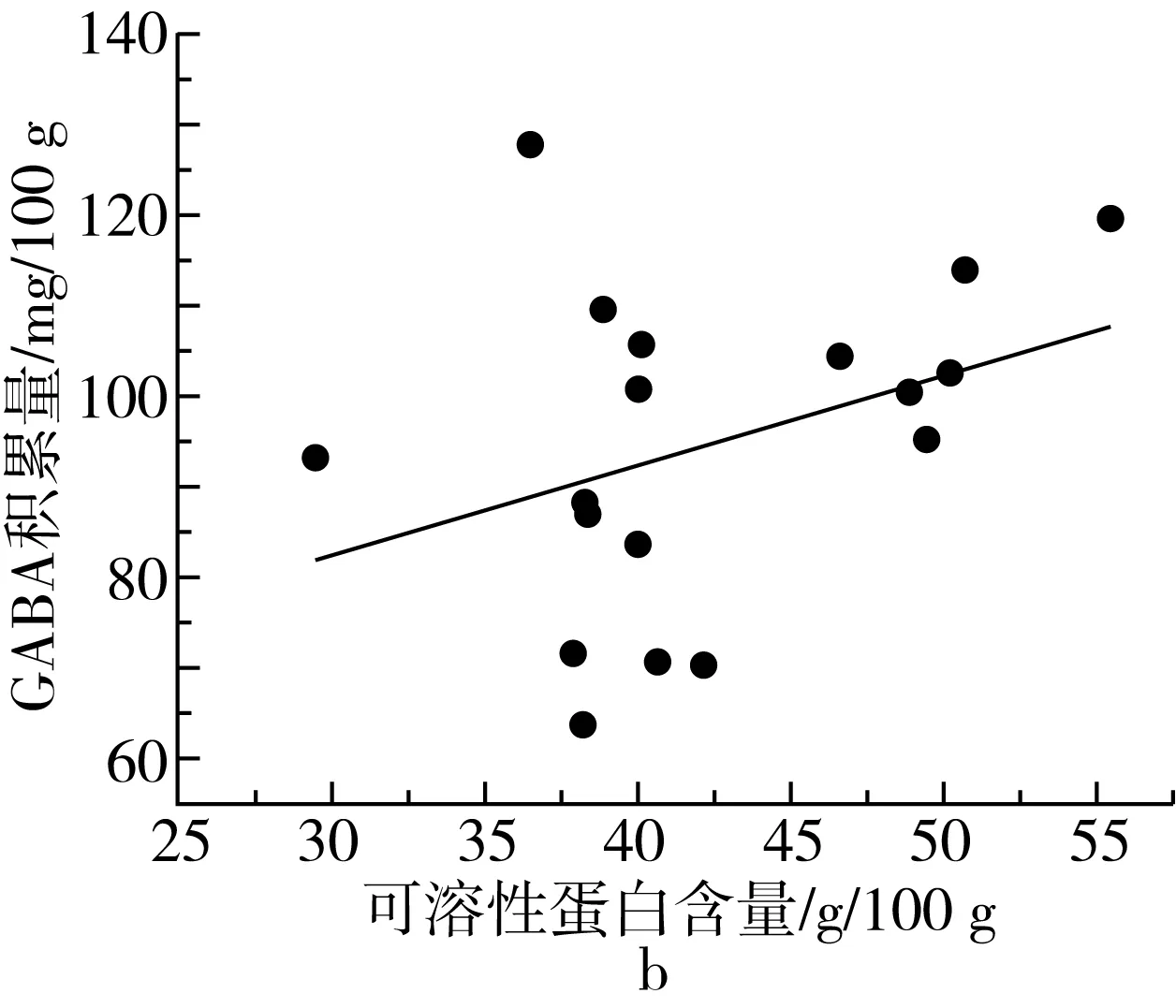
研究发现,糙米、大豆发芽时,GABA的积累量与可溶性蛋白含量呈显著正相关,可能是在蛋白酶的作用下,蛋白质被分解成了游离氨基酸,进而提高了GABA的含量[25,26]。由表2可知,芸豆中蛋白质含量丰富,粗蛋白含量在20.32~28.02 g/100 g之间,品种间差异不大,变异系数为7.8%。芸豆中可溶性蛋白含量在29.48~55.42 mg/g之间,与王何柱等[27]的报道结果一致。
GAD是GABA支路的关键性限速酶[28]。芸豆品种不同,GAD活性具有显著差异性,变异系数达41.3%。其中Y10的GAD活性最高,是活性最低者Y4的4.86倍。

表2 GABA支路相关底物含量、酶活性测定结果
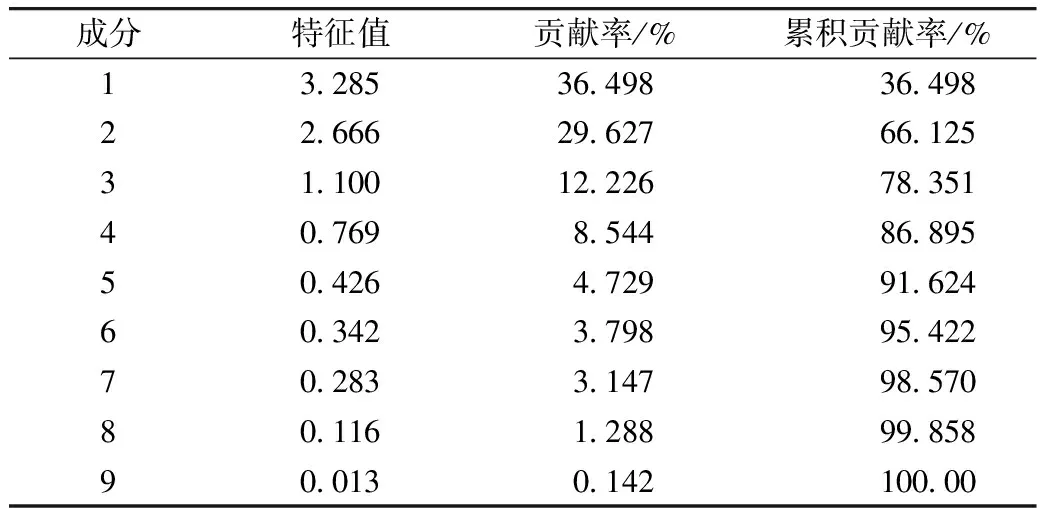
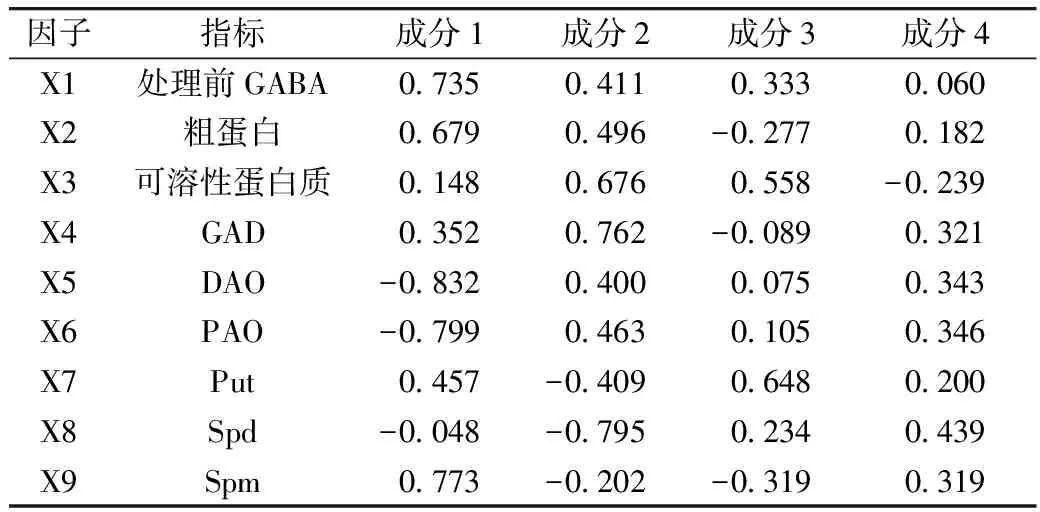
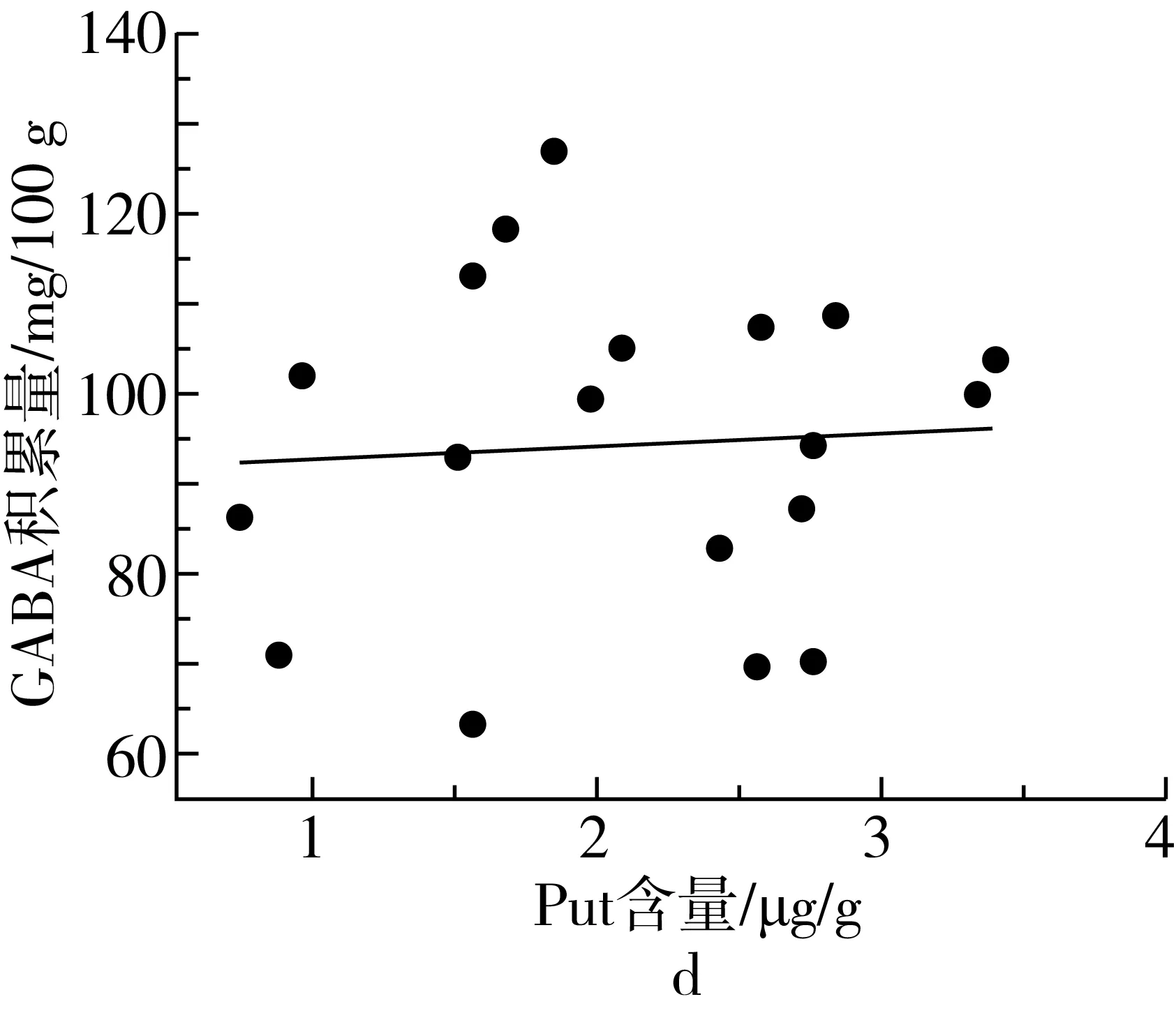
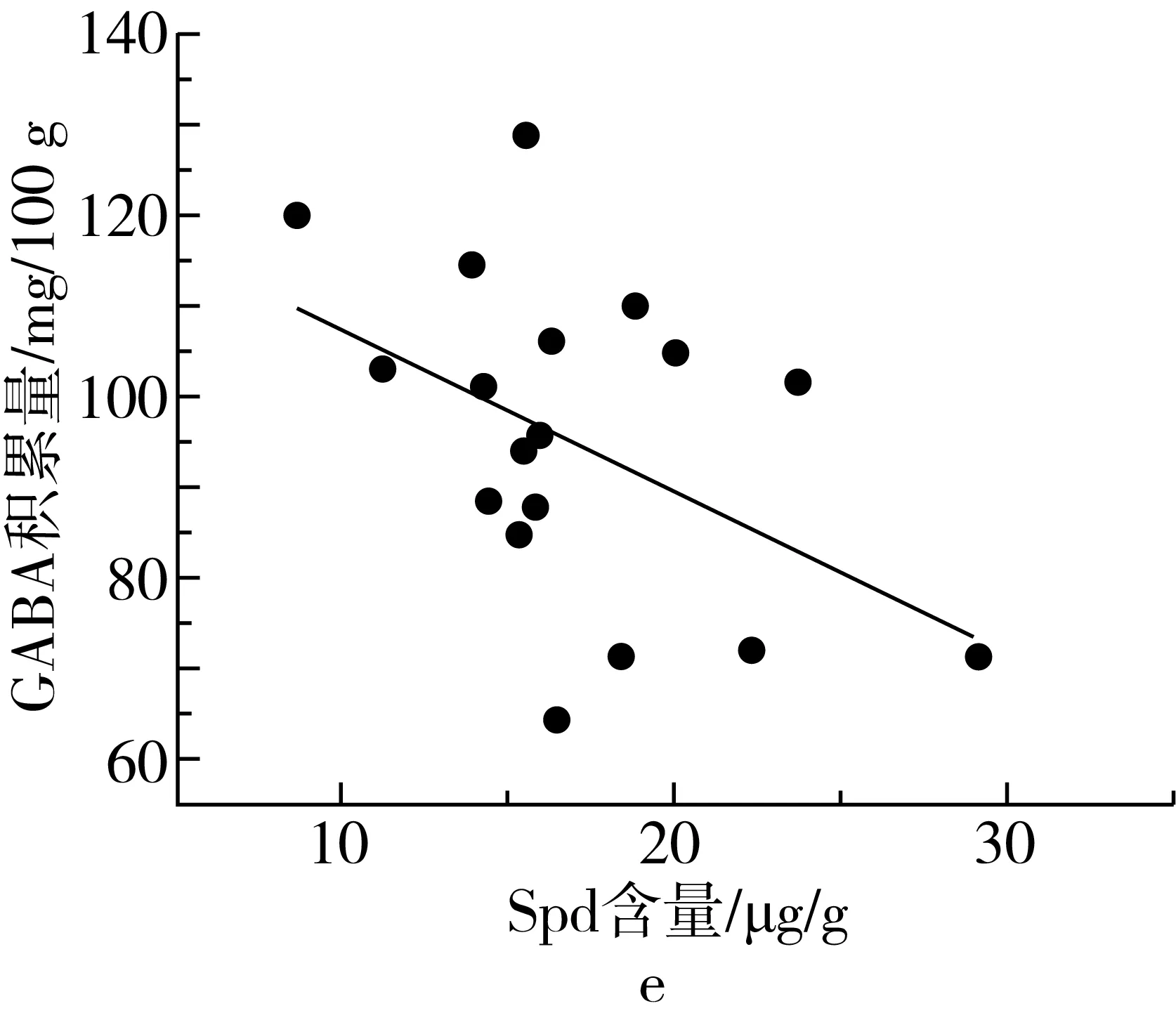
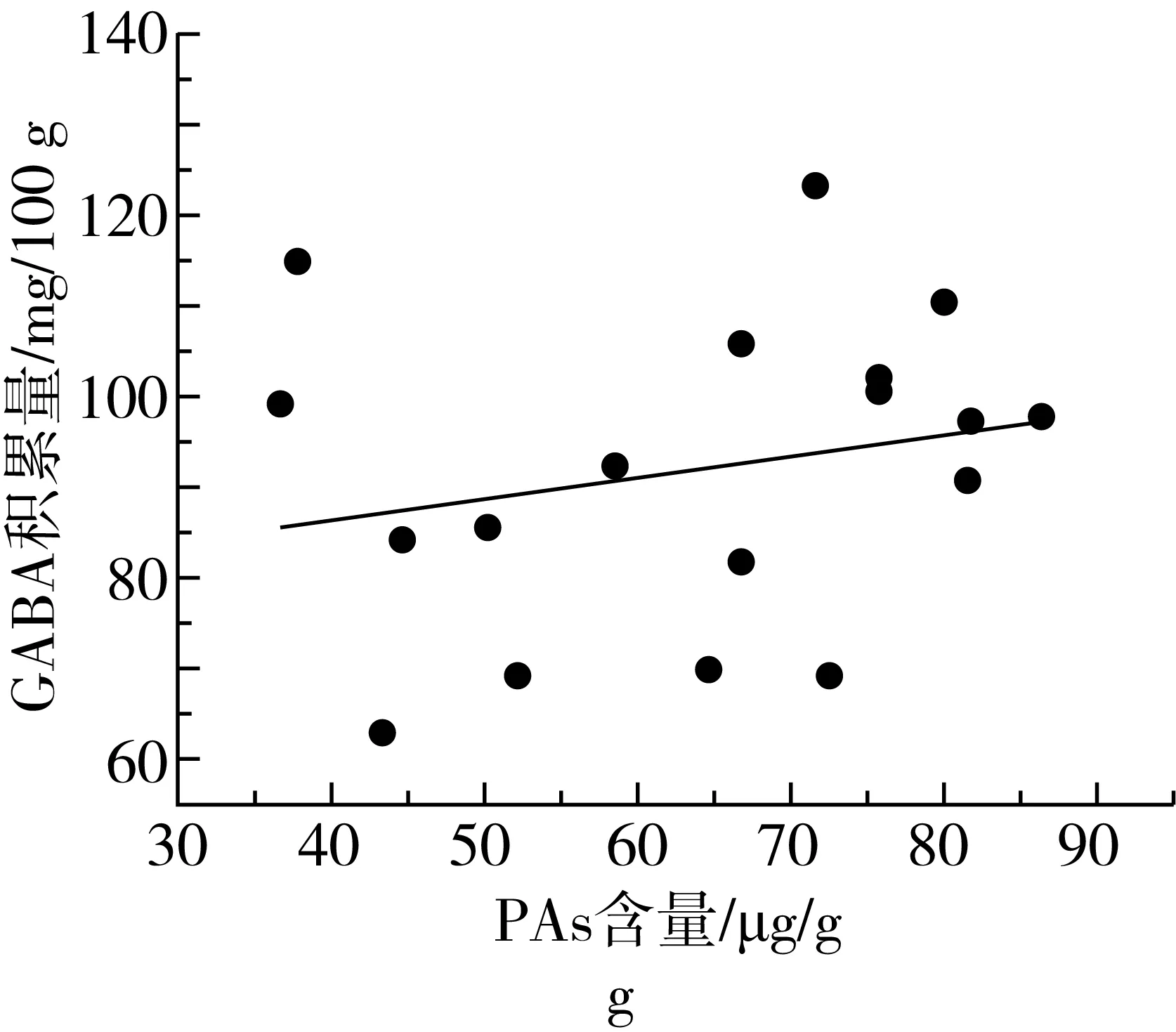
植物中通常含有尸胺(Cadaverine,Cad)、Put、Spd、Spm四种生物胺[29]。其中Put、Spd、Spm三类生物胺可在受试芸豆中检测到,在多胺代谢途径中作为底物参与GABA的合成。由表3可知,芸豆中生物胺含量很低,PAs含量最高为86.51 μg/g。18种芸豆生物胺含量整体呈现以下趋势:Put 表3 多胺降解途径相关底物含量、酶活性测定结果 DAO是多胺降解途径中的关键性限速酶。由表3可知,芸豆品种不同,芸豆中DAO、PAO活性差异很大,变异系数分别为99.5%、77.6%。其中Y10 DAO、PAO活性均为最高,分别为10.42、8.27 U,而Y6中未检测到DAO活性。 作物育种时常采用主成分分析对相关特征性状综合评价,通过主成分得分和综合得分筛选符合育种要求的优质品种。对芸豆中与GABA合成相关的底物、酶及处理前芸豆中GABA含量作主成分分析,预测芸豆GABA富集能力。首先,通过KMO与Bartlett检验判断数据是否满足主成分分析的前提条件。结果显示,KMO值为0.582>0.5,且Bartlett显著性为0.000<0.05,说明各因子之间存在线性相关,适合做主成分分析[30]。根据主成分提取的一般原则及碎石图(文中未列出),发现成分数目为4时,可解释总变异的86.895%(表4),此时几乎对所有的特征指标进行了囊括。 表4 主成分方差解释表 表5为主成分载荷值,结合主成分特征值,可得主成分系数,即主成分表达式。其中,各主成分表达式分别为:Z1=0.41×X1+0.37×X2+0.08×X3+0.19×X4-0.46×X5-0.44×X6+0.25×X7-0.03×X8+0.43×X9;Z2=0.25×X1+0.30×X2+0.41×X3+0.47×X4+0.24×X5+0.28×X6-0.25×X7-0.49×X8-0.12×X9;Z3=0.32×X1-0.26×X2+0.53×X3-0.08×X4+0.07×X5+0.10×X6+0.62×X7+0.22×X8-0.30×X9;Z4=0.07×X1+0.21×X2-0.27×X3+0.37×X4+0.39×X5+0.39×X6+0.23×X7+0.50×X8+0.36×X9。对原始数据标准化处理并带入主成分表达式中,得各品种主成分得分。综合得分表达式为:Z=(3.285×Z1+2.666×Z2+1.1×Z3+0.769×Z4)/(3.285+2.666+1.1+0.769)。经计算,Y14、Y11、Y7三个品种的综合表现最好,这与湿热处理后芸豆中GABA含量的测试结果基本一致,说明主成分分析法可作为预测芸豆GABA富集能力的参考方法。 表5 主成分载荷值表 由图3a、图3b及图4可知,芸豆中粗蛋白含量、可溶性蛋白质含量与GABA积累量呈正相关,相关系数分别为0.31、0.36,但均无显著相关性(P>0.05)。由图3c与图4可知,湿热处理后芸豆中GABA积累量随芸豆GAD活性的增大而增加,芸豆GAD活性与GABA积累量呈极显著正相关(P<0.01),相关系数为0.8。由此表明,湿热处理下GABA支路相关底物与酶对芸豆中GABA的合成具有促进作用。 由图3d~图3i及图4可知芸豆湿热处理下GABA积累量与Put含量、PAs含量、PAO活性、DAO活性均无相关性,相关系数小于0.3,但与Spm含量、Spd含量分别呈现正相关、负相关,且与Spd含量呈显著负相关(P<0.05),相关系数-0.47。这表明,湿热处理下多胺降解途径相关底物与酶未促进芸豆中GABA的合成。 植物GABA富集过程中,GABA支路作为主要贡献途径参与GABA合成与代谢[31,32]。通过分析可知,GABA支路是芸豆湿热处理下合成GABA的最主要途径,且GAD作为GABA支路的关键性限速酶对于GABA的合成起着至关重要的作用。因此,可将芸豆GAD活性作为湿热处理下高GABA富集能力芸豆品种的筛选指标。然而,湿热处理下芸豆GABA富集的机制尚未完全明确,需要对湿热处理前、后及过程中参与反应的各组分的动态变化进行监测,这可作为未来研究的重点。 图3 GABA合成相关底物、酶与GABA积累量的散点图 注:图中红色圆圈表示相关系数为正,蓝色圆圈表示相关系数为负,圈中数字为相关系数。GABA-1为湿热处理前GABA含量;GABA-2为湿热处理后GABA含量;GABA为湿热处理下GABA积累量;Soluble Pro为可溶性蛋白质含量;Pro为粗蛋白含量。图4 GABA合成相关底物、酶与湿热处理下GABA积累量的相关性分析热图 线性回归是确定2种或2种以上变量之间依赖关系的数理统计方法。将湿热处理后芸豆GABA含量作为因变量(Y),与GABA合成相关的底物与酶作为自变量(X),对其拟合线性回归模型。首先进行D-W检验和方差分析,结果显示D-W值为2.046,P=0.014<0.05,说明数据间相互独立、符合线性回归独立性的条件,由此构建的回归模型具有统计学意义[30]。 多元线性回归方程为Y=1.18×X1-4.638×X2+0.829×X3+18.789×X4+3.684×X5-5.448×X6-3.1×X7-5.325×X8-3.751×X9+4.359×X10+135.403(式中X1~X9分别为处理前芸豆中GABA含量、粗蛋白含量、可溶性蛋白质含量、GAD活性、DAO活性、PAO活性、Put含量、Spd含量、Spm含量、PAs总量)。模型构建时,X4的标准化回归系数值最大且P<0.05,说明GAD活性对湿热处理后芸豆中GABA含量影响最大,这与相关性分析所得结果一致。该模型R2=0.74<0.8,未能达到预测型模型要求,但可作为解释型模型对数据进行解释[30]。同时,说明可能存在其他因变量未被纳入分析,如游离氨基酸的含量、谷氨酸的含量等。 培育优质的种质资源是获得高效目标产物的重要手段。目前,已通过重组菌株、转基因技术等方式使GAD过量表达,从而提高发酵液或植物中GABA的含量[33,34]。研究发现,芸豆中GAD活性是影响湿热处理下GABA积累量的重要因素,该结论可提供新的育种思路,即定向改变芸豆中有关GAD表达的基因,提高芸豆中GAD表达能力,培育出高GABA富集能力的芸豆品种。 通过热刺激的方式,湿热处理可在短时间内促进GABA的大量合成,提升了芸豆的营养品质,为开发富含GABA的食品提供了良好的原料来源。湿热处理下,芸豆中GABA积累量与原籽粒中GABA支路相关底物含量与酶活呈正相关,而与多胺降解途径相关底物含量与酶活无关或呈负相关,说明GABA支路作为主要代谢途径参与了GABA的积累。其中GAD活性与GABA积累量呈极显著正相关(P<0.01),通过线性回归模型的构建发现GAD是合成GABA的关键性限速酶,因此可通过测定芸豆中GAD活性筛选高GABA富集能力的芸豆品种。
2.3 主成分分析法筛选高GABA富集能力的芸豆品种
2.4 GABA合成相关底物、酶与湿热处理下芸豆GABA积累量之间的相关性分析





2.5 湿热处理后芸豆中GABA含量的线性回归模型
3 结论
