甲基化转移酶样蛋白3在急性心肌梗死患者外周血中的表达及对缺氧缺血所致心肌细胞损伤的调节作用▲
2021-07-28白峰华董小莉
周 钰 白峰华 张 君 詹 峰 董小莉 吴 奎
(海南省人民医院1 入院服务中心,2 科教处,3 急诊ICU病房,4 心血管内科,海口市 570311,电子邮箱:zho38763@163.com;5 海南医学院基础医学与生命科学学院,海口市 571199)
心肌梗死是全球人类死亡的主要原因之一。急性心肌梗死的特点是冠状动脉突发性缺血缺氧,引起心肌细胞凋亡、坏死,从而导致不可逆的心肌组织损伤[1-2]。尽管已有研究报告了多种信号通路参与心肌细胞凋亡,包括活性氧、蛋白激酶C、丝裂原活化蛋白激酶和核因子κB信号通路等[3-5],但心肌梗死以及其他与缺氧缺血相关的急性心脏疾病的分子机制仍不完全清楚。
N6-甲基腺苷(N6-methyladenosine,m6A)修饰是真核mRNA中最普遍的内部修饰[6]。尽管m6A修饰存在于成千上万个具有独特分布模式的RNA转录物[7],但其在大多数RNA修饰中的功能仍然未知。在哺乳动物细胞中,m6A的修饰可被甲基化转移酶样蛋白(methyltransferase-like protein,METTL)3和METTL14等甲基转移酶复合物催化[8]。而且METTL3在哺乳动物中发挥着多种生物学功能,例如调节胚胎干细胞分化、转录剪接、控制蛋白质翻译等[9-11]。研究表明,METTL3可调节缺血再灌注小鼠心肌细胞的自噬和凋亡[12],但其对急性缺血缺氧的人心肌细胞损伤的调节效果仍不清楚。本研究探讨m6A-METTL3在心肌梗死患者体内的表达情况,以及对缺氧/缺血(hypoxia/ischemia,HI)心肌细胞凋亡和自噬的影响,并分析METTL3在急性心肌损伤中的作用。
1 材料与方法
1.1 临床资料 收集2017年1月至2019年12月于我院诊治的60例急性心肌梗死患者(心肌梗死组)的外周血样本。心肌梗死组的纳入标准:(1)符合《急性心肌梗死诊断和治疗指南》[13]的诊断标准;(2)患者发病后5 h内入院。心肌梗死组的排除标准:(1)肝、肾功能障碍者;(2)近6个月有手术史及重大创伤史者;(3)瓣膜性疾病、急性脑血管疾病患者;(4)自身免疫性疾病、血液系统疾病患者;(5)合并其他可能影响本研究结果的疾病者。心肌梗死组中男性35例、女性25例,年龄35~77(53.93±3.69)岁。另从我院体检中心收集同期60例健康体检者(健康对照组)的外周血。健康对照组的纳入标准:未患明显疾病(如特异性感染、骨骼疾病、肿瘤、心脏疾病等疾病)的健康成年人。健康对照组的排除标准:肥胖、残疾、精神疾病、肿瘤、结核病以及患其他系统疾病者。健康对照组中男性36例、女性24例,年龄32~79(52.91±3.82)岁,两组研究对象的年龄和性别比例差异均无统计学意义(均P>0.05)。本研究经我院医学伦理委员会批准,并获得所有患者和体检者的知情同意。
1.2 血液标本的采集和处理 收集心肌梗死患者入院4 h内的血液标本4 mL,及健康对照组体检抽血后4 h内的余血标本4 mL。使用抗凝管(肝素抗凝)获得血浆,然后以3 000 r/min的速度离心15 min,获取血清。血清和血浆分别置于1.5 mL的EP管中,保存于-20℃环境中待检。
1.3 试剂与耗材 TRIzol试剂盒购于美国英杰公司(批号:15596-026);PrimeScriptTMRT Master Mix和LipofecamineTM2000试剂盒购于德国Eurofins MWG Operon公司(批号:PKD446、200917003);人心肌细胞AC16购于通派(上海)生物科技有限公司并经专业认证资源鉴定通过。SYBR qPCR Mix和细胞计数试剂8(cell counting kit-8,CCK-8)均购于日本TaKaRa公司(批号:201719001);磷酸酶检测试剂盒购于中国建城生物工程公司(批号:06104008A)。二辛可宁酸试剂盒购于美国Thermo Fisher Scientific公司(批号:02093011X)。聚偏二氟乙烯膜购于美国Millipore公司(批号:15630002)。METTL3酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒购于上海江莱生物科技有限公司(批号:201651002)。溶酶体抑制剂巴佛洛霉素A1(批号:ab120497)、兔抗人METTL3(批号:ab195352)、激活型天冬氨酸特异性半胱氨酸蛋白酶(cleaved cysteinyl aspartate specific proteinase,cleaved-Caspase3;批号:ab32042)、B细胞淋巴瘤-2(B-cell lymphoma-2,Bcl-2;批号:ab182858)、Bcl-2相关X蛋白(Bcl-2-associated X protein,Bax;批号:ab32503)、微管相关蛋白1轻链3B-Ⅱ(microtubule-associated protein 1 light chain 3B-Ⅱ,LC3B-Ⅱ;批号:ab232940)、自噬通量减少的标志物人死骨片1(sequestosome 1,SQSTM1;批号:ab109012)的第一抗体和第二抗体(批号:ab150077)均购于美国Abcam公司。小干扰RNA(small interfering RNA,siRNA)的构建和合成均由上海吉玛公司完成。
1.4 细胞培养和HI细胞模型的构建和处理 将AC16细胞在37℃和5% CO2的条件下培养于含5%胎牛血清和青霉素-链霉素(100 μg/mL)的杜氏改良伊格尔培养基(Dulbecco′s modified Eagle medium,DMEM)中,24 h换液一次,48~36 h传代一次。将传代后的对数期AC16细胞分为5组,包括对照组、HI-2h组、HI-4h组、siMETTL3+HI-2h组、siNC+HI-2h组。对照组AC16细胞不进行任何处理。HI-2h组、HI-4h组AC16细胞分别进行2 h和4 h的低血清(1%胎牛血清)和低氧(1% O2、5% CO2、94% N2)的HI处理。siMETTL3+HI-2h组AC16细胞在经siMETTL3(有效沉默METTL3的siRNA序列)转染24 h后进一步行HI处理2 h。siNC+HI-2h组AC16细胞在siNC(siMETTL3的阴性对照序列)转染24 h后进一步行HI处理2 h。在检测AC16细胞自噬通量蛋白的实验中,将终浓度为50 nmol/L的溶酶体抑制剂巴佛洛霉素A1添加到DMEM中,其余处理方式不变,检测自噬标记蛋白水平。
1.5 荧光定量PCR检测血浆METTL3 mRNA相对表达水平 使用TRIzol试剂盒提取两组研究对象血浆中的总RNA,并使用紫外分光光度计检测RNA的浓度。根据PrimeScriptTMRT Master Mix试剂盒的操作说明,在以下反应条件下合成cDNA:40℃持续6 min,65℃持续25 min。将cDNA产物储存在-80℃冰箱中,用于定量PCR。反应体系为20 μL:2 μL cDNA产物,0.4 μL 50×ROX,10 μL SYBR qPCR Mix,0.8 μL上游引物和0.8 μL下游引物,补充RNase水至20 μL。反应条件:首先在95℃下预变性1 min,随后进行以下反应:95℃下变性30 s,60℃退火40 s,总共40个循环。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,每个实验设置3个复孔,并将所有样品重复3次。采用2-ΔΔCt计算METTL3 mRNA的相对表达水平。所有操作均在冰上进行。引物序列见表1。
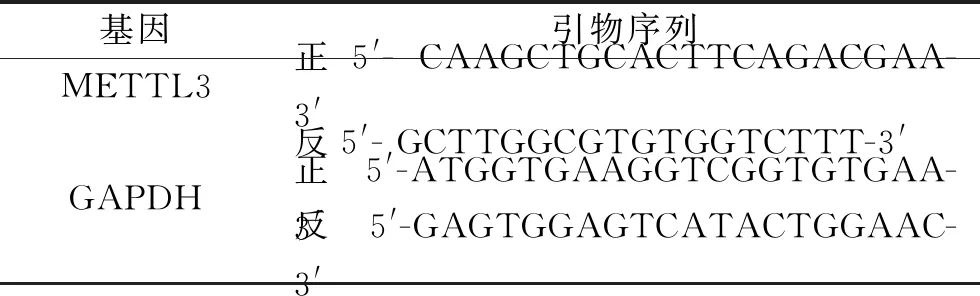
表1 引物序列
1.6 ELISA法检测血清METTL3表达水平 使用ELISA法检测两组研究对象外周血清METTL3表达水平,操作方法严格按照剂盒说明书进行。
1.7 CCK-8法测定AC16细胞增殖率 取1.4中分组处理后的AC16细胞,将其以每孔1×103个的密度重新接种到96孔板中,使用含5%胎牛血清和青霉素-链霉素(100 μg/mL)的DMEM在37℃和5% CO2的条件下培养0、12、24、48 h。将CCK-8试剂以10%的最终浓度添加到每个孔中,避光孵育1 h。采用酶标仪检测450 nm波长处的吸光度值。细胞增殖率=(观察组吸光度值-空白管吸光度值)/(阴性对照组吸光度值-空白管吸光度值)×100%。
1.8 流式细胞仪检测AC16细胞凋亡率 取1.4中分组处理后的AC16细胞,用预冷的磷酸缓冲盐溶液洗涤两次,5 min/次,并使用1 mL流式缓冲溶液重悬细胞使细胞密度为1×106/mL。将100 μL细胞悬液添加到5 mL流量管中,随后添加10 μL膜联蛋白V-异硫氰酸荧光素染色和10 μL碘化丙锭染色,避光、室温下孵育15 min。采用流式细胞仪(美国安捷伦生物科技有限公司)检测细胞凋亡率。
1.9 免疫印迹法检测蛋白表达水平 取1.4中分组处理后的AC16细胞,加入200 μL M-PERTM裂解液(美国赛默飞公司,批号:78503),冰上裂解30 min,1 500 r/min离心10 min取上清。根据二辛可宁酸法测定蛋白的浓度。在变性条件下,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离20 μg总蛋白,并将其转移至聚偏二氟乙烯膜。将膜封闭在5%脱脂牛奶中,随后给予抗METTL3(1 ∶600)、cleaved-Caspase3(1 ∶800)、Bax(1 ∶700)、Bcl-2(1 ∶400)、LC3B-Ⅱ(1 ∶600)、SQSTM1(1 ∶500)、GAPDH(1 ∶5 000)的一抗4℃孵育过夜,并使用Tris缓冲盐溶液和Tween 20洗涤膜。随后将膜与二抗(1 ∶2 000)在室温下孵育2 h,并用Tween 20洗涤。通过使用增强的电化学发光试剂可以观察到蛋白条带。以GAPDH为内参蛋白,使用Image J软件分析条带的灰度。
1.10 统计学分析 使用GraphPad Prism软件(5.0版)进行统计学分析。计量资料以(x±s)表示。多组间的比较采用方差分析,其中两两比较使用LSD-t检验,两组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组研究对象血浆METTL3 mRNA的相对表达水平、血清METTL3表达水平的比较 心肌梗死组血浆METTL3 mRNA相对表达水平、血清METTL3表达水平均高于健康对照组(均P<0.05)。见表2。
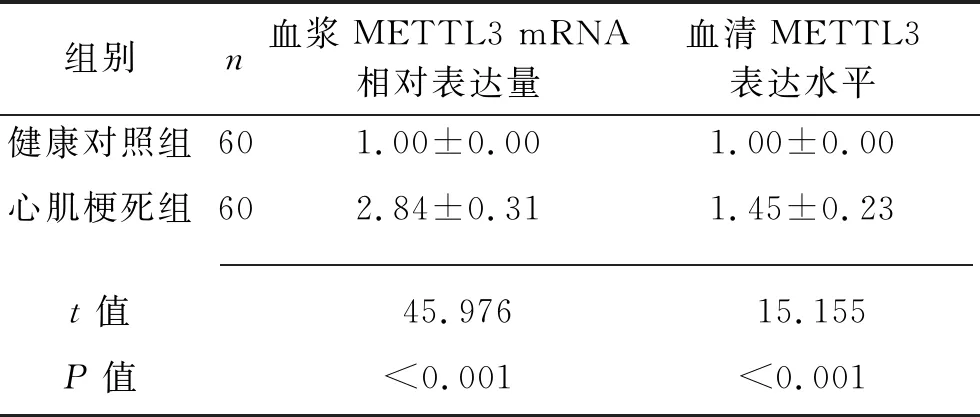
表2 两组研究对象血浆METTL3 mRNA相对表达水平、血清METTL3表达水平的比较(x±s)
2.2 敲低METTL3对体外急性HI心肌细胞增殖的影响 培养0 h时,5组细胞增殖率差异无统计学意义(P>0.05)。培养12 h、24 h、48 h时,HI-2h组、HI-4h组、siMETTL3+HI-2h、siNC+HI-2h组细胞增殖率均低于对照组(P<0.05),siMETTL3+HI-2h组细胞增殖率均高于HI-2h组、siNC+HI-2h组(均P<0.05)。见表3。

表3 5组AC16细胞增殖率的比较(x±s,%)
2.3 敲低METTL3对体外急性HI心肌细胞凋亡的影响 (1)HI-2h组、HI-4h组、siNC+HI-2h组AC16 细胞的凋亡率高于对照组(均P<0.05),而siMETTL3+HI-2h组与对照组的凋亡率差异无统计学意义(P>0.05)。siMETTL3+HI-2h组AC16细胞凋亡率低于siNC+HI-2h组和HI-2h组(均P<0.05)。见表4和图1。(2)与对照组比较,HI-2h组、HI-4h组、siNC+HI-2h组的cleaved-Caspase3表达水平,以及HI-2h组、HI-4h组、siMETTL3+HI-2h组、siNC+HI-2h组的Bax/Bcl-2 比值均升高(均P<0.05),siMETTL3+HI-2h组与对照组的cleaved-Caspase3表达水平差异无统计学意义(P>0.05);siMETTL3+HI-2h组cleaved-Caspase3表达水平和Bax/Bcl-2比值均低于HI-2h组和siNC+HI-2h组(P<0.05)。见表5和图2。
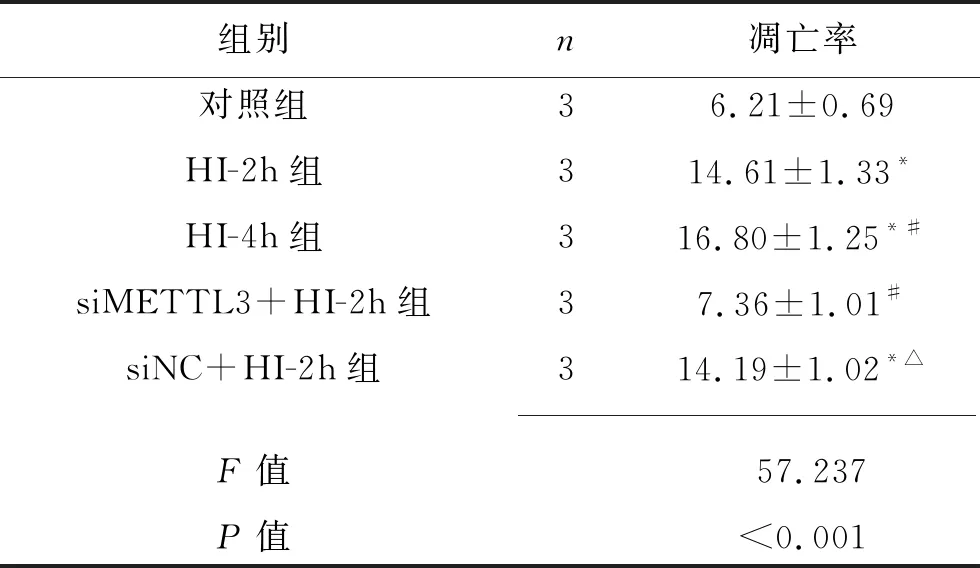
表4 5组AC16细胞凋亡率的比较(x±s,%)
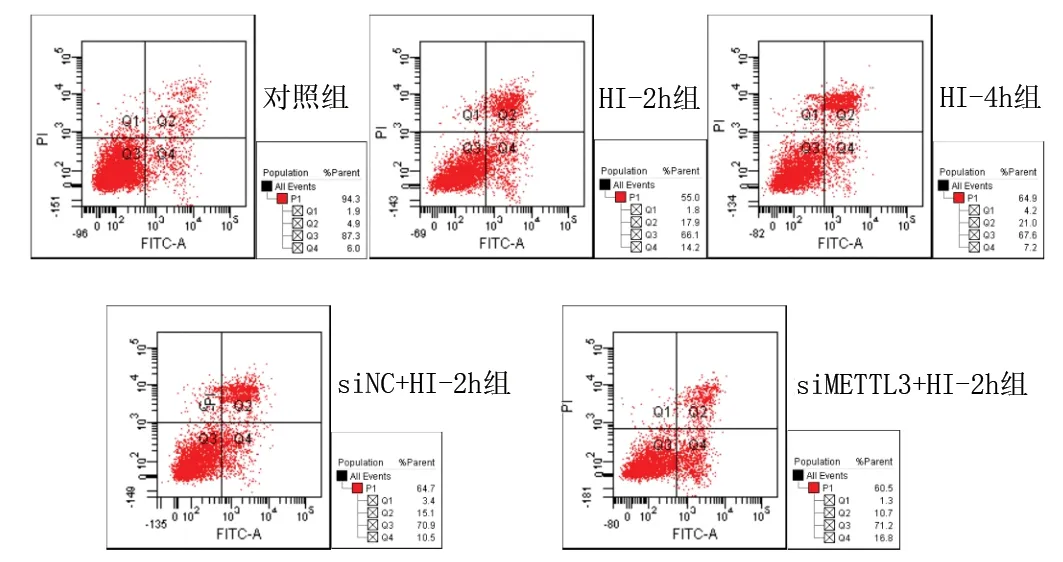
图1 各组AC16细胞凋亡率检测结果
2.4 敲低METTL3对体外急性HI心肌细胞METTL3蛋白表达水平的影响 HI-2h组、HI-4h组、siNC+HI-2h组的METTL3蛋白表达水平均高于对照组(均P<0.05),但siMETTL3+HI-2h组与对照组差异无统计学意义(均P>0.05)。HI-4h组的METTL3蛋白表达水平高于HI-2h组(P<0.05),siMETTL3+HI-2h组的METTL3蛋白表达水平低于HI-2h组和siMETTL3+HI-2h组(均P<0.05)。见表6和图2。
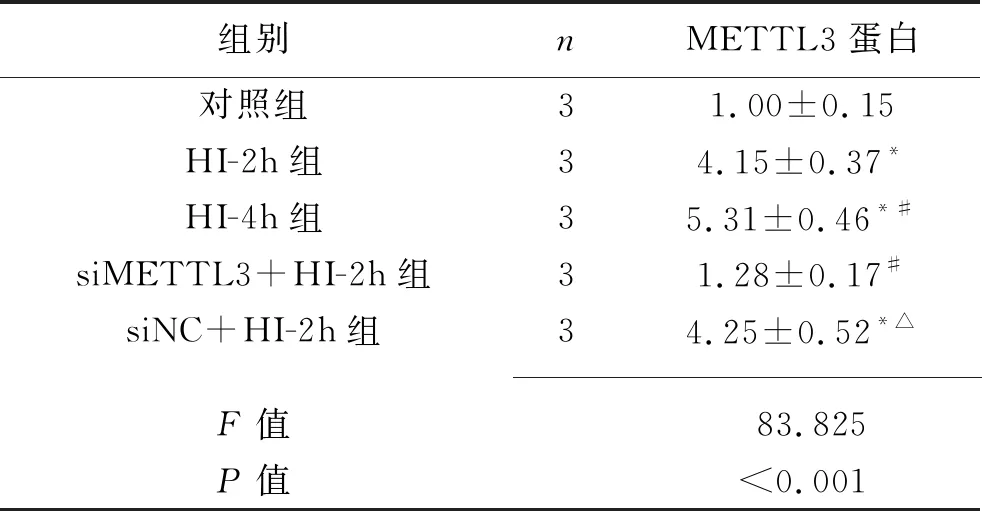
表6 5组AC16细胞METTL3蛋白相对表达水平的比较(x±s)
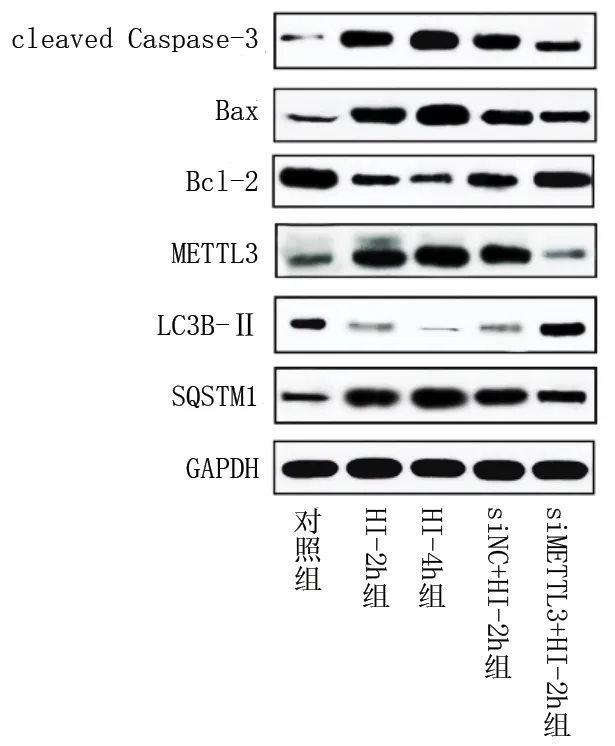
图2 5组细胞各蛋白表达情况
2.5 敲低METTL3对体外急性HI心肌细胞自噬通量的影响 与对照组相比,HI-2h组、HI-4h组及siNC+HI-2h组的LC3B-Ⅱ表达水平均下调,而HI-2h组、HI-4h组、siMETTL3+HI-2h组以及siNC+HI-2h组SQSTM1表达水平均上调(均P<0.05);与HI-2h组比,HI-4h组的SQSTM1表达水平上调(均P<0.05);与HI-2h组和siNC+HI-2h组比,siMETTL3+HI-2h组的LC3B-Ⅱ表达水平上调,而SQSTM1表达水平下调(均P<0.05)。见表7和图2。

表7 5组AC16细胞自噬通量相关蛋白相对表达水平的比较(x±s)
3 讨 论
本研究结果显示,心肌梗死组血浆中METTL3的mRNA相对表达水平均高于健康对照组(P<0.05),提示心肌梗死的发生可能与METTL3的表达有关。
尽管METTL3介导的m6A修饰具有重要的生物学意义,然而,目前对METTL3如何调节细胞功能和基因的表达的研究仍较少。本研究中, siMETTL3+HI-2h组细胞增殖率均高于HI-2h组、siNC+HI-2h组(P<0.05),提示沉默METTL3的表达可以恢复HI心肌细胞的增殖,这也表明METTL3可能参与调节HI诱导的心肌细胞增殖抑制。另外,研究表明HI还可以通过诱导心肌细胞凋亡促进心肌细胞损伤[5]。cleaved-Caspase3和Bax/Bcl-2比值是心肌细胞凋亡的关键标志物[14]。本研究中,与对照组比较,HI-2h组和HI-4h组的心肌细胞的增殖率均降低,METTL3蛋白表达水平、细胞凋亡率、cleaved-Caspase3水平和Bax/Bcl-2比值均增加(P<0.05),提示METTL3可能参与调节HI诱导的心肌细胞的凋亡和增殖抑制。Song等[12]的研究表明,过表达METTL3可以促进心肌细胞的凋亡,使用短发夹RNA敲低METTL3表达后,缺氧复氧模型小鼠心肌细胞的凋亡明显降低。本研究使用siRNA技术敲低METTL3的表达,结果显示,与HI-2h组和siNC+HI-2h组比较,siMETTL3+HI-2h组AC16细胞凋亡率、cleaved-Caspase3表达水平和Bax/Bcl-2比值均降低(P<0.05),表明沉默METTL3表达可以抑制HI诱导的心肌细胞凋亡。
SQSTM1蛋白是自噬通量减少的标志物,LC3B-Ⅱ蛋白是自噬标志物[15]。研究显示,在体内和体外抑制细胞自噬,能引起细胞凋亡的增加[16]。基于本研究观察到的沉默METTL3表达对心肌细胞凋亡的影响,进一步检测了HI及沉默METTL3对心肌细胞自噬标记物和自噬通量的影响。结果显示,HI-2h组和HI-4h组AC16心肌细胞的LC3B-Ⅱ蛋白表达水平低于对照组,而SQSTM1蛋白表达水平高于对照组(P<0.05);当敲低METTL3表达后HI心肌细胞LC3B-Ⅱ蛋白的表达增加,而SQSTM1蛋白的表达降低(P<0.05)。以上结果与既往研究[17]相似,提示METTL3具有抑制心肌细胞自噬的作用,而敲低METTL3可以上调HI诱导的心肌细胞损伤的细胞自噬通量。自噬信号通路哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)-1的下游转录因子EB(transcription factor EB,TFEB)在转录水平对细胞自噬具有关键调控作用[18],而有研究表明过表达METTL3可以明显抑制TFEB表达,从而抑制心肌细胞的自噬水平,而敲低METTL3可通过上调内源性TFEB水平来抑制mTOR的磷酸化,从而促进自噬[19],且TFEB已被证明可抑制mTOR活性[20]。以上结果表明METTL3是心肌细胞自噬的负调控因子。
综上所述,m6A甲基化转移酶METTL3在心肌梗死患者体内和HI诱导的急性心肌细胞损伤模型中的表达均升高,沉默METTL3可以抑制HI心肌细胞的凋亡并增加自噬通量,促进细胞增殖的恢复。METTL3或可作为急性缺血缺氧性疾病的潜在诊断和治疗靶点。
