湖南猪血桃花色苷提取工艺优化及抗氧化活性研究
2021-07-22陈为峰卜范文
杨 玉,陈为峰,袁 野,廖 琼,邓 文,徐 海,卜范文
(1.湖南省农科院 园艺研究所,湖南 长沙 410125;2.湖南省水果产业体系 长沙试验站,湖南 长沙 410125;3.国家农业部华中地区果树科学观测站,湖南 长沙 410125;4.长沙时鲜水果工程技术研究中心,湖南 长沙 410125;5.湖南省农业科学院,湖南 长沙 410125;6.湖南省农科院 农业经济和农业区划研究所,湖南 长沙 410125)
【研究意义】桃是我国主栽水果之一,市场需求量大。猪血桃(Amygdalus persica)为蔷薇科桃属中型落叶小乔木,学名红脆桃、血桃,属中华血桃的一种,是我国湖南衡山的地理标志保护农产品,果肉色泽殷红、甜脆爽口,深受消费者喜爱[1]。近年来的研究表明,一些红肉桃资源的果实抗氧化能力可与蓝莓相媲美,使得富含花色苷的红肉桃成为当前国内外功能性水果开发与研究的热点[2-5]。【前人研究进展】花色苷被普遍认为是自然界中最重要的水溶性色素,也是许多水果、花卉和其他植物的颜色来源[6-8]。花色苷作为一种天然色素,安全无毒,且具有清除自由基、抗氧化、抗肿瘤、抗炎、保护肝脏、预防糖尿病等多种生理功能,在一些功能性食品、化妆品和医药等领域已有应用,并有着巨大的综合利用潜力[9-15]。然而,花色苷由于自身化学结构对光、温度、pH 值等外界因素敏感,导致其稳定性差,在提取和加工利用过程中很容易发生降解,而这也正是花色苷能否得到广泛应用的关键[16-17]。【本研究切入点】目前,花色苷的提取方法有溶剂提取法、加压溶剂萃取法、水溶液提取法超高压辅助提取、微波辅助提取和超声波辅助提取等[18];在提取过程中,为了降低其降解速率,通常会加入一定浓度的盐酸或甲酸[19]。水果果实中具有抗氧化能力的物质主要为酚类化合物和花色苷,且二者含量呈正相关[20-21]。研究发现,桃富含花色苷等化学物质[22],其果实颜色取决于花色苷的种类和含量,且不同品种果肉的花色苷种类存在差异[23-24]。目前,有关猪血桃花色苷的组分含量尚有待明确,关于桃果实中花色苷的提取方法研究报道较少。【拟解决的关键问题】研究以湖南衡山地方特色优势桃品种猪血桃为材料,采用超声波辅助有机溶剂法提取花色苷,通过单因素和响应面优化试验探索其适宜的提取工艺条件,并对提取的花色苷进行体外抗氧化活性研究,旨在为进一步促进湖南地方特色品种资源的开发与利用提供技术支撑。
1 材料和方法
1.1 材料与试剂
材料:猪血桃,产地为湖南衡山;颐红水蜜桃,产地为湖南芷江;红肉M1001,产地为湖南长沙;浏阳4 斤桃,产地为湖南长沙。新鲜桃果实洗净,切片,置于冷冻干燥机中避光干燥24 h。干燥去除水分后,粉碎机粉碎,避光置干燥皿中备用。
主要试剂:矢车菊素-3-O-葡萄糖苷,美国Sigma 公司;无水乙醇(分析纯)、甲醇(分析纯)、丙酮(分析纯)、乙腈(分析纯)、甲酸、乙酸、盐酸、磷酸,国药集团化学试剂有限公司;三氟乙酸,美国Sigma 公司;1,1-二苯基-2-苦基肼、过硫酸钾、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸,Sigma-Aldrich(上海)贸易有限公司。
1.2 仪器与设备
Thermo Savant 冷冻干燥机,诸城市博众机械有限公司;高速万能粉碎机,天津泰斯特仪器有限公司;AR2140 电子天平,奥豪斯国际贸易有限公司;超声波清洗仪器,昆山美美超声仪器有限公司;岛津LC-20AT 液相色谱仪,日本Shimadzu 公司;UV-1800PC 紫外-可见分光光度计,上海奥析科学仪器有限公司。
1.3 试验方法
1.3.1 猪血桃花色苷的制备 称取一定质量的经冷冻干燥的桃粉末,加入适量提取液,避光超声提取,取上清液,经0.45 μm微孔微膜滤过,平行制样3次,备用。
1.3.2 花色苷HPLC 分析方法 色谱柱:ZORBAX SB-C18(250 mm×4.6 mm,5 μm),流速:1 mL/min;柱温:30 ℃;进样量:20 μL;流动相:A 0.2%磷酸水溶液,B 乙腈,梯度洗脱0~35 min,B 相5%~35%;二极管阵列检测器(DAD)。
1.3.3 标准曲线的绘制 通过预实验,得知猪血桃中主要的花色苷为矢车菊素-3-O-葡萄糖苷,以该花色苷作为测定猪血桃中花色苷的标准品。精密称取矢车菊素-3-O-葡萄糖苷(纯度95%)对照品1.128 mg 置于50 mL 棕色量瓶中,以甲醇溶解,每1 mL 含0.022 6 mg 矢车菊素-3-O-葡萄糖苷。采用HPLC 液相色谱法进行测定,分别设置进样量为1,2,5,10,20 μL,以质量为横坐标,峰面积为纵坐标,绘制标准曲线。
1.3.4 猪血桃花色苷提取单因素试验 1)有机溶剂筛选。取4份1.0 g猪血桃粉末至100 mL具塞锥形瓶中,分别加入50 mL 60%乙醇、甲醇、丙酮、乙腈,用盐酸调节pH 为1.5,在40 ℃下超声提取30 min,测定不同提取溶剂下花色苷的含量。
2)酸种类筛选。取4份1.0 g猪血桃粉末至100 mL具塞锥形瓶中,各加入50 mL 60%乙醇溶液,分别用盐酸、磷酸、甲酸、乙酸、三氟乙酸调节pH 值至1.5,在40 ℃下超声提取30 min,测定不同酸种类下花色苷的含量。
3)pH 对花色苷提取率的影响。取5 份1.0 g 猪血桃粉末至100 mL 具塞锥形瓶中,分别加入50 mL 60%乙醇,用盐酸调节pH 分别为1.5,2.0,2.5,3.0,3.5,在40 ℃下超声提取30 min,测定不同pH 值下花色苷的含量。
4)乙醇体积分数对花色苷提取率的影响。取6 份1.0 g 猪血桃粉末至100 mL 具塞锥形瓶中,分别加入50 mL用盐酸调节pH 值为1.5的不同体积分数的乙醇(0%,20%,40%,60%,80%,100%),在40 ℃下超声提取30 min,测定不同乙醇体积分数下花色苷的含量。
5)超声时间对花色苷提取率的影响。取5 份1.0 g 猪血桃粉末至100 mL 具塞锥形瓶中,加入50 mL用盐酸调节pH值为1.5的60%乙醇,在40 ℃下分别超声提取20,30,40,50,60 min,测定不同提取时长下花色苷含量。
6)超声温度对花色苷提取率的影响。取5 份1.0 g 猪血桃粉末至100 mL 具塞锥形瓶中,加入50 mL用盐酸调节pH值为1.5的60%乙醇,分别在20,30,40,50,60 ℃下超声提取30 min,测定不同提取温度下花色苷的含量。并采用DPPH自由基清除试验对其花色苷的活性进行测定。
7)料液比对花色苷提取率的影响。6 份1.0 g 猪血桃粉末至100 mL 具塞锥形瓶中,分别加入不同体积(10,25,50,75,100 mL)用盐酸调节pH值为1.5的60%乙醇,在40 ℃下超声提取30 min,测定不同料液比条件下花色苷的含量。
1.3.5 响应面试验设计 在单因素测试的基础上,响应面测试采用Design-Expert 8.0.6.1 软件设计。试验因素与水平设计见表1。
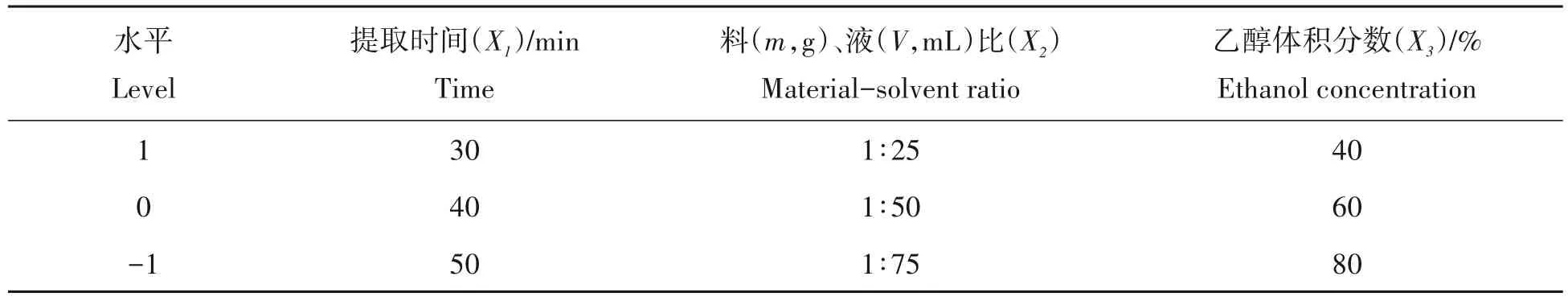
表1 响应面试验的因素和水平Tab.1 Coded factors and levels in quadratic regression rotational combinational design
1.3.6 验证试验 利用上述方法得出的最佳提取工艺进行验证试验,重复5次。
1.3.7 不同品种桃花色苷含量测定 在最佳的提取工艺条件下,分别对4个不同品种桃的果皮、果实(果皮+果肉)及果肉中花色苷含量进行测定。
1.3.8 猪血桃花色苷体外抗氧化试验 按文献的方法进行DPPH 自由基清除能力的测定[25];按文献的方法进行ABTS+自由基清除能力的测定[26]。
2 结果与分析
2.1 猪血桃花色苷提取物HPLC分析
花色苷属于类黄酮化合物,在280 nm 和520 nm处均有特征吸收峰[19]。由图1可见,样品提取液分别在280 nm 和517 nm 处有最大吸收峰,由此可推断样品中提取的色素为花色苷类物质。如图2 所示与标准品矢车菊素-3-O-葡萄糖苷比对,二者出峰时间一致并均有单一峰,故可推断出猪血桃中所含的花色苷主要为矢车菊素-3-O-葡萄糖苷。

图1 猪血桃花色苷提取物的紫外吸收光谱Fig.1 Ultraviolet absorption spectrum of anthocyanin extract from blood fleshed peach

图2 HPLC液相色谱图Fig.2 HPLC liquid chromatogram
2.2 猪血桃花色苷提取单因素试验
2.2.1 有机溶剂对花色苷提取效果的影响 在提取时间为30 min,料液比为1∶50,pH 值为1.5,有机溶剂体积为60%,温度设定为40 ℃的条件下,探究有机溶剂种类对花色苷提取效果的影响,结果如图3 所示。由图3 可知,在4 组有机溶剂中,甲醇和乙醇对花色苷的溶出效果最好。由于甲醇具有毒性,所以确定乙醇为最佳提取溶剂。
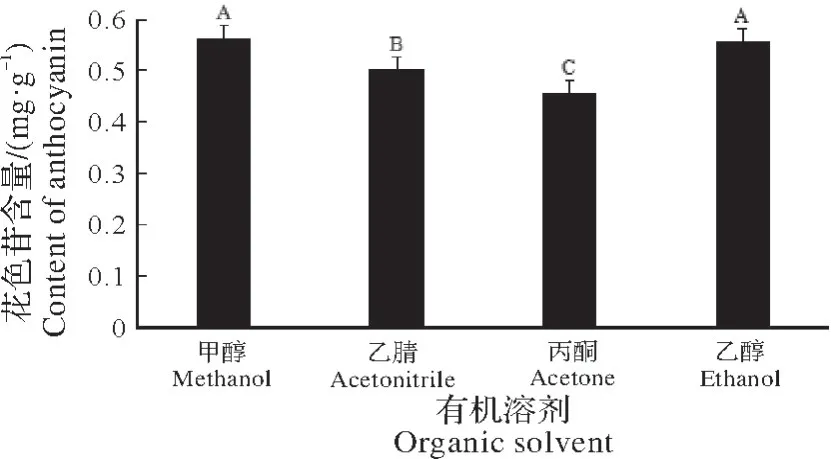
图3 有机溶剂对花色苷含量的影响(P=0.01)Fig.3 The effect of organic solvent on the content of anthocyanin(P=0.01)
2.2.2 酸种类对花色苷提取效果的影响 在提取时间为30 min,料液比为1∶50,乙醇体积为60%,温度设定为40 ℃的条件下,用不同的酸将pH 值调为1.5,探究其对花色苷提取效果的影响,结果如图4所示。由图4 可看出,盐酸对花色苷的提取效果最佳,磷酸其次,表明对该花色苷的提取效果无机酸大于有机酸。因此试验确定以盐酸调节pH。

图4 酸对花色苷含量的影响(P=0.01)Fig.4 The effect of acid on the content of anthocyanin(P=0.01)
2.2.3 pH 值对花色苷提取率的影响 在提取时间为30 min,料液比为1∶50,乙醇体积为60%,温度设定为40 ℃的条件下,用盐酸将pH 值分别调到1.5、2.0、2.5、3.0和3.5,探究pH 对花色苷提取效果的影响,结果如图5所示。当pH值为1.5的处理提取含量最高,表明酸可以防止花色苷的降解和提高花色苷的溶出率。所以确定以pH值1.5进行后续试验。
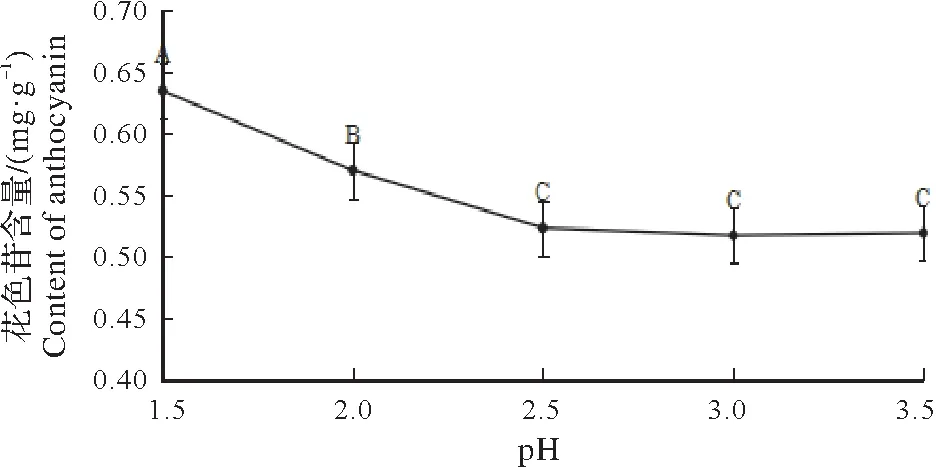
图5 pH对花色苷含量的影响(P=0.01)Fig.5 The effect of pH value on the content of anthocyanin(P=0.01)
2.2.4 乙醇体积分数对花色苷提取率的影响 在提取时间为30 min,料液比为1∶50,pH值为1.5,温度设定为40 ℃的条件下,分别用不同体积分数的乙醇提取花色苷,花色苷溶出率如图6 所示,当乙醇体积分数达到60%时花色苷的提取效果最好,此后随着体积分数的增大,花色苷的提取效率趋于平衡。这种情况可能是因为矢车菊素-3-O-葡萄糖苷极性较大,使用同样具有较大极性的溶剂更利于C3G 溶出。考虑到节约有机溶剂,单因素试验初步确定的最佳乙醇体积分数为60%。

图6 乙醇体积分数对花色苷含量的影响Fig.6 The effect of ethanol concentration on the content of anthocyanin
2.2.5 提取时长对花色苷溶出率的影响 在料液比为1∶50,pH 值为1.5,乙醇体积为60%,温度设定为40 ℃的条件下,探究不同提取时长对花色苷溶出率的影响。结果如图7 所示,随着超声时间延长,提取率有增大趋势,当提取时间为50 min时达到最大(图7)。当提取时间超过50 min后得率降低。这可能与长时间的提取,超声产热量增加,组织中大量细胞破裂和溶液中杂质增多有关,最终使吸附部分花色苷含量下降。单因素试验结果筛选最佳提取时间为50 min。
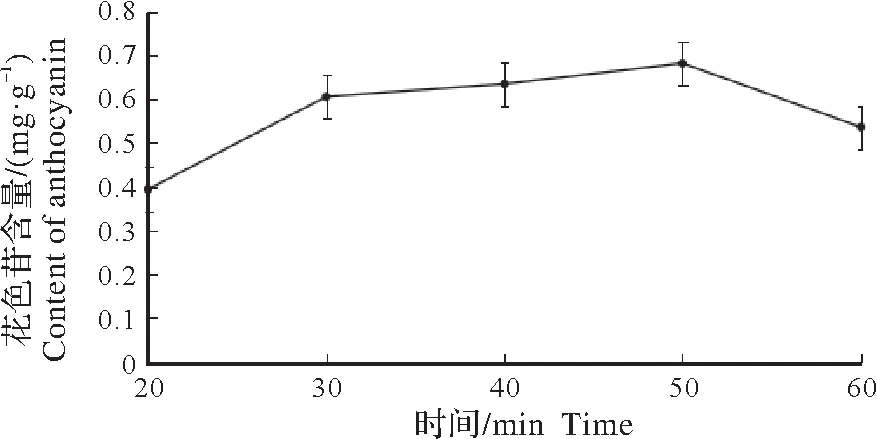
图7 提取时间对花色苷含量的影响Fig.7 The effect of time on the content of anthocyanin
2.2.6 提取温度对花色苷提取效果的影响 在料液比为1∶50,pH 值为1.5,乙醇体积为60%,提取时间为30 min 的条件下,探究提取温度对花色苷溶出率的影响。由图8 和图9 可知,在温度60 ℃以下对花色苷的提取含量及其抗氧化活性几乎没有影响。而在不对超声仪进行温度设置的情况下,超声所产生的热量很难使水浴温度超过60 ℃,所以后续试验不对温度进行考察,只需控制温度在60 ℃以下进行即可。

图8 提取温度对花色苷含量的影响Fig.8 The effect of temperature on the content of anthocyanin

图9 提取温度对DPPH自由基清除能力的影响Fig.9 The effect of temperature on the DPPH·scavenging activity
2.2.7 料液比对花色苷溶出率的影响 在提取时间为30 min,pH值为1.5,乙醇体积为60%,温度设定为40 ℃的条件下,探究料液比对花色苷溶出率的影响。图10结果表明,随着溶剂用量的增多,花色苷含量先增加后减少,表明一定量的溶剂用量有利于原料中花色苷的传质与扩散,提升提取率。但溶剂太多造成浪费,也不利于后续处理。因此,单因素试验下的最佳料液比确定为1∶50。

图10 料液比对花色苷含量的影响Fig.10 The effect of material-solvent ratio on the content of anthocyanin
2.3 响应面优化提取工艺试验结果
在单因素试验的基础上,根据Box-Behnken 中心组合试验原理,提取溶剂为乙醇,盐酸调节pH 至1.5,选择时间、料液比和乙醇体积分数3 个因素,并用响应面法对提取工艺条件进行优化。试验方案和结果见表2。

表2 响应面分析方案及结果Tab.2 Response surface analysis and results
用Design-Expert 8.0.6 软件对表2 的数据进行处理,其方差分析结果见表3,并对响应值与各个因素进行回归拟合,其拟合方程为:花色苷含量Y=1.74+0.080X1+0.096X2+0.28X3-0.023X1X2-0.063X1X3-。结果表明,回归方程模型极显著(P<0.01),方程失拟项不显著(P>0.05),表明该模型适用。回归系数R2=0.986 1>0.9,表明该模型相关度良好。每项方差分析表明,X1、X2、对花色苷提取量有极显著的影响。根据各影响因素标准回归系数的大小:X3>X2>X1,可知各因素对花色苷得率的影响由大到小依次为乙醇体积分数、料液比和提取时间。在交互项对花色苷得率的影响中,X1X3也就是时间和乙醇体积分数对最终花色苷提取量有较大的影响。

表3 回归模型方差分析Tab.3 Analysis of variances for the created regression model
根据建立的参数优化分析模型(图11),获得最高花色苷提取量所需的参数是:pH 1.5、m(料)∶V(液)=1∶54.31、提取时间40.89 min、乙醇体积分数78.61%,猪血桃提取量预测值为1.881 mg/g。为方便实际操作,确定最佳提取条件为:pH 1.5、m(料)∶V(液)=1∶55、提取时间41 min、提取温度45 ℃、乙醇体积分数78%。

图11 各因素交互作用的响应及等高线图Fig.11 Response surface and contour plots showing the interactive effects of variables on the extraction yield of anthocyanin
2.4 验证试验
在pH 1.5、m(料)∶V(液)=1∶55、提取时间41 min、提取温度45 ℃和乙醇体积分数78%的条件下,重复试验5 次。由表4 可知,猪血桃花色苷的平均提取量为1.901 mg/g,相对标准偏差RSD 值为2.158%,表明该提取工艺条件适用于猪血桃花色苷的提取。

表4 最佳提取工艺验证结果Tab.4 Optimum extraction process verification results
2.5 湖南4种地方红肉桃品种花色苷含量比较
试验所选4 种红肉桃品种所含花色苷均为C3G。从表5 可知,猪血桃的C3G 含量远高于其他3 个桃品种,且其他3 个桃品种花色苷主要集中在果皮,而猪血桃为果肉,表明猪血桃果肉更具营养保健价值。

表5 不同品种桃不同部位C3G含量Tab.5 C3G content in different parts of different varieties of peach
2.6 猪血桃花色苷的抗氧化活性
2.6.1 对DPPH 自由基的清除能力 在所考察的质量浓度范围内,样品溶液清除DPPH·的能力均随着质量浓度的增加而增大,并呈现出较好的量效关系(图12)。对猪血桃提取物清除DPPH·的效果与浓度进行线性拟合,线性方程为:y=0.600 3x-6.19,R2=0.995 2。IC50为93.6 mg/mL,表明猪血桃花色苷对DPPH·具一定的清除能力。

图12 DPPH自由基清除率Fig.12 DPPH·scavenging activity
2.6.2 对ABTS+自由基的清除能力 将猪血桃花色苷对ABTS+·的清除率与浓度进行线性拟合,如图13所示,其方程为y=1.087 8x+1.409 6,R2=0.999 0,根据方程计算其IC50为47.26 mg/mL,表明桃花色苷对ABTS+·具有一定的清除能力,可使具有高度氧化性的自由基还原,终止自由基的连锁反应,起到清除或抑制自由基的作用。

图13 ABTS+自由基清除率Fig.13 ABTS+·scavenging activity
3 结论与讨论
3.1 猪血桃花色苷主要成分鉴定及提取工艺的优化
研究表明,花色苷的存在是使果肉呈现红色的关键物质[29]。赵玉等[5]检测了48 份桃果实中所含的花色苷主要为矢车菊素-3-O-葡萄糖苷(C3G),但在乌黑鸡肉桃、大果黑桃果肉中同时检测到矢车菊-3-O-芸香糖苷(C3R)。笔者研究结果表明猪血桃花色苷主要成分为矢车菊素-3-O-葡萄糖苷(C3G)。本文在单因素试验的基础上选取pH 值、液料比、提取温度和提取时间进行响应面试验优化,得到猪血桃花色苷最适宜的提取工艺为:pH 值1.5、m(料)∶V(液)=1∶55、提取时间41 min、提取温度45 ℃、乙醇体积分数78%,平均提取量为1.901 mg/g(RSD=2.158%),与预测值1.881 mg/g相近。研究表明,温度会影响C3G这类多酚羟基化合物结构的稳定性,高温可致其降解,笔者在提取猪血桃C3G时观察到只要保持水浴温度在60 ℃以下即可,这与前人对红肉桃“天仙红”花色苷提纯工艺的研究一致[15]。经过工艺优化,猪血桃花色苷的提取最适时间明显短于“天仙红”,含量也相对较高。此外,pH 值也会影响酚类化合物C3G 分子结构从而导致其色泽发生变化。杨梅花色苷种类也为C3G[27],当pH<3 时,主要以2-苯基苯并吡喃阳离子形式存在使提取液呈现明亮的红色;当pH值升高至4~5时,主要以醌型碱形式存在而使提取液逐渐变为蓝色;当pH>6时,C3G的碳环打开则以黄色的查尔酮形式存在[28]。猪血桃果实花色苷含量随盐酸pH 值的增大而减少,据此判定偏酸条件更有利于猪血桃花色苷稳定性的保持。通过响应面优化试验同样也证明pH 在1.5时更有助于提高猪血桃花色苷的溶出率。萃取溶剂的采选也是优化提取工艺参数的重要步骤。以往的研究均利用甲醇作为萃取溶剂,但甲醇具有毒性;笔者的研究结果表明甲醇和乙醇对桃花色苷提取量均接近0.6 mg/g,溶出效果在4组有机试剂中最佳,因此可用乙醇替代甲醇作为溶剂进行花青素提取。
3.2 猪血桃花色苷的抗氧化活性探究
利用优化后的工艺提取比较了湖南4个地方品种桃果皮和果肉的花色苷,发现猪血桃的花色苷果肉大于果皮,并且果肉C3G含量在4个品种中最高,但其他3个桃品种花色苷果皮大于果肉,与前人对红肉桃果肉中类胡萝卜素、花青素含量低于果皮中类胡萝卜素、花青素含量研究结果一致[30]。通过对DPPH·和ABTS+·的清除试验表明,其对DPPH·清除作用的IC50为93.6 mg/mL,对ABTS+·清除作用的IC50为47.26 mg/mL。研究显示,红肉桃果实抗氧化能力显著高于白肉和黄肉桃,从抗氧化的角度分析红肉桃资源更有开发利用的价值,且桃果实总酚对抗氧化能力的贡献高于花色苷[2]。猪血桃中花色苷对DPPH·及ABTS+·存在明显的清除效果,但其抗氧化的量效关系及作用机制尚不清楚,有待于进一步探究。
