火龙果主要商业品种SSR指纹图谱构建和遗传多样性分析
2021-07-20胡文斌洪青梅李婧濮文辉何云李洪立李琼
胡文斌 洪青梅 李婧 濮文辉 何云 李洪立 李琼

摘 要:为了准确鉴定火龙果主要商业品种和评估其遗传多样性,本研究利用20对火龙果SSR核心引物对58个火龙果品种进行遗传多样性分析,采用毛细管电泳技术进行多态性位点检测,共检测到116个多态位点,平均每个位点等位基因数(Na)为5.8个,有效等位基因数(Ne)为2.0519,观测杂合度(Ho)为0.3318,期望杂合度(He)为0.4603,多态性信息含量指数(PIC)为0.417。基于遗传相似系数聚类结果,将火龙果主要商业品种分为3大类群。依据20对SSR引物在58个品种中扩增的特异带型组合,选取其中9对引物采用引物-带型组合法构建了58个火龙果品种的指纹图谱,品种鉴定的置信概率几乎为100%。研究结果可为火龙果种质分类、品种鉴定和品种权保护提供重要的理论依据与技术支撑。
关键词:火龙果;SSR标记;指纹图谱;品种鉴定;遗传多样性
中图分类号:S667 文獻标识码:A
Abstract: In order to accurately identify pitaya cultivars and evaluate their genetic diversity, 20 pairs of SSR core pri-mers were used to analyze the genetic diversity of 58 pitaya varieties, and polymorphic alleles were detected by capil-lary electrophoresis. Totally, 116 polymorphic alleles were revealed, with an average of 5.8 for each primer pairs. The average number of alleles (Na), number of effective alleles (Ne), observed heterozygosity (Ho), expected heterozygosity (He), and polymorphism information content (PIC) was 5.8, 2.0519, 0.3318, 0.4603 and 0.417, respectively. Based on the clustering results of genetic similarity coefficient, the main commercial cultivars of pitaya were divided into three groups. Based on 20 pairs of SSR primers amplified from 58 cultivars, the fingerprints of 58 cultivars of pitaya were constructed using 9 pairs of primers. A strategy of combining primer pair with distinct alleles for fingerprint construction was developed and applied to the 58 cultivars. The confidence probability of variety identification was almost 100%. The research results would provide important theoretical basis and technical support for the germplasm classification, cultivar identification and varieties property protection of pitaya.
Keywords: pitaya; SSR; fingerprint; variety identification; genetic diversity
DOI: 10.3969/j.issn.1000-2561.2021.05.016
火龙果(Hylocereusundatus Britt. & Rose)又名红龙果,属仙人掌科(Cactaceae)多年生攀缘植物,原产于墨西哥南部及中美洲诸国的太平洋沿岸地区。火龙果是近年发展起来的具有较高的营养价值[1]、药用价值[2-4],以及观赏价值[5]的新兴热带亚热带果树。在中国、越南、美国、泰国、以色列、哥伦比亚、厄瓜多尔、巴西、澳大利亚等国家有大规模种植,目前中国的种植面积大约有80 000 hm2,主要分布在广东、广西、海南、贵州、云南、福建等省(区),但是火龙果现有品种存在严重的同物异名、同名异物以及品种混淆等问题,由于主要商业品种外形特征极为相似,传统形态学分类手段难以有效鉴定。为了实现现有资源特别是商业品种的准确鉴定,亟需开展DNA分子身份证构建相关研究。
2005年国际植物新品种权保护组织(UPOV),将构建DNA指纹数据库的标记方法确定为SSR和SNP,目前国家认定的植物品种鉴定DNA分子标记法的行业标准,以SSR、SNP、IDP标记为首选标记[6],主要是采用SSR。微卫星DNA标记(simple sequence repeat, SSR)具有按照孟德尔遗传方式分离、共显性遗传、位点数量多、多态性高、实验程序简单等优点,在农作物品种鉴定的研究上得到了广泛应用。SSR在水稻[7]、玉米[8]、小麦[9]等农作物品种鉴定上的研究,不仅形成了有效的鉴定技术体系,构建了对应的DNA指纹数据库,还将其应用于实践中。目前水稻[10]、玉米[11]、大豆[12]、小麦[13]等都建立了基于SSR标记的品种鉴定技术规程,发布相关的行业标准,已经分别在中国水稻、玉米、大豆和小麦等品种鉴定中得到了实施和应用。SSR标记在火龙果种质资源遗传多样性分析中已得到应用[14-15],但尚未有主要商业品种分子身份证构建相关报道。为了构建适合火龙果品种鉴定的分子身份证,本试验以58份火龙果主要商业品种为材料,从前期引物筛选所得火龙果SSR核心引物中选择20对引物开展遗传多样性分析和分子身份证构建研究,以期为火龙果种质分类、品种鉴定和品种权保护提供重要的理论依据与技术支撑。
1 材料与方法
1.1 材料
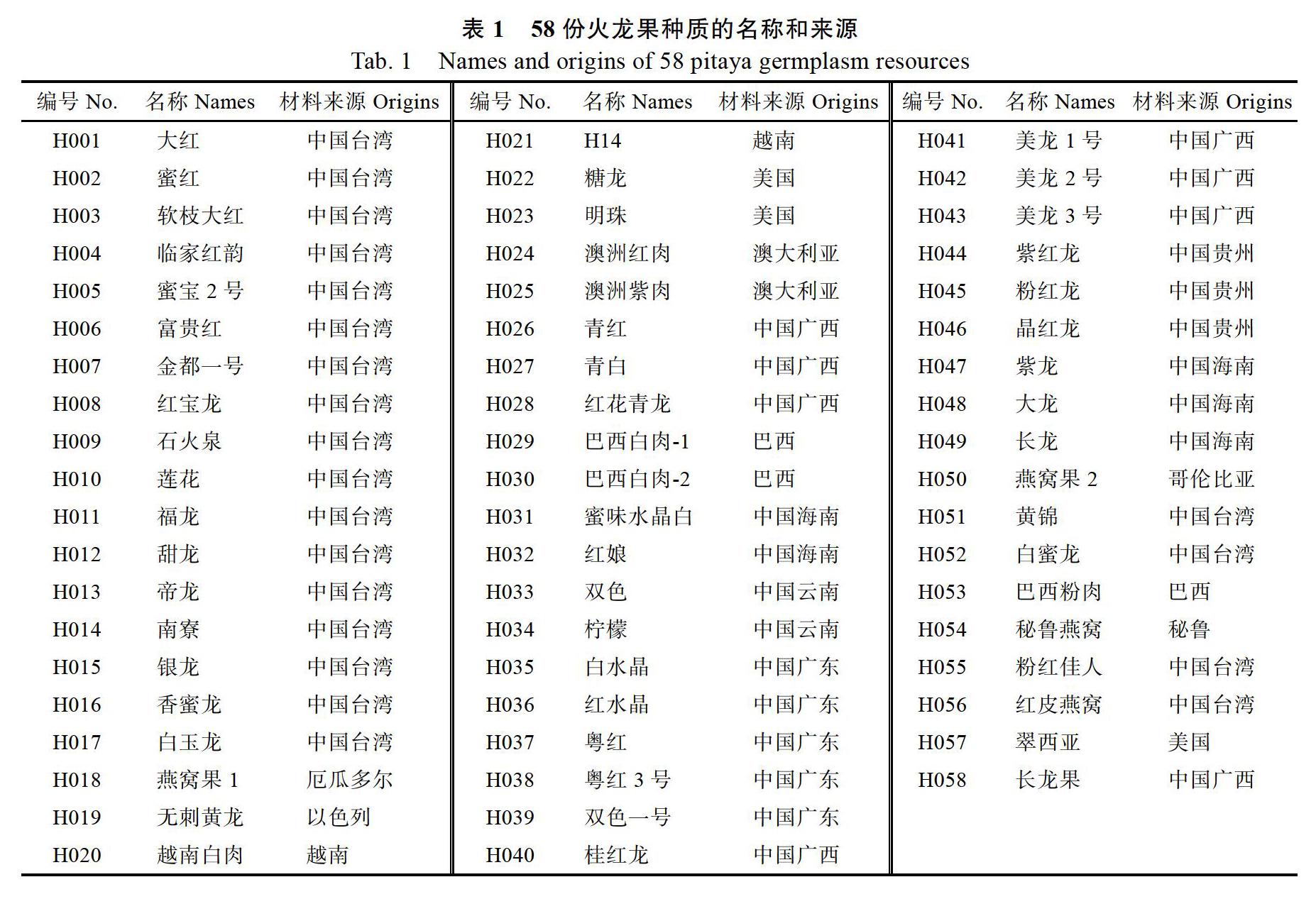
供试的58份火龙果品种资源(表1)主要来自火龙果主产区,包括国内的海南、云南、广西、广东、福建、贵州、台湾等省(区)的火龙果主产区,以及国外的美国、越南、以色列、厄瓜多尔、哥伦比亚、巴西、澳大利亚等国家的火龙果主产区。以上材料均保存于海南儋州中国热带农业科学院热带作物品种资源研究所农业农村部火龙果种质资源保护海南创新基地。
1.2 方法
1.2.1 DNA提取 使用天根生化科技(北京)有限公司高效植物基因组DNA提取试剂盒(DP350)提取58份火龙果幼嫩茎样品的总DNA,操作参照产品说明书进行。样品统一稀释到20 ng/μL后,–20 ℃保存备用。
1.2.2 SSR程序及PCR产物检测 火龙果SSR引物由前期核心引物筛选试验所得(表2),PCR产物检测使用毛细管电泳,普通引物委托生工生物工程(上海)股份有限公司进行合成。毛细管电泳所需荧光引物由武汉诚至生物科技有限公司合成,分别在各引物对的F向引物的5端加上FAM或HEX荧光修饰基团。
SSR荧光引物反应体系(共10 μL):PCR反应体系总体积为10 μL,含2×Taq PCR Master Mix 5.0 μL,带荧光的F-primer(10 μmol/L)0.5 μL,R-primer(10 μmol/L)0.5 μL,模板DNA(20 ng/μL)2.0 μL,ddH2O 2.0 μL。
扩增程序为:94 ℃预变性5 min;94 ℃变性30 s,复性30 s(根据引物Tm值设计退火温度),72 ℃延伸30 s,共35个循环;最终72 ℃延伸10 min。4 ℃保存。
将甲酰胺与分子量内标按100∶1的体积比混匀,再将PCR产物进行稀释10倍后,取1 μL PCR稀释产物+9 μL甲酰胺(含1%分子量内标)变性后上DNA分析仪ABI 3730xl(美国)进行毛细管荧光电泳检测。
1.2.3 数据处理与遗传多样性分析 将毛细管电泳检测结果导入到GeneMarker分析软件中,进行数据整理,每对引物导出PDF峰图文件。根据毛细管电泳结果,选择条带清晰、多态性高的进行统计,将同一位点的所有等位基因从小到大排列,有条带记为“1”,空白记为“0”,统计所得的数据利用Excel软件转換成NTSYS-2.10所需要的格式,利用软件NTSYSpc2.10计算遗传相似系数,采用非加权组平均法(UPGMA),利用筛选出的SSR核心引物对58份火龙果种质资源进行聚类分析。用Cervus软件和Popgene软件进行遗传多样性分析,等位基因数(No. ofalleles,Na)、有效等位基因数(No. of effective alleles,Ne)、香农信息指数(Shannon sinformation index,I)、Nei氏期望杂合度(Neis expected heterozygosity,Neis)、观测杂合度(Observed heterozygosity,Ho)、期望杂合度(Expected heterozygosity,He)等参数使用Popgene软件计算,各个位点的多态性信息含量(Polymorphism information content,PIC值)由Cervus软件计算。
1.2.4 指纹图谱构建 从上述结果中选择适当鉴定力强的SSR引物构建主要商业品种的指纹图谱,以所分析的SSR引物名称为前缀,该标记在某样品上扩增带的分子量为后缀,得到每个品种在某个标记的带型编号,按照固定的引物排序综合不同引物分析结果,串联各带型编号,形成该品种的SSR指纹图谱。根据指纹图谱出现的概率公式P=1/2n(n为多态位点数,2n则为检测n个位点涉及的所有可能的试验材料个数),统计图谱的置信概率。
2 结果与分析
2.1 主要商业品种的SSR标记多态性分析
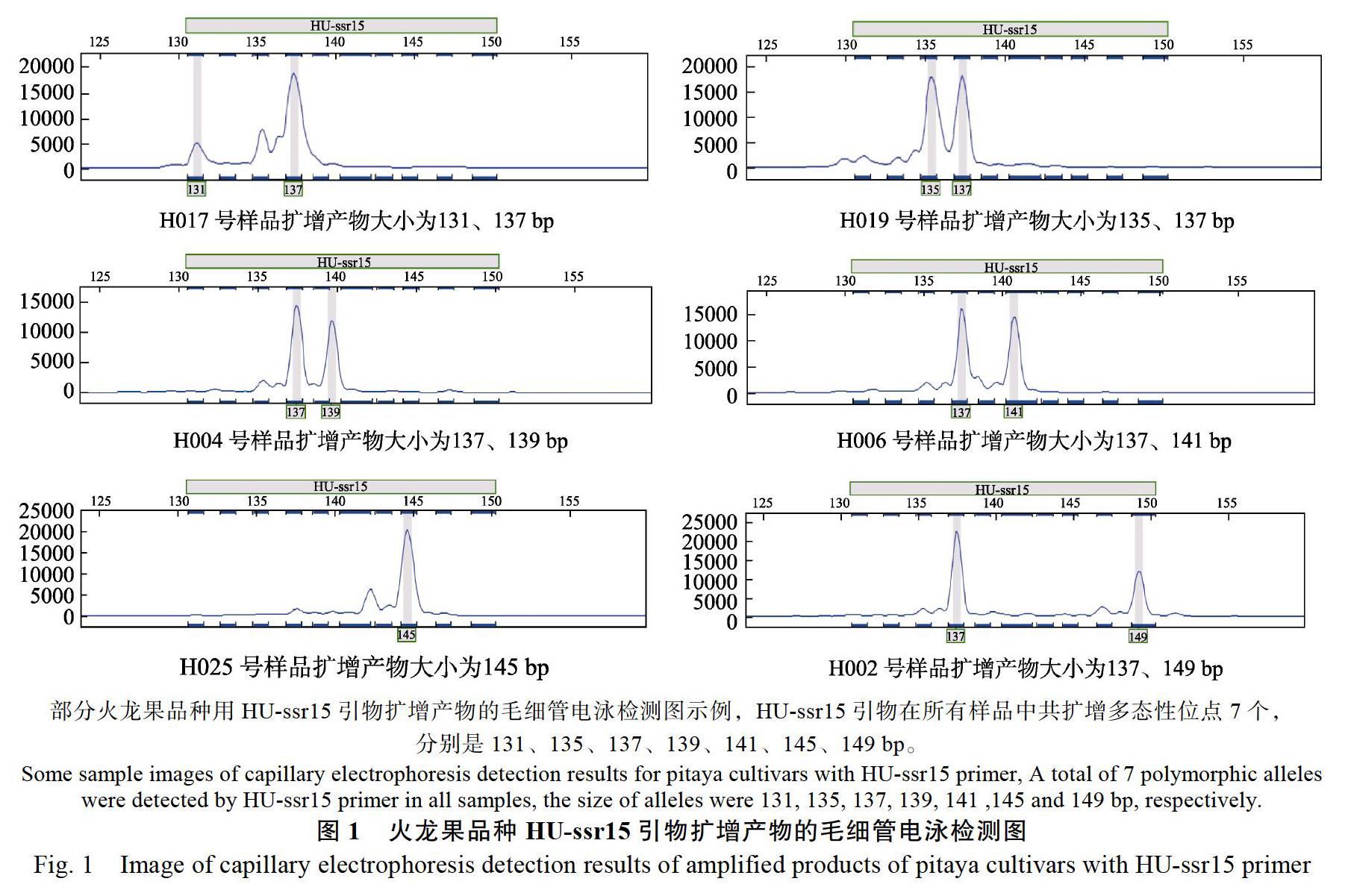
从前期实验得到的火龙果SSR标记核心引物中筛选出20对引物,对58份样品进行遗传多样性分析(部分检测结果见图1)。20对SSR引物在58份火龙果种质资源中共检测出116个等位变异,多态性条带数为116个,多态位点百分率达100%。等位基因数变化范围为2~13,平均每个位点等位基因数(Na)5.8个,有效等位基因数(Ne)变化范围为1.0194~3.3029,平均值为2.0519,香农信息指数(I)平均为0.9186,观测杂合度(Ho)平均为0.3318,期望杂合度(He)平均为0.4603,多态性信息含量指数(PIC)平均为0.417,说明引物的多态性较高,有效揭示了58份火龙果主要商业品种的遗传多样性,同时说明这些引物能用于主要商业品种的指纹图谱构建(表3)。其中引物HU-ssr15、HU-ssr67、HU-ssr91的PIC值高,分别有7、9、13个等位变异,对应的基因型有11、15、16个,有很高的鉴别能力,可以将绝大多数材料鉴别出来,可以作为指纹图谱构建的优选引物。
2.2 主要商业品种聚类分析
根据20对核心引物扩增数据,用NTSYS- pc2.1软件,依据遗传相似系数采用UPGMA算法对58个种质进行聚类分析。从图2可见,在遗传相似系数为0.72时,58份火龙果商业品种总体上被分为3个类群。其中第1类只包含了H057(‘翠西亚);第2类包括H018(厄瓜多尔‘燕窝果)、H022(‘糖龙)、H050(哥伦比亚‘燕窝果)、H054(‘秘鲁燕窝)、H056(‘红皮燕窝);第3类为常见的主栽品种和地方品种,主要量天尺属类或杂交群体,总共有52份。包括‘大红‘金都一号‘蜜红‘蜜宝‘石火泉‘富贵红‘帝龙‘福龙‘甜龙等系列品种,越南、澳大利亚等国主栽品种,也包括广西、广东、海南、部分火龙果品种用HU-ssr15引物扩增产物的毛细管电泳检测图示例,HU-ssr15引物在所有样品中共扩增多态性位点7个,分别是131、135、137、139、141、145、149 bp。
贵州等地方审定品种,这一类群又可以分为多个亚类群,基本上为红皮红肉、红皮白肉、双色等系列品种。这些品种遗传相似系数基本在0.90以上,说明现有主栽品种差异小,遗传背景狭窄,其中H002(‘蜜红)与H048(‘大龙)、H020(‘越南白肉)与H046(‘晶红龙)等之间的相似系数接近为0.99,说明它们之间的亲缘关系近。
2.3 指纹图谱构建
根据20对核心引物扩增结果可以将所有品种区分开,选取最优的9对引物组合(HU-ssr03、HU-ssr15、HU-ssr23、HU-ssr36、HU-ssr56、HU-ssr67、HU-ssr68、HU-ssr74、HU-ssr91)就可以将58份品种完全区分,将代表每个样品等位基因位点有无的“1”和“0”按顺序组成数字指纹,构建了58份主要商业品种和优良品系的指纹图谱(表4)。这些引物的多态性位点有65个,根据概率公式1/2n可知,理论上在265份品种中才有可能存在2个品种的电泳图谱完全相同,置信概率几乎为100%,该指纹图谱可准确检测其中任何品种。其中引物HU-ssr91的多态位点数达13个,可以区分H001(‘大红)、H022(‘糖龙)、H057(‘翠西亚)等16个品种。
3 讨论
本研究使用的20个SSR标记,对58份样品进行遗传多样性分析结果中,检测出116个等位变异,多态性条带数为116个,多态位点百分率达100%,等位基因数变化范围为2~13,平均每个位点等位基因数(Na)5.8个,多态性好。但是有效等位基因数(Ne)变化范围为1.0194~ 3.3029,平均值为2.0519,香农信息指数I为0.0542~1.5693,平均为0.9186,观测杂合度(Ho)0.0000~0.8750,平均为0.3318,期望杂合度(He)为0.0192~0.7033,平均为0.4603,多态性信息含量指数(PIC)为 0.019~0.658,平均为0.417,在0.25 < PIC < 0.50之间,为中度多态性,其中20个标记中有7个具有高度多态性(PIC > 0.50),10个具有中度多态性(0.25 < PIC < 0.50),3个标记为低度多态性(0 < PIC < 0.25),说明引物的多态性较高,能有效揭示58份火龙果种质资源的遗传多样性,也能很好地鉴别现有主要商业品种。然而,虽然本研究的样品数增加了,但是相较于前期引物筛选所用18份材料得出的结果(PIC为0.471、13个高度多态性,相关结果文章已发表于《热带农业科学》2020年12期),整体多态性指数都有降低,说明58份样品的多样性不够。而聚类分析结果也证明火龙果主要商业品种丰富度不够,遗传背景较狭窄。除了第1类H057(‘翠西亚)和第2类H018(厄瓜多尔‘燕窝果)、H022(‘糖龙)、H050(哥伦比亚‘燕窝果)、H054(‘秘鲁燕窝果)、H056(‘红皮燕窝果),其他的大部分材料相似度很高。H057(‘翠西亚)棱边缘木栓化、棱边缘波浪形、枝条带粉状物、刺多而细长、果皮暗红色、果肉紫肉、果无刺,与美国品种El特征很相似,从表型描述上基本符合量天尺属的Hylocereus ocamponis表型特征,明显区别于其他类型火龙果。H018(厄瓜多尔‘燕窝果)、H022(‘糖龙)、H050(哥伦比亚‘燕窝果)、H054(‘秘鲁燕窝果)、H056(‘红皮燕窝果)可以基本概括为燕窝果类。因此,需加强国外原生种资源的引进,选择遗传差异大的种质作为亲本,这样有助于扩大双亲的遗传基础,提高火龙果育种的效率。而为了更好更准确地进行火龙果种质资源遗传多样性分析,需要筛选更多的多态性位点。另外由于火龙果没有公开发表的基因组序列信息,无法保证所用SSR位点在基因组上均匀分布且每一条染色体上有位点分布,如果要建立品种鉴定的标准方法,需要更多的引物筛选与完整的基因组信息。
早期的RAPD、ISSR、AFLP、SRAP等分子标记方法由于分型不稳定、基因型过多、重复性差、非共显性等原因,不太适合做种质资源的精准鉴定与遗传多样性分析。目前主要用SSR、SNP标记开展相关研究。SSR由于重复性好、多态性高且共显性标记,实验条件要求不高而成为主要应用标记。虽然本研究利用SSR标记构建了现有主要商业品种的分子身份证,实现了品种鉴定,对完成现有主要商业品种分类、品种鉴定和品种权保护提供了技术支撑。但是SSR标记也有其缺点:由于DNA聚合酶的“滑动”现象容易出现错误基因型,SSR位点差异小需要精准确定位点大小比较难。这些缺点导致SSR有一定的错误率。随着测序技术的发展,在基因组水平上的SNP(單核苷酸引起的序列多态性)、MNP(多个核苷酸引起的序列多态性)应用越来越广泛,小麦[16]、玉米[17]、大豆[18]、油菜[19]等主要农作物都开展利用SNP标记进行品种鉴定的相关研究,但是单个SNP位点鉴定能力有限,需要大量的SNP位点才能实现鉴定目标,加上SNP位点太多,多态性位点筛选工作量大;另外SNP位点检测也存在一定的错误率。新的标记法MNP标记可以避免SSR、SNP的缺点、充分利用了SNP标记的优点,多态性丰富、准确率高、效率高等优点,是目前最有效的鉴定方法。后期我们将基于MNP标记法开展火龙果种质资源鉴定研究。
由于我国不是火龙果的原产国,国内引进的大部分火龙果种质资源以商业化品种为主,在火龙果育种过程中可利用的亲本资源不多,再加上集中利用少数亲本导致国内火龙果种质资源遗传多样性低。需要加强国外原生种资源的引进,提升资源丰富度。同时未来将结合SSR与MNP标记法开展火龙果种质资源鉴定与遗传多样性研究,提高技术水平,利用合适的分子标记以期建立更准确更标准化的品种鉴定技术规程,更系统更准确地对火龙果种质资源进行遗传多样性和亲缘关系分析,选择遗传差异大的种质作为亲本,充分利用现有资源,提高火龙果育种的效率,为火龙果分类、育种、品种鉴定、新品种权保护提供重要的技术支撑和理论依据。种质资源和育种辅助技术双管齐下,提升育种效率,加快培育具有自主知识产权的优异品种,推动我国火龙果产业健康可持续发展。
参考文献
[1] 蔡永强, 向青云, 陈家龙, 等. 火龙果的营养成分分析[J]. 经济林研究, 2008, 26(4): 53-56.
[2] Ariffin A A, Bakar J, Tan C P, et al. Essential fatty acids of pitaya (dragon fruit) seed oil[J]. Food Chemistry, 2009, 114 (2): 561-564.
[3] Nurliyana R, Syed Zahir I, Mustapha Suleiman K, et al. Antioxidant study of pulps and peels of dragon fruits: A comparative study[J]. International Food Research Journal, 2010, 17: 367-375.
[4] Wu L C, Hsu H W, Chen Y C, et al. Antioxidant and anti-proliferative activities of red pitaya[J]. Food Chemistry, 2006, 95(2): 319-327.
[5] 李兴华. 21世纪保健食品——火龙果[J]. 云南农业, 2001(7): 14.
[6] 王凤格, 易红梅, 赵久然, 等. 植物品种鉴定DNA指纹方法总则: NY/T 2594—2014[S]. 北京: 中国农业出版社, 2014.
[7] 程本义, 施勇峰, 沈伟峰, 等. 水稻品种DNA指纹检测技术体系及其应用[J]. 杂交水稻, 2008, 23(1): 54-59.
[8] 王凤格, 赵久然, 戴景瑞, 等. 玉米品种DNA指纹数据库构建的标准化规范[J]. 分子植物育种, 2007, 5(1): 128-132.
[9] 李根英, Susanne D, Marilyn L W, 等. 小麦指纹图谱数据库的建立及SSR分子标记试剂盒的研发[J]. 作物学报, 2006, 32(12): 1771-1778.
[10] 徐 群, 魏兴华, 庄杰云, 等. 水稻品种鉴定技术规程SSR标记法: NY/T 1433—2014[S]. 北京: 中国农业出版社, 2014.
[11] 王凤格, 易红梅, 赵久然, 等. 玉米品种鉴定技术规程SSR标记法: NY/T 1432—2014[S].北京: 中国农业出版社, 2014.
[12] 廖 琴, 陈应志, 邱丽娟, 等. 大豆品种纯度鉴定技术规程SSR分子标记法: NY/T 1788—2009[S]. 北京: 中国农业出版社, 2009.
[13] 赵昌平, 支巨振, 邱 军, 等. 主要农作物品种真实性SSR分子标记检测普通小麦: NY/T 2859—2015[S]. 北京: 中国农业出版社, 2015.
[14] Limei Pan, Jiaxin Fu, Rong Zhang, et al. Genetic diversity among germplasms of pitaya based on SSR markers[J]. Scientia Horticulturae, 2017, 225: 171-176.
[15] 楊仕美, 乔 光, 毛永亚, 等. 基于火龙果转录组测序的SSR标记开发及种质亲缘关系分析[J]. 分子植物育种, 2018, 16(24): 8096-8110.
[16] 刘丽华, 刘阳娜, 张明明, 等. 我国75份小麦品种SNP和SSR指纹图谱构建与比较分析[J]. 中国农业科技导报, 2020, 22(5): 15-23.
[17] 赵久然, 王凤格, 易红梅, 等. 我国玉米品种标准DNA指纹库构建研究及应用进展[J]. 作物杂志, 2015(2): 1-6.
[18] 魏中艳, 李慧慧, 李 骏, 等. 应用SNP精准鉴定大豆种质及构建可扫描身份证[J]. 作物学报, 2018, 44(3): 315-323.
[19] 赵仁欣, 李森业, 郭瑞星, 等. 利用SNP芯片构建我国冬油菜参试品种DNA指纹图谱[J]. 作物学报, 2018, 44(7): 956-965.
责任编辑:沈德发
