欧李再生和遗传转化体系的研究进展
2021-07-19郎绍裕任静王迪笈小龙宋兴舜
郎绍裕 任静 王迪 笈小龙 宋兴舜
摘要: 通过总结近年来对欧李再生体系和遗传转化体系的研究结果发现:1.带有芽点的茎段是构建无性系的主要材料;2.叶片更适合诱导愈伤组织产生;3.培养基中添加细胞分裂素和生长素的比例接近时有利于诱导愈伤组织产生,比例升高时会促进愈伤组织的分化;4.单独添加生长素可以诱导生根;5.欧李遗传转化的方法是农杆菌介导法。同时总结和讨论了影响欧李再生率、转化率的主要因素。
关键词: 欧李; 组织培养; 植株再生; 遗传转化; 外植体
中图分类号: S 662. 5 文献标识码: A 文章编号:1001 - 9499(2021)03 - 0033- 05
欧李(Cerasus humilis (Bge.) Sok.)是我國特有的一种蔷薇科樱属多年生小灌木,也是实施“退耕还林”的重要树种之一,具有重要的生态价值。欧李适应性强,耐干旱、耐贫瘠、耐盐碱,对生长环境要求较低,具有短期内速生繁殖等优点[ 1 ]。其果实颜色鲜艳,含有丰富的天然活性钙,是一种具有代表性的药食两用水果[ 2 ]。同时其种仁中药称之为郁李仁,具有润肠通便,下气利水的功效[ 3 ]。现阶段对于欧李幼苗栽培,果实加工,新品种培育的研究已经取得了极大的成果,但是对其抗逆机理等分子生物学问题深入研究较少,主要还是因为当前欧李的再生和遗传转化体系构建不够完善,可重复性较差。基于此,本文对近年来相关研究进行归纳和总结,以期为当前欧李再生和遗传转化时遇到的再生率、转化率低下等问题提供一些参考,旨在为建立欧李快速、高效的再生和遗传转化体系提供理论依据。
1 欧李再生体系和遗传转化体系研究进展
近年来,已有较多欧李品种的再生体系和遗传转化体系的研究。本文将从建立无性系、愈伤组织诱导、诱导不定芽产生和增殖、生根、驯化移栽、遗传转化等方面对当前的研究进行总结。
1. 1 建立无性系
1. 1. 1 外植体消毒条件
不同欧李品种、不同外植体的消毒条件大致相同。主要步骤是用清水冲洗外植体(可以加入洗衣粉或洗洁精),用0.05%~2%NaClO 或0.1%HgCl2(有时也加入吐温)、75%的酒精进行消毒,用无菌水涮洗干净,最后用无菌滤纸吸干水分备用[ 4 - 8 ]。
1. 1. 2 培养条件
再生体系建立的培养条件就是给外植体提供光照、温度和湿度适宜的环境以促进外植体的生长。培养条件为:温度(25±2)℃,光照强度1 000~ 3 000 lx,光照时间12~16 h/d,空气相对湿度60%左右 [ 9 - 12 ]。
1. 1. 3 初代培养基和增殖培养基
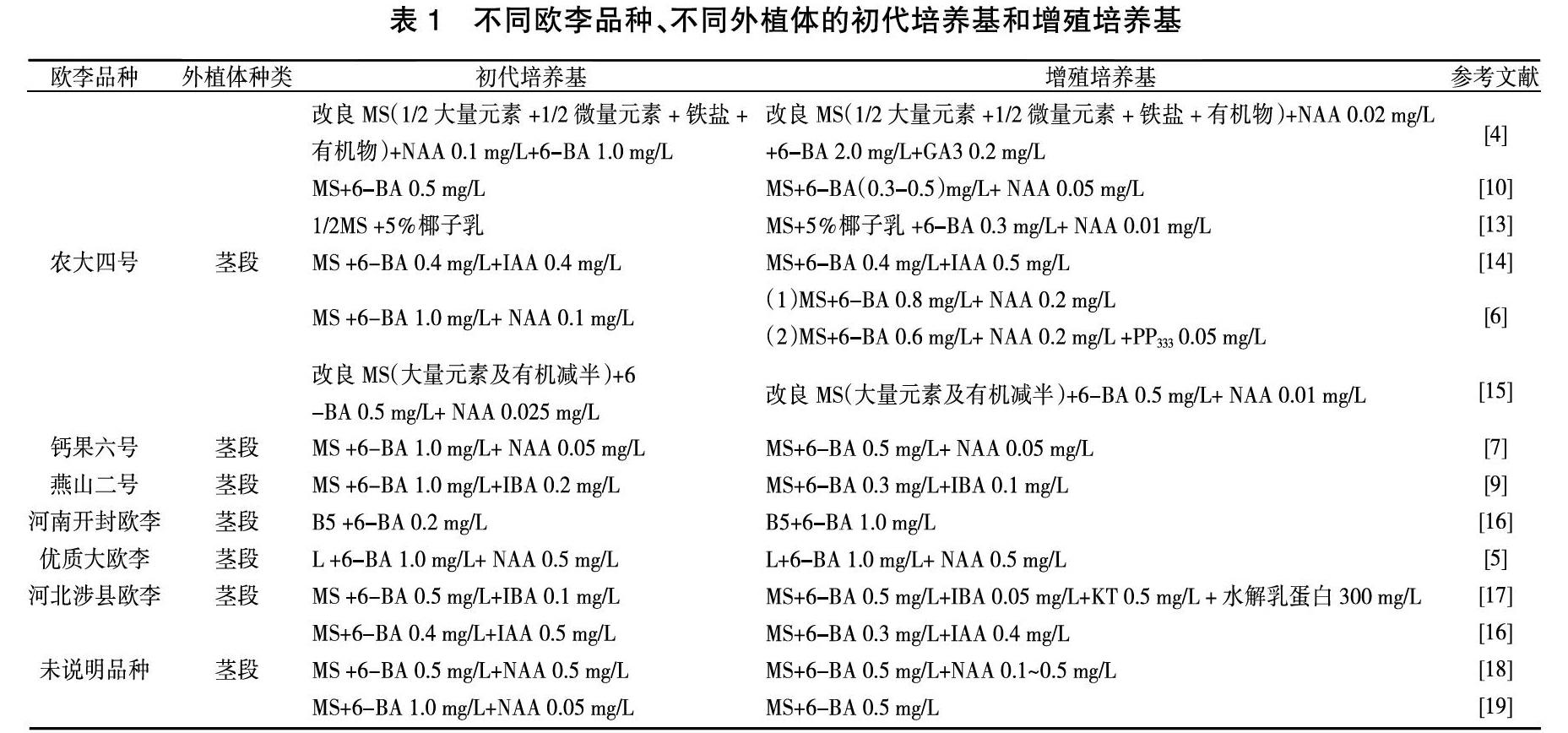
初代培养基也称启动培养基,是外植体消毒后第一次接种的培养基,用来筛选无菌苗。将初代培养基筛选后得到的第一批无菌苗转入增殖培养基中扩繁,建立无性系,可以为之后的实验提供足够的无菌材料。近年来研究结果中初代培养基和增殖培养基的配方总结如表1所示,培养基中添加的蔗糖量为20~40 g/L、琼脂量为5~8 g/L,pH为5.6~
6.0,继代周期为1个月左右。
1. 2 愈伤组织诱导
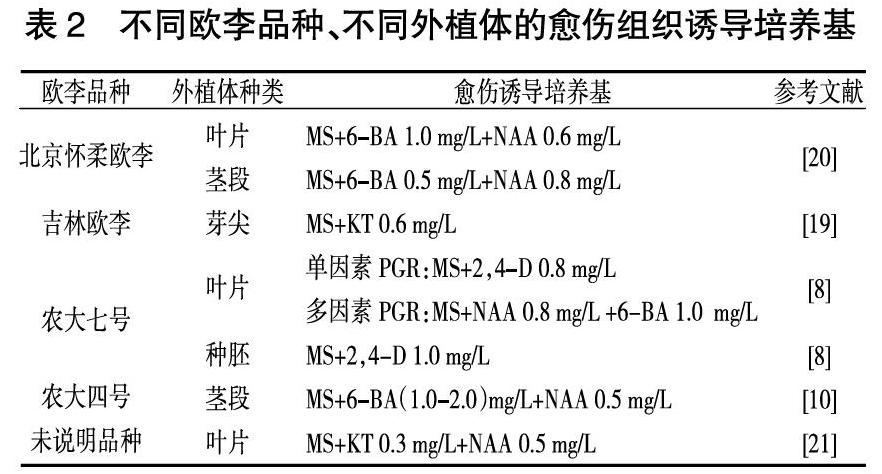
将无菌外植体接入愈伤诱导培养基中诱导其中的活细胞恢复全能性,转变为分生细胞,分生细胞分化为薄壁组织最终形成愈伤组织。诱导产生愈伤组织是分化生成完整植株的前提。由表2可知,不同欧李品种用来诱导愈伤的外植体各有不同,但是利用叶片诱导愈伤组织,诱导率可达95%以上,培养基中添加的蔗糖量为20~40 g/L、琼脂量为5~8 g/L,pH为5.6~6.0。
1. 3 不定芽的诱导和增殖
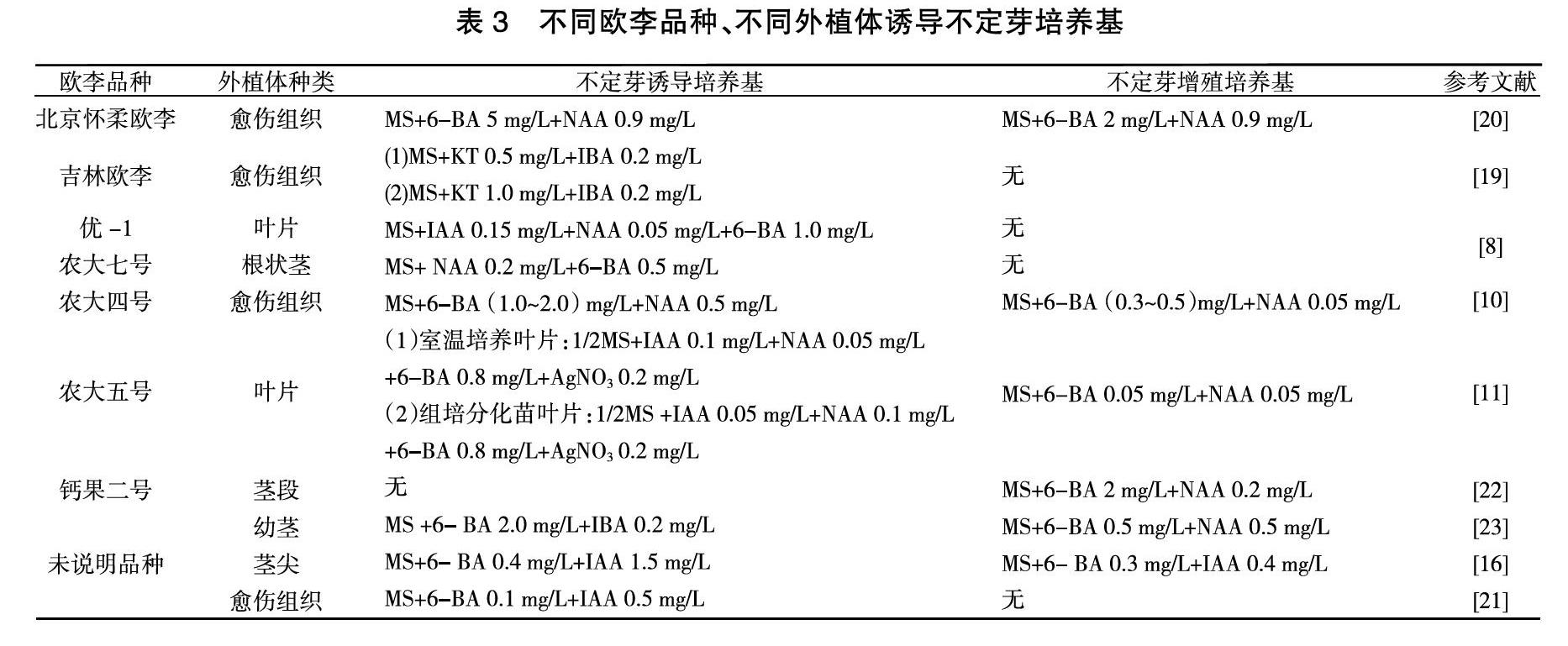
不定芽就是从通常不形成芽的组织或者器官上生出芽,这些部位如:愈伤组织、叶、根等。由于在选取植物的器官或组织离体培养时,难以形成定芽,这时就需要诱导产生不定芽来发育成为一个完整的植株。通过诱导产生的不定芽,往往是单个或者少数几个,这时就需要对不定芽进行增殖培养,形成不定芽丛来为后续研究提供足够的材料。由表3可知,利用愈伤组织分化产生不定芽是不定芽获取的常规手段,愈伤组织分化稳定,且分化率高。培养基中添加的蔗糖量为20~40 g/L、琼脂量为5~8 g/L,pH为5.6~6.0。
1. 4 诱导生根
无菌苗能否顺利驯化移栽,建成再生体系,无菌苗是否生根起着决定性作用。无菌苗生根以后,汲取养分会更快,植株的生长也会加快,继代培养的苗也会更加强壮。
庄丽娟[ 5 ]使用L培养基为基本培养基对“优质大欧李”的无菌苗进行生根诱导,单独添加了不同浓度的IAA、NAA、IBA和6-BA来诱导植株生根,通过统计和观察生根情况,找出诱导欧李生根的最适培养基。结果发现在添加了IAA、NAA和IBA的L培养基中无菌苗均可以生根,IAA和NAA随着浓度的提高生根率也有所提高,但IBA的生根效果不是很好。虽然NAA的生根率最高,但是会在茎基部形成愈伤组织,生出短而粗的根,且植株生长缓慢,叶片发黄;当IAA的浓度达到1.0 mg/L时也会在茎基部出现愈伤组织,但是IAA浓度降低为0.5 mg/L时,茎基部很少再出现愈伤组织,生根率也可以达到83.3%,且可生出侧根,植株长势较好。在加入6-BA的培养基中,没有生根苗的出现,但是植株长势良好,验证了细胞分裂素在欧李生根时不起作用,但有益于植株的营养生长。综合考虑选用添加了0.5 mg/L IAA来诱导继代培养的组培苗生根。陈书明等[ 6 ]以1/2MS培养基为基本培养基对“唐山欧李”和“九渡河欧李”进行生根诱导时发现,在添加生长素之后,再加入0.05 mg/L PP333(多效唑),生根率明显提高,同时高浓度的IBA会导致分化幼苗变黄,从而无法生根;张建英[ 9 ]以“燕山二号”欧李为材料,在诱导生根时发现把幼苗接入生根培养基培养4~6天后,再转接入不含激素的1/2MS培养基中培养,可减少愈伤组织的产生,有利于植株的生长;周金梅等[ 24 ]以“吉林欧李”为材料摸索出的最适生根培养基为1/2MS+0.2mg/L NAA,通过观察发现1周左右的生根时间对于欧李后期生长最为有利;Mu等[ 25 ]以“99-02”欧李为材料摸索出的最适生根培养基为1/2MS+0.8mg/L IAA;孙新政等[ 4 ]、范小峰等[ 10 ]、徐萍等[ 13 ]、王正德等[ 16]以“农大4号”欧李为材料,1/2MS为基本培养基加入生长素来诱导无菌苗生根,孙新政除此之外还添加了0.02mg/L KT、徐萍还添加了1%的椰子乳来促进无菌苗生根。
综上所述,诱导无菌苗生根的最适条件为:以1/2MS培养基为基础培养基,单独添加生长素,其中培养基中添加的蔗糖量为20~40g/L、琼脂量为5~8g/L,pH为5.6~6.0。
1. 5 驯化移栽
欧李再生体系建立的最后一步就是驯化移栽组培的幼苗。驯化移栽的步骤主要是先对组培幼苗进行驯化锻炼、基质培养,逐步恢复其自养功能,然后移栽到自然环境中幼苗可以自养成活。
韩向峰等[ 11 ]利用光培炼苗、闭瓶炼苗和开瓶炼苗的方法对植株复壮,瓶内炼苗后将生根苗移至用1 000倍多菌灵液清洗消毒后的基质(深层土+泥炭+河沙+珍珠岩)上完成驯化;最后当苗在基质上长至5~8 cm,基部开始半木质化,根系变为褐色,有大量毛细根产生时,将幼苗移栽到营养杯;经过30天的生长后,去掉营养杯带土坨移栽到大田中,成活率为77.5%。赵昌亮等[ 26 ]将苗置于太阳光下照射3~7天,然后开盖培养3~5天,洗去根部培养基,将试管苗在15~20 ppm 的多菌灵稀液中浸蘸 3~5 s ,然后移入营养钵基质中培养90~120天,最后定植于大田中,成活率达85%以上。曹琴等[ 27 ]在光培炼苗过程中,闭瓶炼苗10天、开瓶炼苗3天,光照强度为0.6~0.9 wlx;移栽的生根幼苗采用0.1%多菌灵药液浸泡10 min,移栽基质采用pH 7.29~7.39,Ec值为0.30×103~0.36×103 mS/cm的混合基质和原生土基质;移栽基质用0.2%的五氯硝基苯灭菌或 125 ℃高温灭菌;基质炼苗45~50天后进行营养钵移栽。刘春颖等[ 23 ]在幼苗达到3叶以上时进行移栽,先闭瓶进行强光锻炼,把三角瓶移至光照强度20~35 klx下,继续培养10天左右,然后将组培苗去盖移至通风阴凉处,开瓶炼苗2~5 天,在表面出现大量杂菌前取出小苗,洗净根部培养基,移栽到温室装有蛭石、珍珠岩和草炭基质(比例为1∶1∶1)的穴盘中,扣上塑料薄膜保温,加扣遮阴网;温度控制在22~25 ℃,保持空气相对湿度90%左右,7~8天后逐渐通风,再炼苗5天后,可完全放开;10天浇1次营养液,保证此期间的养分供应,成活率为85%以上。当穴盘内幼苗长到5 cm左右时,移至装有营养土的营养钵(8 cm×8 cm)内,营养土的构成为大田土、腐熟农家肥、腐殖土各占1/3,并拌入防病菌的药剂,加扣遮阴网,浇透水,保持空气湿度 80%左右。当营养钵内幼苗长至15~20 cm左右时,定植到生产田。
1. 6 遗传转化
通过对蔷薇科果树离体再生于遗传转化研究进展的总结发现[ 28 ],蔷薇科果树通过转基因改善的性状主要集中在抗性方面,而且运用的都是农杆菌介导的遗传转化体系。山西农业大学杜俊杰教授课题组于2016年发表了农杆菌介导的欧李遗传转化体系,选取组培苗腋芽生长出的1~2 cm叶子,用作外植体再生和转化实验;将构建好的载体用电穿孔法转入LBA4404农杆菌中;确定叶片对于卡那霉素的耐受性为15 mg/L;将叶片浸于农杆菌菌液(OD600=0.6)7 min后用无菌滤纸吸干菌液;然后在25 ℃的黑暗環境下共培养3天;将共培养的外植体进行脱菌处理移入M4培养基中进行抗性的筛选和芽系的诱导;采用GUS分析和PCR分析进行转基因的验证;最终对确定转基因的幼苗进行生根诱导,最终获得转基因株系[ 25 ]。
2 讨 论
2. 1 影响再生率的原因
欧李再生体系建立在当前来看并不完善,体系的可重复性差。总结影响再生率的原因可能有以下几点:
(1)基因型与外植体
欧李广泛分布在我国多个省市自治区,具有多个不同的野生品种和培育品种,且不同品种的基因型不同,生长习性不同,种间差异明显,所以组织培养的条件也不相同。叶片、茎段、子叶、胚轴等多种外植体在蔷薇科果树离体再生中均有应用[ 28 ]。例如秦伟[ 29 ]研究了新疆苹果以不同器官为外植体的愈伤组织诱导率,其幼茎的诱导率高于叶、子叶,而诱导根则无愈伤组织形成;范小峰等[ 10 ]利用钙果四号的茎段进行愈伤组织诱导;而武莎莎[ 8 ]则是利用农大七号的叶片来进行愈伤组织诱导。
(2)植物生长调节剂
基本培养基是保证外植体生存与生理活动的最基本物质,而细胞分裂的启动、培养物的形态建成、芽的分化和跟的形成则离不开植物激素的诱导调节[ 30 , 31 ]。在植物组织培养的过程中,细胞分裂素和生长素是常用的植物生长调节剂,通过控制二者的配比来达到定向诱导植物组织形成和发育的目的。单独使用IBA对于植物生根有一定的帮助[ 14 , 21 ]。2. 2 影响转化率的原因
关于欧李遗传转化体系的报道较少,现阶段取得一定成果的是山西农业大学杜俊杰教授的团队。其他研究人员对于欧李基因功能的研究还是在转化异源植物,重要的原因就是自己开发的体系转化效率低下无法达到实验要求,这是所有蔷薇科植物面临的共同问题。影响转化率的原因有以下几点:
(1)外植体类型
孙华军等[ 32 ]认为外植体类型是转化的主要影响因素。不同来源和发育状态的受体都会对农杆菌的侵染产生较大影响。
(2)农杆菌菌株类型、浓度和浸染时间
通过查阅文献发现,当前蔷薇科植物的遗传转化方式大多都是由农杆菌介导的。用于遗传转化的农杆菌菌株有多种,不同菌株的侵染能力不同,并因果树种类而异。蔷薇科果树遗传转化时农杆菌菌液浓度多为A600=0.2~1.0,侵染时间因菌株和果树种类不同而异[ 28 ]。Oosumi等[ 33 ]在草莓的遗传转化过程中分别使用了GV3101和LBA4404两个菌种侵染外植体,两个菌种浸染时间分别为20 min和24 h。
(3)筛选剂的种类和浓度
与其他植物类似,蔷薇科果树转基因研究常用的标记基因是NptⅡ,对应的抗性筛选剂为卡那霉素[ 28 ]。不同品种、不同外植体和不同生长时期的植物对抗生素的敏感程度不同,因此要根据实际情况选择筛选剂的浓度。
(4)共培养条件
共培养就是将处于对数生长期的菌液和受体在同一环境中培养,利用细菌侵染受体,从而达到将T-DNA整合到受体基因组中的目的。除了常用方法以外,共培养时可以加一些酚类物质和渗透保护剂来提高转化效率。蔷薇科果树遗传转化通常也在外植体与农杆菌共培养时,加入或提前加入乙酰丁香酮(As)于菌液中[ 28 ]。
3 展 望
欧李作为潜在价值巨大的药食两用植物,近些年对其幼苗栽培、果实加工、新品种培育的研究已经取得了极大的成果,但是深入的分子生物学研究还处于起步阶段。究其根本,转化率和再生率低下仍是欧李相关产业发展所面临的瓶颈问题。建立欧李快速、高效的再生和遗传转化体系,在欧李品种改良、了解其抗逆机制发挥其更大的生态价值以及基因功能研究中起着重要作用。相信随着再生体系和遗传转化体系的深入研究和发展,同时借鉴成熟的蔷薇科植物遗传转化体系的研究成果,瓶颈终将被打破,欧李相关产业也会得到长足的进步和发展。
参考文献
[1] 张东为, 贾天会, 舒乔生. 水保优良树种欧李的研究进展及今后研究方向[J]. 中国水土保持, 2012(1): 45-47.
[2] Fan S, Wu P, Xing G. Nutritional Composition and Development of Chinese Dwarf Cherry (Cerasus Humilis (Bge.) Sok.)[J]. International Journal of Nutrition and Food Sciences, 2019, 8(2): 49-52.
[3] 孙萌. 欧李果实不同发育阶段糖酸动态变化及其种仁药材品质评价研究[D]. 北京: 北京中医药大学, 2017.
[4] 孙新政, 申顺先, 李庆伟, 等. 钙果4号欧李组织培养技术研究[J]. 果树学报, 2007(1): 80-83.
[5] 庄丽娟. 欧李快速繁殖技术体系研究[D]. 呼和浩特: 内蒙古农业大学, 2005.
[6] 陈书明, 姜英淑, 王秋玉. 欧李组培快速繁殖体系的建立[J]. 林业科技, 2008(2): 59-62.
[7] 李琳琳. 钙果6号组织培养技术研究[J]. 林业实用技术, 2010(5): 29-30.
[8] 武莎莎. 欧李愈伤组织诱导及不定芽再生体系的优化[D]. 太原: 山西农业大学,2018.
[9] 张建英. 燕山2号欧李组织快繁技术研究[J]. 河北林业科技, 2011(5): 12-13.
[10] 范小峰, 田兴旺. 钙果4号愈伤组织的诱导和植株再生[J]. 林业实用技术, 2008(6): 8-10.
[11] 韩向峰, 李志芳, 曹琴, 等. 农大5号钙果叶片芽诱导及其植株再生研究[J]. 广东农业科学, 2018, 45(8): 37-42+32.
[12] 薛麗萍, 赵昌亮, 马颢玲, 等. 钙果组培育苗技术研究[J]. 山西水土保持科技, 2005(4): 21-22.
[13] 徐萍, 谭剑锋. 钙果苗木组培技术初探[J]. 林业科技开发, 2008(5): 78-80.
[14] 贾明仁, 张明伟. 钙果组织培养育苗技术研究[J]. 北方果树, 2008(6): 11-13.
[15] 郭劲鹏. 欧李组织培养快繁技术[J]. 中国林副特产, 2012(5): 83-84.
[16] 王正德, 王大钟. 欧李幼茎组织培养的初步研究[J]. 河南大学学报(自然科学版), 2006(2): 71-72.
[17] 梁伟玲, 陈翠果, 孟繁祎, 等. 欧李优系组培快繁技术研究[J]. 湖北农业科学, 2019, 58(6): 136-139.
[18] 钟士传, 杜启兰. 钙果的组织培养技术[J]. 农业科技通讯, 2004(8): 18.
[19] 胡延生, 姜继发, 建德锋. 欧李愈伤组织诱导及分化研究[J]. 吉林农业科学, 2015, 40(6): 98-100.
[20] Wang R F, Huang F L, Zhang J, et al. Establishment of a high-frequency regeneration system in Cerasus humilis, an important economic shrub[J]. Journal of Forest Research, 2016,
21(5): 244-250.
[21] 杜研, 李毅, 王娅丽, 等. 钙果愈伤组织诱导和植株再生的研究[J]. 西北农业学报, 2007(5): 222-226.
[22] 徐立, 李志英. 钙果不定芽生根诱导研究[J]. 安徽农业科学, 2008(29): 12 585-12 586.
[23] 刘春颖, 孙伯铮, 冉学忠. 欧李的组培快繁与移栽技术研究[J]. 现代农业科技, 2008(8): 11+13.
[24] 周金梅, 吕忠仁, 建德锋. 欧李组培苗的扩繁与生根出瓶移栽技术研究[J]. 吉林农业科学, 2012, 37(6): 51-52+55.
[25] Mu X P, Liu M, Wang P F, et al. Agrobacterium-mediated transformation and plant regeneration in Chinese dwarf cherry [Cerasus humilis(Bge.) Sok][J]. Journal of Horticultural Science & Biotechnology, 2016, 91(1): 71-78.
[26] 赵昌亮, 薛丽萍, 马颢玲, 等. 钙果组培苗炼苗与移栽研究[J]. 山西水土保持科技, 2005(4): 23-24.
[27] 曹琴, 杜俊杰. 欧李组培苗移栽成活影响因子的研究[J]. 山西农业大学学报(自然科学版), 2009, 29(3): 238-242.
[28] 李坤坤, 徐昌杰. 蔷薇科果树离体再生与遗传转化研究进展[J]. 园艺学报, 2017, 44(9): 1 633-1 644.
[29] 秦伟. 新疆野苹果繁育特性及种质资源亲缘关系研究[D]. 乌鲁木齐: 新疆农业大学, 2010.
[30] 吴静妍, 葛新新, 李海英, 等. 蔷薇科果树组织培养研究进展[J]. 安徽农业科学, 2020, 48(21): 10-12.
[31] Buzkan N, In-Mendi Y, Terlizzi B. CLONAL PROPAGATION OF DISEASE-FREE ROOTSTOCKS FOR SOUR AND SWEET CHERRY BY MERISTEM CULTURE[J]. Acta Horticulturae, 1997(441): 329-332.
[32] 孫华军, 李国瑞, 陈永胜, 等. 农杆菌介导的植物遗传转化影响因素研究进展[J]. 安徽农业科学, 2015, 43(24): 26-27+77.
[33] Oosumi T, Gruszewski H A, Blischak L A, et al. High- efficiency transformation of the diploid strawberry (Fragaria vesca) for functional genomics[J]. Planta, 2006, 223(6): 1 219- 1 230.
第1作者简介: 郎绍裕(1995-), 男, 在读硕士研究生, 主要研究方向为欧李遗传转化体系的构建。
通讯作者: 宋兴舜(1978-), 男, 教授, 博士生导师, 主要研究方向为植物逆境生理与分子生物学。
收稿日期: 2020 - 10 - 28
(责任编辑: 张亚楠)
