香菇菌种生产中木霉侵染过程研究
2021-07-16刘作易刘永翔谭玉梅
王 莹, 刘作易, 冯 瑶, 刘永翔 谭玉梅
(1.贵州大学农学院, 贵阳 550025; 2.贵州省农业科学院, 贵阳 550006;3.贵州省农业生物技术重点实验室, 贵阳 550006; 4.贵州省生物技术研究所, 贵阳 550006)
在食用菌生产过程中,菌种是人工培育与繁殖用于科学研究与实际生产中的纯菌丝体[1]。菌种生产对食用菌产业发展有着极为重要的作用,能直接影响食用菌产品品质和产量。目前,食用菌主要以长菌棒栽培、大棒小棚、短棒多层、压块等方式生产。现代农业中,食用菌生产已形成工厂化、周年化高密度模式,在一定程度能减少栽培过程中病虫害发生,可一旦病虫害出现,就会造成巨大损失[3]。一直以来,菌种生产过程中木霉菌的侵染都是十分严重且急于解决的问题。
木霉属(Trichodermaspp.)真菌生长快、传染性强、适应性极广,在病原真菌生物防治上发挥了重要作用,但也是食用菌菌种生产中主要侵染菌,成为目前国内外食用菌菌种生产研究的热点[5]。由于木霉菌与食用菌菌种生长发育有很多相同特性,防治较为困难,轻则减少出菇产量,重则导致菌种报废或整床食用菌培养料毁坏[6]。在香菇栽培过程中也常常遭受哈茨木霉(T.harzianum)、绿色木霉(T.viride)等侵染[7]。由于栽培料灭菌不彻底,导致栽培料中携带木霉孢子萌发菌丝,木霉菌生长速度是香菇菌丝的3~5倍,容易造成香菇菌种受害,每年平均发病率在8%左右,损失率40%~50%,严重的甚至绝收[8]。
贵州近几年把食用菌生产作为脱贫攻坚重要手段,其种植业发展极为迅速。香菇是贵州食用菌种植主要品种之一,在其菌种生产中出现严重的木霉菌污染,对香菇种植业造成巨大影响。针对病原不清,侵染过程不明等问题,本实验从贵州省内5个香菇种植基地菌种受害培养料中分离病原菌,通过形态学特征结合 ITS 、TEF-1α以及RPB 2序列进行分析,通过对峙培养、显微观察以及木霉代谢物、挥发性产物等实验对香菇菌丝的抑制作用研究,以期为香菇菌种生产过程中木霉的防治提供参考。
1 材料与方法
1.1 实验材料
1.1.1供试菌株
香菇(Lentinulaedodes)0912由贵州省贵阳市白云区蒙台食用菌种植基地提供。
受污染菌棒培养物:于贵州省贵阳市乌当区尧上食用菌基地,白云区蒙台食用菌基地,贵安新区洋塘食用菌基地,安顺市平坝区唐约食用菌基地,黔东南州台江市排羊食用菌基地采集所得。菌株保存于贵州省微生物菌种保存中心,编号GZCC 21-0004。
1.1.2培养基与试剂盒
PDA:马铃薯(去皮)200 g,葡萄糖20 g,琼脂粉16 g,H2O 1 000 mL,保留自然pH,121 ℃高压灭菌20 min。
PDB:马铃薯(去皮)200 g,葡萄糖20 g,H2O 1 000 mL,保留自然pH,121 ℃高压灭菌20 min。
Ezup柱式真菌基因组DNA抽提试剂盒(上海生工)。
1.2 实验方法
1.2.1病原分离
采集的菌棒培养物置于4 ℃保存,稀释涂布平板法分离病原:装有99 mL无菌水锥形瓶中加入受污染香菇菌棒内栽培物1 g,180 r·min-1摇床上震荡30 min后取出静置10 min,取1 mL上清液用装有9 mL无菌水的试管依次稀释至10-7S·mL-1,选取100 μL 10-5、10-6、10-7S·mL-1浓度菌液涂布至PDA平板于26 ℃培养1~3 d后,将单菌落转移至新平板培养,每个浓度5个重复。选出有抑制作用菌株进行纯化鉴定[9]。
1.2.2病原鉴定
PCR扩增引物分别为ITS 1和ITS 4[10]、TEF 1-728 F和TEF 1 LLErev[11]、RPB 2-5 F和RPB 2-7 R[12],序列见表1。配制25 μL的PCR反应体系,扩增后产物用1.0%的琼脂糖进行凝胶电泳检测,检测条带单一后送至上海生工生物工程有限公司进行测序。将测序结果在NCBI数据库中进行比对,下载相关序列并构建系统发育树,结合形态学鉴定分离菌株。

表1 扩增序列引物及其序列Table 1 Amplified sequence primers and their sequences
1.2.3培养皿对峙
两端对峙:PDA平板一端接种香菇菌丝块,26 ℃下培养4 d后在另一端接种病原菌菌丝块,共培养至两种菌丝相遇,观察对峙情况。以只接种香菇菌,不接种病原菌为对照,计算菌丝生长抑制率[13]。
抑制率(%)=[(对照香菇菌丝生长半径-接种病原后香菇菌丝生长半径)/对照香菇菌丝生长半径]×100%。
重复对峙:PDA平板中央上接种香菇菌,长满平板后在距中央20 mm左右分别接种4个病原菌菌丝块。以只接种香菇菌丝块,不接种病原菌菌丝块为对照计算菌丝生长覆盖率。以上处理均为3个重复。
覆盖率(%)=(病原菌丝生长直径/香菇菌丝生长直径)×100%。
1.2.4菌棒回接
打孔器取5块病原菌菌丝块接入PDB培养基中,摇床180 r·min-1室温培养5 d,纱布过滤获得病原菌孢子液,稀释到合适浓度4 ℃保存备用。取健康香菇菌棒分别接种5块病原菌菌丝块以及注射500 μL病原菌孢子液,每个处理5个重复,另设不接种菌丝块以及注射无菌蒸馏水为对照[14]。
1.2.5载玻片对峙
无菌载玻片上涂一层厚约1 mm的PDA培养基,在载玻片的一端接种直径5 mm香菇菌丝块,封口后置于26 ℃下暗培养。4 d后在距香菇菌丝块4 cm处接种直径5 mm的病原菌菌丝块,继续培养。待病原菌菌丝与香菇菌丝相遇后进行显微观察。以只接种香菇菌不接种病原菌的载玻片作为对照观察[15]。
1.2.6病原发酵代谢物对香菇菌丝的抑制作用
病原菌菌丝块接入液体PDA培养基,摇床28 ℃,115 r·min-1培养5 d。纱布过滤后用0.22 μm过滤器再次过滤得到发酵液,与两倍浓度的固体PDA混合,倒平板,接入香菇菌丝,对照处理加入等量的液体PDA,26 ℃培养,计算抑菌率[16]。以上处理均为3个重复。
1.2.7病原挥发性代谢物对香菇菌丝的抑制作用
病原菌和香菇菌分别接入不同的PDA平板中,去掉平板盖,2个皿底相对扣着,封口膜沿着边缘封口,防止挥发性物质的渗漏。香菇菌一端平板在上,病原菌平板在下,28 ℃培养观察。以不接病原菌处理作为对照,计算抑菌率[17]。以上处理均为3个重复。
2 结果与分析
2.1 病原分离与鉴定
从贵州5个食用菌基地受污染菌棒上分离到相同一株木霉,编号GZCC 21-0004。形态描述(如图1):26 ℃下PDA培养48 h菌落直径达43 mm,呈白色;72 h菌落直径达80 mm,气生菌丝丰富,棉絮状(a),孢子簇束状(b),呈同心圆分布。分生孢子梗对生,极少单生,初次分支几乎为直角,常常2~3个呈旋涡状排列,二次分支复杂,近乎垂直于分支主轴,形成类似金字塔结构(c,d);瓶梗(3.0~3.8)μm安瓶形或是壶形,紧密排列在分支上,典型的在瓶梗顶端强烈收缩变细,基部稍缢缩,顶端收缩程度不等(e~g);分生孢子淡绿色(h),近球形至卵形(2.5~3.0)μm×(2.0~2.5)μm。
序列测定结果表明,GZCC 21-0004菌株ITS、TEF-1α以及RPB 2序列扩增产物长度分别为590 bp、593 bp以及859 bp,经BLAST序列比对结果显示,与T.lentinulae最大相似性达99%,根据同源性最高的原则,从GeneBank分别下载13个近似种26个菌株的3个基因对应序列(见表2),以Trichodermarugulosum(SFC 20180301-001和SFC 20180301-002) 为外群,通过RAxML软件以最大似然法构建系统发育树(如图2)。GZCC 21-0004与T.lentinulae进化上在同一分支且同源性达到99%。结合形态学与分子生物学将GZCC 21-0004鉴定为哈茨木霉(Trichodermaharzianum)复合种下的Trichodermalentinulae。
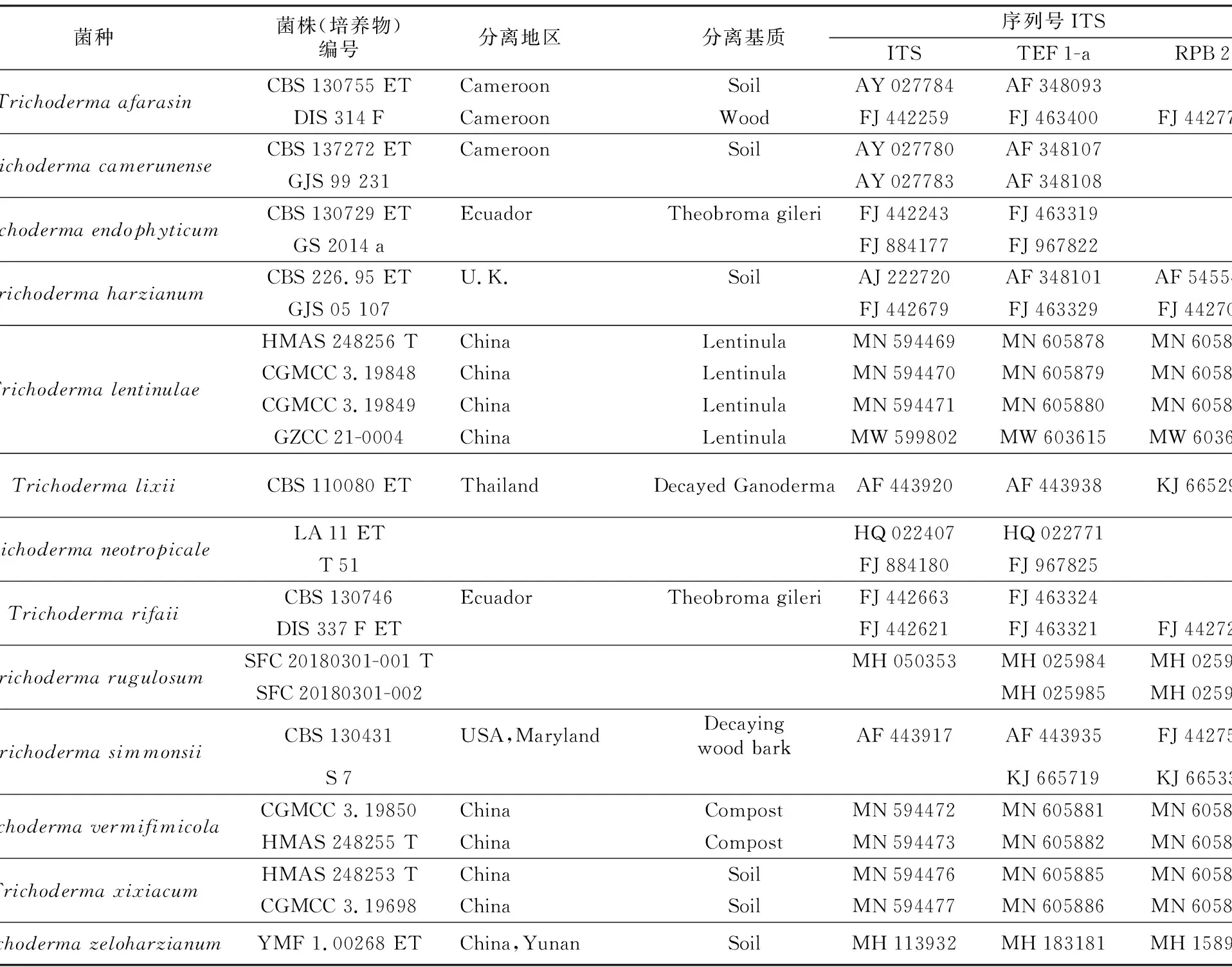
表2 用于系统发育分析的菌种、菌株及其相应的GenBank序列登录号Table 2 Strains and its corresponding GenBank sequence entry number for phylogenetic analysis
2.2 平板对峙
GZCC 21-0004(T.lentinulae)抑制香菇菌丝生长,产生明显拮抗线(图3 a,b),分生孢子和菌丝生长迅速,拮抗线周围培养基变为深褐色,抑制率高达51%(见表3);重复接种后T.lentinulae在长满香菇菌丝的平板上生长,覆盖率为44.8%,且出现明显的拮抗线与平板变色现象(图3 A,B)。
2.3 菌棒回接
健康的香菇菌棒接种GZCC 21-0004(T.lentinulae)菌丝块、注射孢子液后T.lentinulae在菌棒中能快速生长,菌棒出现大量绿色木霉菌丝以及分生孢子,香菇菌丝停止生长,14 d后木霉菌生长至菌棒的三分之二处,产生明显拮抗线,一个月后菌棒内全部长满绿色菌丝及孢子,香菇菌丝生长彻底受抑制,菌棒筒体变软,皱缩,发出异味,溢出黑绿色液体,如图4。
2.4 载玻片对峙
显微观察到GZCC 21-0004(T.lentinulae)侵染香菇菌丝过程分为5个步骤:附生长、缠绕包裹、分泌色素、顶端破裂、中空皱缩。
贴附生长:GZCC 21-0004与香菇菌丝相向生长,两者接触后GZCC 21-0004菌丝分支增多、趋向贴附香菇菌丝生长(图5 A);呈“S”形在香菇菌丝上生长(图5 B);在香菇菌丝上呈螺旋式缠绕生长(图5 C);多根菌丝贴附一根香菇菌丝,或是木霉菌丝绕香菇菌丝一圈后趋向其他香菇菌丝生长进行另一轮侵染(图5 D)。
缠绕包裹:GZCC 21-0004菌丝贴附香菇菌丝后,菌丝弯曲在香菇菌丝上螺旋式不断缠绕,分支大量菌丝趋向缠绕一根香菇菌丝(图6 A);形成一个粗壮的圆柱体形状的菌丝缠绕体,中央包裹着生长完全受限制的香菇菌丝(图6 B,C,D)。GZCC 21-0004通过缠绕侵入香菇菌丝,达到抑制香菇菌丝生长的效果。

注:a为28 ℃培养3 d的菌落形态(PDA);b为分生孢子簇;c~e分别为分生孢子梗和分生孢子;f~g分别为瓶梗和分生孢子;h为分生孢子,标尺:c~g=10 μm,h=20 μm。图1 木霉属菌株(GZCC 21-0004)形态观察Fig.1 Morphological observation of Trichoderma strain (GZCC 21-0004)
分泌色素:GZCC 21-0004缠绕包裹外缘香菇菌丝后,分支向内缘香菇菌丝生长,接触后菌丝顶端变成黄褐色,后分泌一圈黄褐色物质(图7 A)作用于香菇菌丝,导致菌丝出现凹陷,蜷曲,且变得粗糙(图7 B,C),而GZCC 21-0004菌丝依旧粗壮。同时在香菇菌丝上产生深褐色囊泡(图7 D),破裂后渗入培养基。
顶端破裂:在GZCC 21-0004一系列侵染后,香菇菌丝顶端破裂流出透明的菌丝细胞内容物(图8 A,C),香菇菌丝壁出现凹凸不平,变皱缩(图8 B,D)。香菇菌丝出现内容物外泄是由于木霉菌缠绕侵染,胞内膨压增大而导致菌丝顶端破裂,或是受GZCC 21-0004分泌抑菌物质影响,破坏其菌丝结构。
香菇菌丝中空、皱缩:受到GZCC 21-0004菌丝缠绕侵染,抑菌物质影响,香菇菌丝内容物流出后,菌丝中空(图9 A)、皱瘪(图9 B)、透明,出现不规则皱缩(图9 C,D),菌丝彻底丧失生长能力。
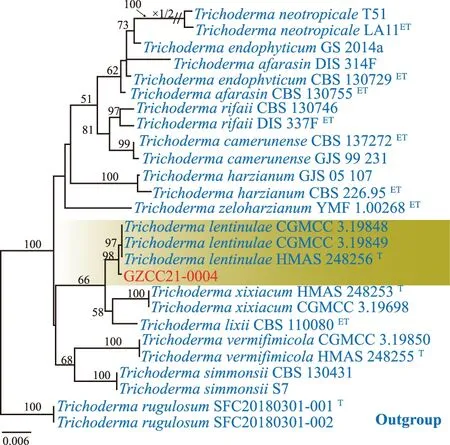
注:RAxML大于50%标注于分支节点上。T 为模式菌株;ET 为模式菌株培养物。本研究分离所得菌株用红色字体表示。图2 GZCC 21-0004 基于ITS,RPB 2和TEF-1 α序列构建的系统发育树Fig.2 Phylogenetic tree of GZCC 21-0004 based on ITS,RPB 2 and TEF-1 α sequences
2.5 病原菌代谢物对香菇菌丝生长的影响
GZCC 21-0004(T.lentinulae)次生代谢产物对香菇菌丝具有一定的抑制作用,抑制率达57%(见表3)。如图10所示,菌丝在含有木霉菌次生代谢产物的培养基上后期生长受限,主要表现为菌丝十分疏松,菌丝间空隙大,菌丝体数量明显减少。

表3 不同处理抑制香菇菌丝生长Table 3 Mycelial growth inhibition of L. edodes by different treatments
2.6 病原菌挥发性产物对香菇菌丝生长的影响
图11所示,GZCC 21-0004(T.lentinulae)的挥发性代谢物对香菇菌丝生长有很高的抑制效果,抑制率高达82%(见表3)。挥发性代谢产物中有能够强烈抑制香菇菌丝生长的物质,在两种菌丝接触之前就能通过挥发性代谢产物首先产生抑制作用,然后接触后再进一步直接性抑制香菇菌丝生长。
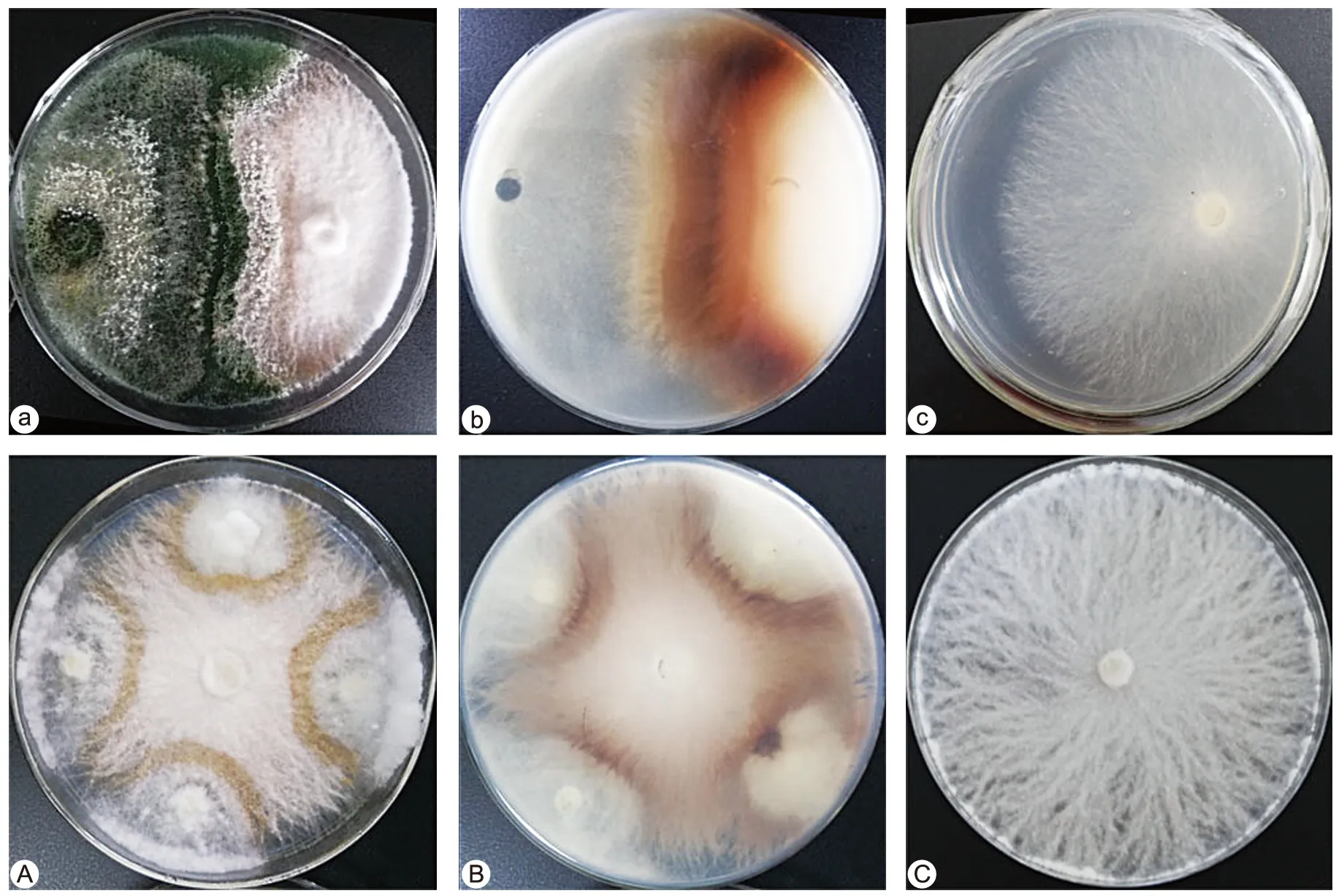
注:a~b为平板接种GZCC 21-0004与香菇菌;c为对照;A~B为在香菇菌平板上重复接种GZCC 21-0004;C为对照。图3 GZCC 21-0004与香菇菌丝对峙培养Fig.3 Confrontation culture of strain GZCC 21-0004 and L. edodes hyphae
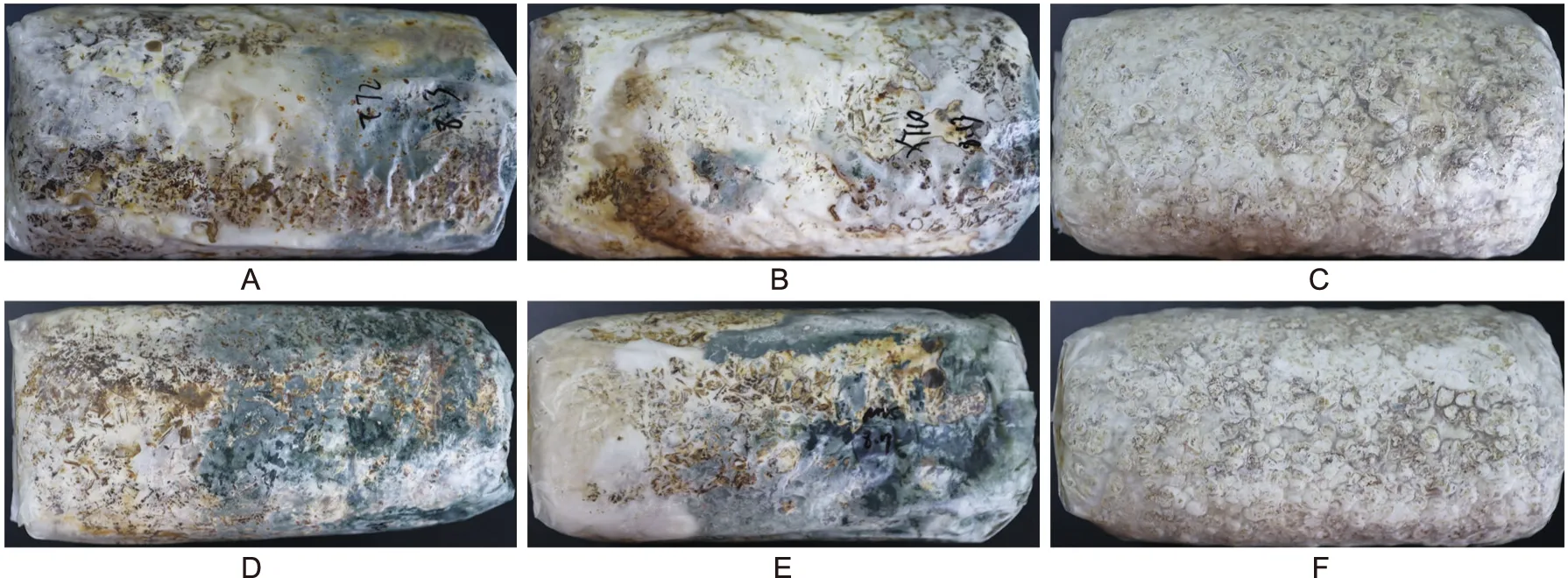
注:A~B为注射GZCC 21-0004孢子液;C为对照;D~E为接种GZCC 21-0004菌丝块;F为对照。图4 健康香菇菌棒回接病原Fig.4 Pathogen-inoculated analysis of healthy L. edodes rod back graft
3 讨 论
本实验从病原分离鉴定到其侵染香菇菌丝过程进行了一个较为完整的系统性研究,从贵州省内受害严重的5个香菇种植基地分离出形态相似的菌株GZCC 21-0004,同时在受害平菇,竹荪培养料中也分离到,结合形态学和分子生物学将GZCC 21-0004鉴定为T.lentinulae,是贵州地区侵染食用菌木霉中的优势菌,也是首次在贵州香菇菌棒上发现。T.lentinulae由顾欣等[18]2020年首次在北京市海淀区香菇栽培物上分离到,但有关T.lentinulae对香菇菌丝的侵染过程并未见报道。

注:黑色箭头标明香菇菌丝,红色箭头标明 GZCC 21-0004菌丝,标尺:A~D=20 μm。下同。图5 GZCC 21-0004菌丝贴附香菇菌丝Fig.5 Attachment of GZCC 21-0004 mycelium to L. edodes hyphae
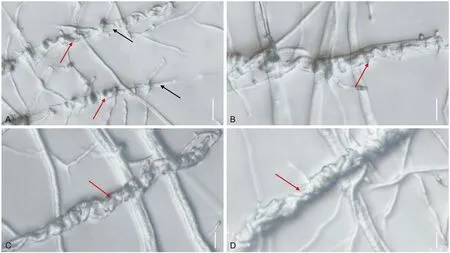
图6 GZCC 21-0004缠绕香菇菌丝体形成棍棒形状Fig.6 Formation of sticks hyphae by wrapping GZCC 21-0004 mycelium with L. edodes hyphae
本研究首次系统地对T.lentinulae侵染香菇菌丝过程进行研究,结果发现侵染过程主要有:
1) 贴附生长:T.lentinulae接触香菇菌丝后有3种生长方式:径直或呈“S”形贴附生长、螺旋形缠绕生长。吴晓金等[19]研究表明,木霉侵染香菇菌丝后缠绕现象只是偶尔出现,因此推测菌丝缠绕不是其侵染食用菌的主要原因。而在本研究中发现,T.lentinulae与香菇菌丝接触后首先贴附生长,然后紧贴香菇菌丝产生螺旋缠绕式生长,是其侵染香菇菌丝的首要方式。
2) 缠绕包裹:与Chet等[20]研究结果不同,本实验发现T.lentinulae菌丝缠绕香菇菌丝过程中没有附着胞出现,而形成一个香菇菌丝在中间,木霉菌丝在外围螺旋形缠绕包裹成棍棒状结构完全限制香菇菌丝生长。
3) 分泌色素:李冠霖等[21]猜想木霉与香菇菌丝对峙培养过程中,拮抗线周围培养基变成深褐色只是由于香菇菌丝产生色素。本研究观察到受T.lentinulae侵染的香菇菌丝上产生深褐色囊泡状结构,后期破裂后囊泡内物质渗入培养基;同时T.lentinulae菌丝在接触香菇菌丝后顶端变成深黄色,且分泌深色物质作用于香菇菌丝表面,导致香菇菌丝表面变粗糙、凹陷,可能存在抑菌物质,如木霉抗菌肽(peptaibols)等[22]。
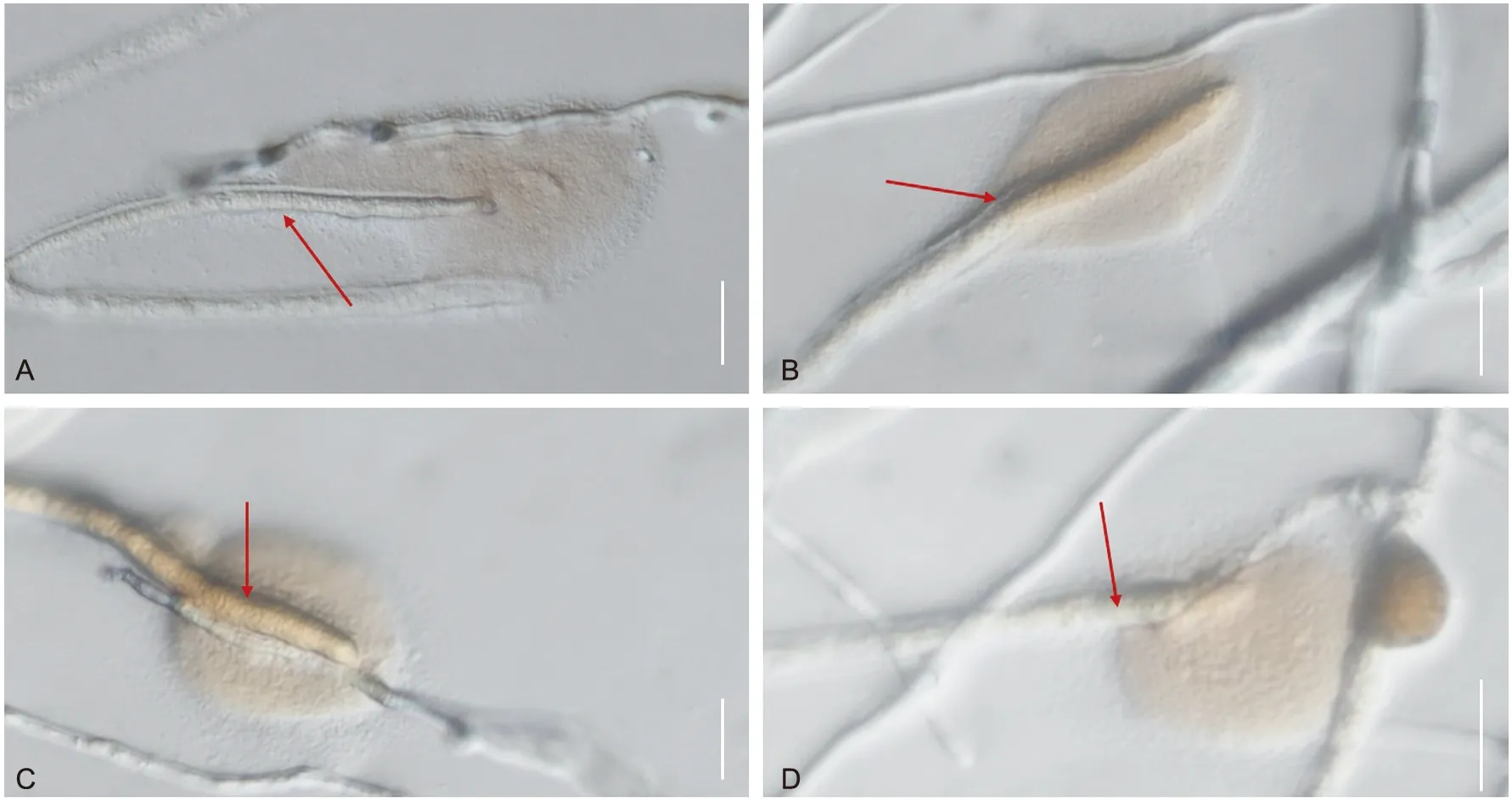
注:红色箭头表示GZCC 21-0004菌丝顶端,标尺:A~D=20 μm图7 GZCC 21-0004菌丝顶端分泌褐色物质Fig.7 Brown substance secretion at the top of the hyphae in strain GZCC 21-0004
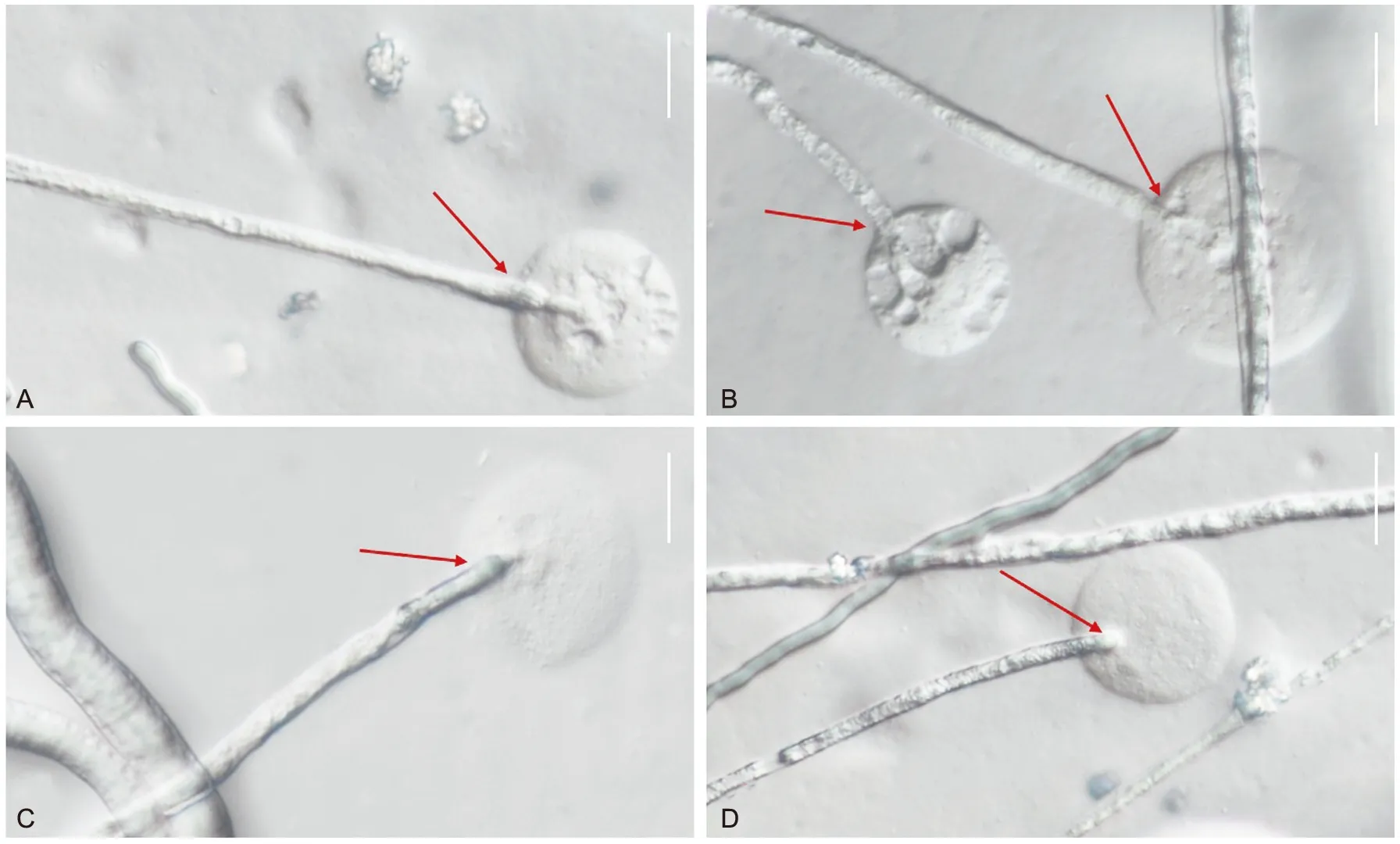
注:红色箭头表示香菇菌丝顶端,标尺:A~D=20 μm图8 香菇菌丝胞内物外泄Fig.8 Intracellular leakage of L. edodes hyphae
4) 顶端破裂、菌丝中空皱缩:受到T.lentinulae侵染后香菇菌丝顶端破裂,分泌出透明的内容物质,导致菌丝中空,变透明以及不规则皱缩以至断裂等,同马晓龙[23]研究描述相似。
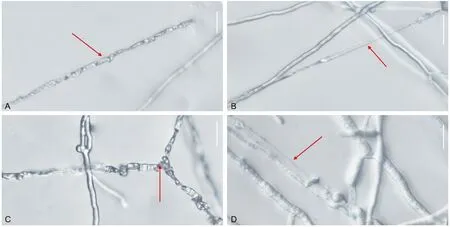
注:红色箭头表示香菇菌丝顶端,标尺:A-D=20 μm图9 香菇菌丝中空,皱褶,透明Fig.9 Formation of hollow,crapy and transparent mycelium of L. edodes
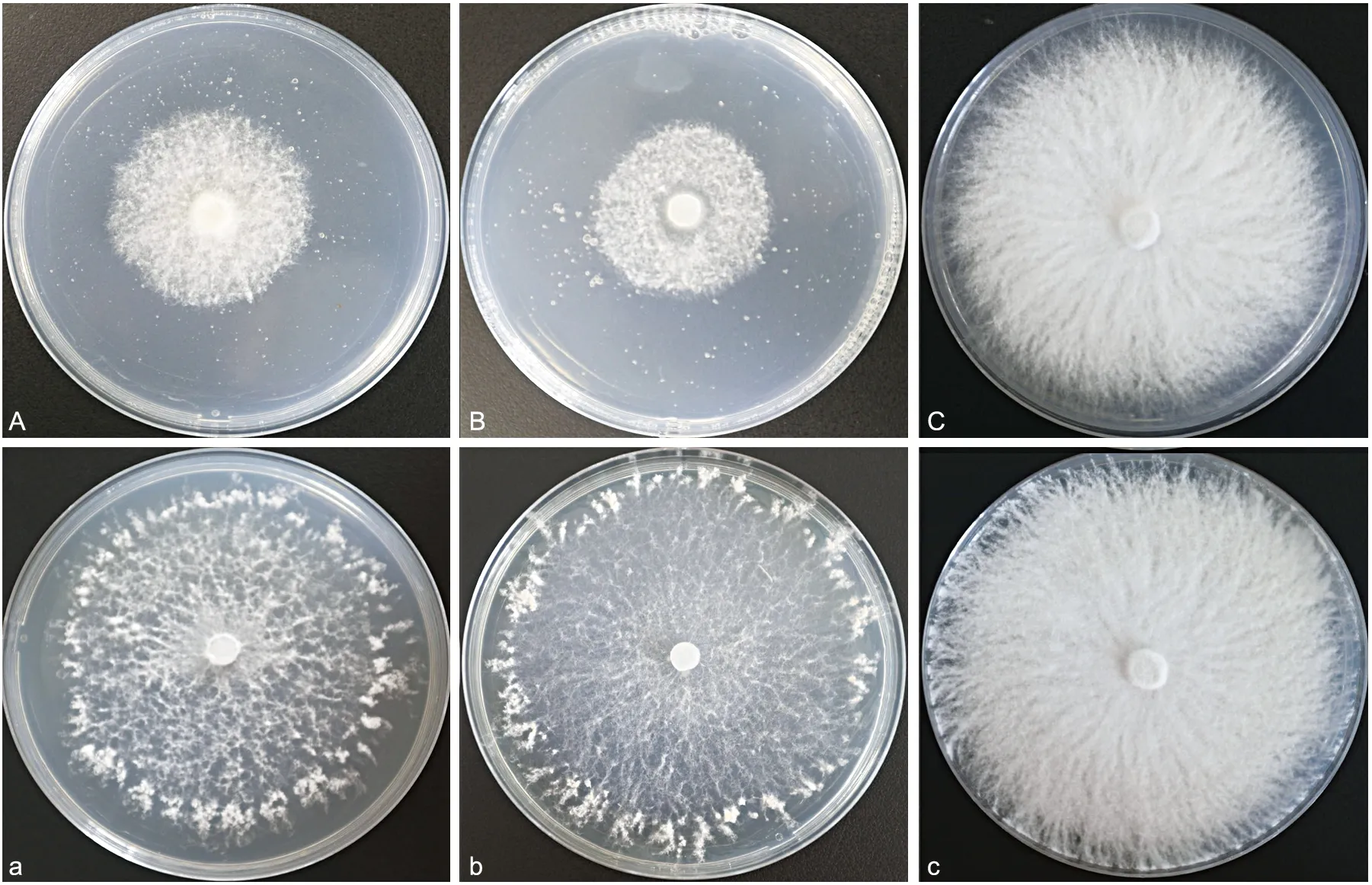
注:A~B(a~b):PDA+代谢物培养14 d(21 d),C(c):对照图10 GZCC 21-0004代谢产物对香菇菌丝影响Fig.10 Effects of metabolites from GZCC 21-0004 on L. edodes hyphae
棘孢木霉Trichodermaasperellum挥发性次级代谢产物主要是醇类和酮类物质,其中2,3-丁二醇和6-正戊基-2 H-吡喃-2-酮(6-PAP)对立枯丝核菌、尖孢镰刀菌和灰葡萄孢均具有抑菌活性[24]。在本实验中,T.lentinulae的挥发性产物对香菇菌丝的抑制效果十分显著,高达80%,甚至出现完全抑制香菇菌丝生长现象。
综上所述,经本实验分离鉴定可知Trichodermalentinulae是侵染贵州省香菇菌棒的优势木霉菌,且该菌在2020年刚被报道为新种,有关其侵染香菇菌丝的后续研究尚未开展。本实验首次完整总结了Trichodermalentinulae侵染香菇菌丝的发生过程,其中缠绕后形成一个完全包裹香菇菌丝的棍棒状结构以及产生黄褐色物质作用于香菇菌丝表面,对于木霉菌侵染香菇菌丝研究并未见报道。

注:A~B:左边接种香菇菌,右边接种GZCC 21-0004,相扣培养;C~D:对照 图11 GZCC 21-0004挥发性产物对香菇菌丝生长影响 Fig.11 Effects of volatile products from GZCC 21-0004 on the growth of L. edodes hyphae
