Exendin-4螺旋结构对生物活性及稳定性的影响
2021-07-15宋相伟窦馨月王雪丽
宋相伟 , 窦馨月, 沙 悦, 罗 锐, 王雪丽
(1.长春师范大学 生命科学学院, 长春130032; 2.吉林工商学院 粮食学院, 长春130507)
Exendin-4是由一种希拉毒蜥唾液腺分泌的39肽[1], 与人体内胰高血糖素家族具有高度同源性. Exendin-4与胰高血糖素样肽-1受体(GLP-1 R)结合可发挥独特的降血糖作用[2-3], 目前已被美国礼来公司开发成为Ⅱ型糖尿病治疗药物——艾塞那肽[4-5]. 文献[6-8]研究表明, Exendin-4在治疗神经退行性疾病及新生儿神经系统障碍疾病等方面作用显著.
Exendin-4结构由三部分组成: N端的无规则卷曲结构, 中心区域的α-螺旋结构以及C端的Trp-Cage结构. 其中N端无规则卷曲主要负责激活受体[9];α-螺旋结构主要负责与GLP-1受体结合, 分为N端螺旋(9~15位氨基酸)和C端螺旋(19~27位氨基酸)两部分, 负责与GLP-1受体胞外区N端相互作用, 是与受体相互作用的主要区域, 占总结合力的79%, 第22位的Phe参与激活受体[10]; Trp-cage结构可稳定螺旋结构, 几乎不参与激活受体.
Exendin-4的水溶性差、 易聚集等特性限制了其更好地发挥生物活性作用. 本文以去除和替换的方式对Exendin-4的N端和C端α-螺旋进行结构改造, 设计了结构类似物ExA,ExB,ExC,ExD, 以进一步研究 Exendin-4螺旋结构与其生物活性和稳定性的关系, 为设计筛选高活性Exendin-4结构模拟物提供结构信息, 最终为糖尿病和神经退行性疾病药物的开发提供先导化合物.
1 实 验
1.1 仪器与试剂
胰岛β细胞系RINm-5F(美国ATCC细胞库, 编号: CCTL-11605); 培养基RPMI-1640(美国GIBCO公司); 小牛血清(浙江天杭生物科技股份有限公司); 四甲基偶氮唑盐(MTT, 美国Sigma公司); 二肽基肽酶Ⅳ(DPPⅣ, 美国Sigma公司). 圆二色谱仪(Jasco J-810型, 日本岛津公司); 荧光光谱仪(RF-5301PC型, 日本岛津公司).
1.2 实验过程
1.2.1 Exendin-4及类似物的合成
Exendin-4及类似物由上海吉尔生化有限公司合成.
1.2.2 圆二色谱检测
圆二色(CD)波长范围185~270 nm, 速度20 nm/min, 狭缝宽度 2 nm, 4次扫描, 响应时间4 s, 温度25 ℃; Exendin-4及模拟物用磷酸盐(PBS)缓冲液配制成50 μmol/L溶液; 数据处理用Origin 9.0软件(美国OriginLab公司)绘制波长毫度曲线.
1.2.3 荧光光谱分析
激发波长设为297 nm, 发射波长扫描模式范围设为300~510 nm, 狭缝宽为5 nm; 样品制备方法与圆二色谱样品制备方法相同; 数据处理用Origin 9.0软件绘制荧光谱.
1.2.4 生物活性检测
以2×104个细胞/孔的密度将胰岛β细胞RINm-5F接种于96孔板上; 37 ℃,φ(CO2)=5% 培养12 h后加入Exendin-4及结构模拟物, 继续培养48 h; 加入10 μL MTT(5 mg/mL)于37 ℃孵育4 h; 吸出上清液后加入二甲基亚砜(DMSO)100 μL/孔完全溶解结晶; 利用酶标仪在490 nm/630 nm波长下检测.
1.2.5 稳定性检测
用pH=8.0 Tris-HCl将Exendin-4 及模拟物配制为25 μmol/L, 分别向模拟物中加入适量的DPPⅣ酶, 37 ℃孵育48 h后取样, 用等体积的体积分数为10%的三氟乙酸(TFA)终止反应.
样品经1 mL C18固相萃取柱预处理后, 用C8柱反相高效液相进行分析, 检测波长214 nm. 根据不同时间点的峰面积计算剩余Exendin-4以及模拟物的百分数.
1.2.6 数据分析
用Origin 9.0软件对数据进行绘图和统计学分析. 生物活性检测实验结果用平均数表示, 每个实验重复3次, 显著性差异用P值表示, 其中*P< 0.05, **P<0.01, ***P<0.001被认为有统计学意义; ns为无显著差异.
2 结果与讨论
2.1 模拟物设计
为研究N端螺旋与生物活性及稳定性关系, 设计模拟物ExA和ExB: 将Exendin-4 的N端螺旋(9~15位氨基酸)去除即为ExA; 将Exendin-4 的N端螺旋(9~15位氨基酸)用3个连续的Ala替换即为ExB. 为研究C端螺旋与生物活性及稳定性关系, 设计模拟物ExC和ExD: 用3个连续的Ala替换Exendin-4的C端螺旋(19~27位氨基酸)即为ExC; 在ExC基础上将第13位Gln替换为Tyr即为ExD. Exendin-4模拟物序列列于表1.

表1 Exendni-4模拟物序列
2.2 圆二色谱检测结果
利用圆二色谱分析模拟物α-螺旋结构的变化, 结果如图1所示. 由图1(A)可见, Exendin-4、 ExA和ExB在191 nm处均有正峰, 在221~222 nm和207~210 nm处有2个负峰, 是标准α-螺旋CD图谱. 螺旋的百分数及稳定性列于表2. 由表2可见, 由于N端螺旋的缺失, 导致ExA的峰值最低, 在4个模拟物中螺旋百分数最低(32.9%), 与预期设计结果相符; 由于ExB 用多聚Ala形成的螺旋替代了原有N端螺旋, 因此α-螺旋的百分数没有降低(82.4%), 甚至高于Exendin-4螺旋的百分数.
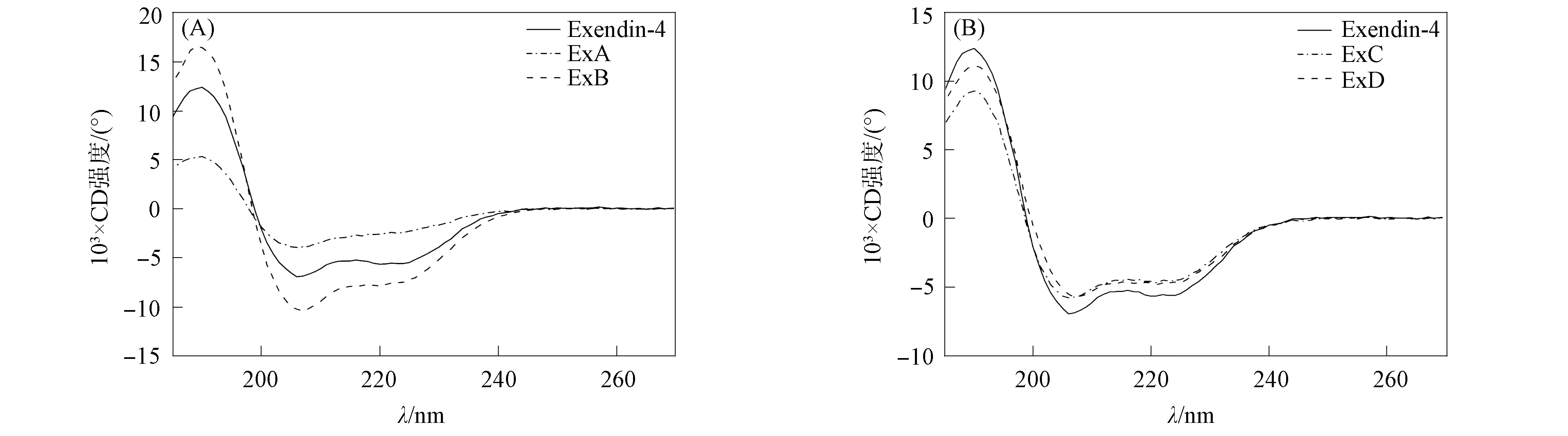
图1 Exendin-4模拟物的圆二光谱Fig.1 Circular dichroism spectra of Exendin-4 mimetics

表2 α-螺旋的百分数及稳定性
结构模拟物ExB与ExA相比, 因可形成螺旋结构的3个Ala弥补了原有N端螺旋的缺失,α-螺旋的百分数仍可保持原有水平, 通过促胰岛细胞增殖生物活性检测可知, 其生物学活性仍保持原有水平, 甚至在高浓度下具有更显著的促胰岛细胞增殖活性. 因此, 结合ExA与ExB的CD图谱以及促胰岛细胞增殖活性数据可以推断, 保持N端α-螺旋结构是维系其生物活性的必要条件, 但N端螺旋序列并未呈现特异性要求.
由图1(B)可见, ExC和ExD均存在α-螺旋结构, 螺旋的百分数与Exendin-4相当, 表明C端螺旋可通过易形成螺旋的3个Ala进行替换, 以维系Exendin-4原有结构构象; 另一方面, 因在ExD中的13位将Gln替换为Tyr, 导致ExD的峰值高于ExC, 即ExD螺旋略高于ExC螺旋的百分数, 表明Tyr13有助于螺旋的形成. 文献[9]研究表明, 在GLP-1的 N端序列中, 第1位His、 第6位Phe和第13位Tyr形成的稳定疏水簇可与GLP-1受体疏水性口袋相互作用, 其中位于α-螺旋表面的Tyr13是与受体相互作用的接触点之一, Tyr13可视为结合和激活受体的关键氨基酸. ExD和ExC的CD结果进一步证明, 将第13位替换为胰高血糖素家族中保守的Tyr13时更有利于形成α-螺旋结构, 是优化Exendin-4的重要位点.
2.3 荧光光谱分析结果
在 Exendin-4的C端(31~39位氨基酸)存在一个以第25位氨基酸Trp为中心的笼状疏水簇, 称为Trp-cage结构. 因此, 利用Trp荧光光谱变化可监测Trp-cage的结构变化. Exendin-4模拟物的荧光光谱如图2所示. 由图2(A)可见: ExA的峰位在353 nm处, 与Exendin-4峰位350 nm相比发生了3 nm红移, 表明Trp-cage结构中心的Trp更趋向暴露于亲水环境, Trp-cage结构趋于疏松, 表明去除N端螺旋影响了C端Trp-cage结构的稳定性; ExB与Exendin-4的峰位相同, 仍在350 nm处, 表明Trp-cage结构未发生改变. 因此3 个Ala形成的螺旋结构代替原N端螺旋后, 未对Exendin-4末端Trp-cage结构的稳定性产生影响. 由图2(B)可见: ExC的峰位在352 nm处, 与Exendin-4峰位350 nm相比发生了2 nm红移, 表明Trp-cage结构变疏松, 趋于亲水, 因此C端螺旋结构更接近Trp-cage结构, 由于对螺旋中氨基酸的种类和顺序有一定要求, 因此比N端螺旋更易影响Trp-cage结构的稳定状态; 另一方面, 由于将第13位Gln替换为Tyr, 使ExD的荧光光谱相对于ExC荧光光谱发生了24 nm蓝移; 此外, ExD相对于Exendin-4的峰位发生了22 nm的显著蓝移, 表明引入Tyr有助于Trp-cage结构更紧凑, 进一步证明了Tyr13对于维系Trp-cage的紧凑结构具有重要作用.
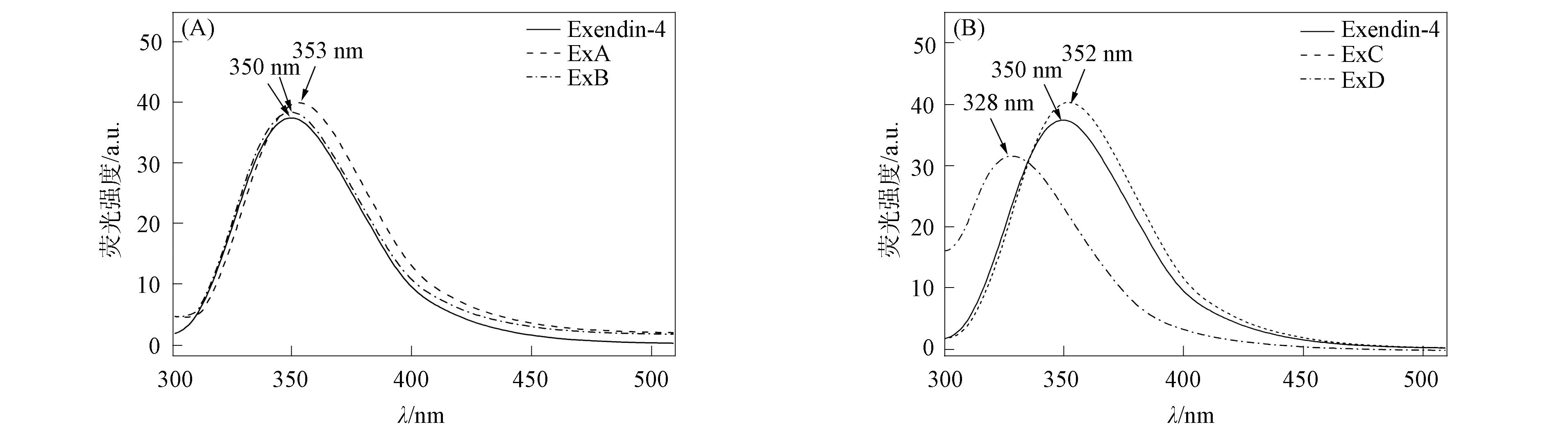
图2 Exendin-4模拟物的荧光光谱Fig.2 Fluorescence spectra of Exendin-4 mimetics
2.4 生物活性检测结果
Exendin-4具有刺激胰岛β-细胞增殖及抑制胰岛β-细胞凋亡的生物活性. 利用MTT法检测Exendin-4及模拟物对胰岛细胞数量的影响, 结果如图3所示. 由图3可见, 4种Exendin-4结构模拟物均具有促RINm-5F细胞增殖的活性, 其中ExC与ExD在40~200 μmol/L浓度内的活性显著高于原始肽Exendin-4.
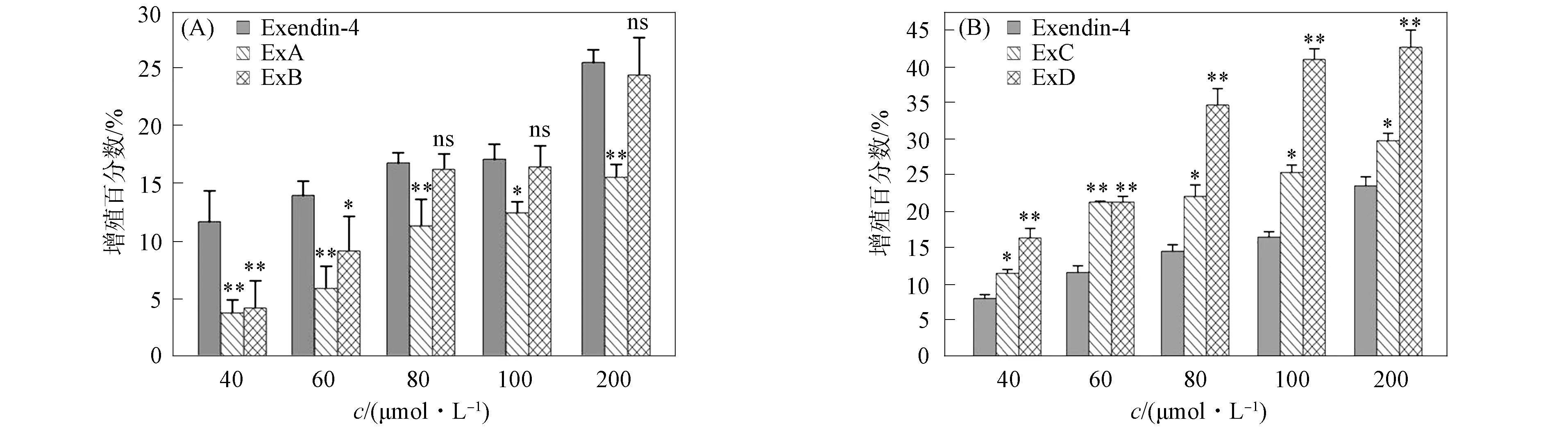
图 3 Exendin-4模拟物体外细胞活性检测Fig.3 Bioactivity test of cell of Exendin-4 mimetics in vitro
在胰高血糖素家族中, 氨基酸序列具有较高同源性, N端His1,Phe6和N端螺旋上的Tyr13均为保守氨基酸位点, 它们可形成一个疏水簇, 是激活受体的主要结构. 与胰高血糖素家族相比, Exendin-4的N端第1位和第6位同样具有保守氨基酸His,Phe, 模拟物ExA与Exendin-4同样具有保守氨基酸His1和Phe6, 由于缺少N端螺旋部, 影响了与N端无规则卷曲部分保守氨基酸形成激活GLP-1受体的疏水簇, 因此ExA生物活性降低. 当Exendin-4的N端螺旋用3个Ala替代时(ExB), 仍能保持螺旋构象, 但此时N端螺旋的序列中缺少与N端无规则卷曲部分相互作用的氨基酸, 激活受体的疏水簇不能有效形成, 使其活性小于Exendin-4活性. 因此, N端螺旋是否存在以及螺旋的一级结构信息与Exendin-4的生物活性有直接关系.
当保留N端螺旋序列, 用3个Ala替代C端序列(ExC)时, N端螺旋与N端无规则卷曲区域仍能有效形成疏水簇激活受体, 因此活性未下降. 在ExC和ExD中, 由3个Ala形成螺旋结构的柔韧性可能优于原螺旋序列, C端螺旋结构的优化可能使整个结构与GLP-1R结合自由度发生了改变, 空间定位的变化使配体可更有效地激活受体. ExD中引入Tyr13促使螺旋含量和促胰岛细胞增殖活性显著上升, 推测增殖活性的升高可能与Tyr13能够和N端His1,Phe6更好地形成疏水簇激活受体有关.
2.5 稳定性检测结果
DPPⅣ酶是一种生物体内常见的酶, 其主要作用是分解体内蛋白质, 利用DPPⅣ酶进行稳定性实验可部分反映多肽模拟物在体内的稳定性. 由表2可见, 针对N端螺旋设计的模拟物ExA和ExB, 稳定性ExB>ExA, 稳定性与螺旋的百分数存在一定的正相关性; 针对C端螺旋设计的模拟物ExC和ExD, 在ExC的基础上引入了胰高血糖素家族中在第13位高度保守的Tyr, 使螺旋的百分数小幅度增加, 稳定性大幅度提高(22%), 即ExD>ExC, 稳定性与螺旋的百分数也存在正相关性.
为进一步了解N和C端螺旋与稳定性的关系, 对ExB和ExC螺旋的百分数和稳定性数据进行分析, ExB和ExC分别用3个Ala的螺旋替换原N和C端螺旋, 螺旋的百分数基本相同, 但稳定性差别较大, ExB比ExC稳定性高51%, 可见C端螺旋被替换后对稳定性影响较大, 表明C端螺旋序列比N端螺旋序列对于Exendin-4的稳定性影响更大.
综上所述, 由于N端螺旋参与激活受体疏水簇的形成, 因此N端的变化极易削弱Exendin-4的生物活性; C端螺旋氨基酸序列信息的特异性对Exendin-4 在DPPⅣ酶环境的稳定性影响大于N端螺旋序列; 将13位的Gln替换为胰高血糖素家族保守的Tyr有利于提高螺旋的百分数, 促进与N端无规则卷曲区域形成疏水簇增强激活受体的能力, 是Exendin-4序列可进行优化的重要位点.
