“虚拟教室与教学楼”模型在无机化学四个量子数教学中的应用
2021-07-14陈广慧林旺强马荔
陈广慧,林旺强,马荔
1汕头大学理学院化学系,广东 汕头 515063
2上海交通大学化学化工学院,上海 200240
1 课程调研
无机化学[1]是化学专业大一本科生的必修课。根据多年的教学经验,发现其中许多学生对主量子数n、角量子数l、磁量子数m和自旋磁量子数ms这四个量子数的概念及其物理意义不理解,影响了后续内容,如亚层原子轨道的能量比较、核外电子的排布、元素各论知识的学习。为了解学生陷入困境的原因,我们进行了课程调研,探究是什么原因导致对以上内容理解困难。最后,根据学生的反馈,总结出以下两点原因:
(1) 大部分学生在高中阶段原子结构与性质相关知识的缺失。广东高校的大部分生源均来自于广东省,高考使用的是全国I卷,其中原子结构与性质的内容不是必考,只需从两道选考题,即有机化学基础和原子结构与性质中任选一道答题即可。因为有机化学基础选做题相对比较简单,相对容易得分,所以广东省内的大部分高中都建议或引导学生专攻有机化学基础的选做题,甚至不少高中直接放弃原子结构与性质的内容。只有少数重点高中为了取得优异的竞赛成绩,针对有机化学基础和原子结构与性质的内容安排课时进行学习。因此,导致大部分高中学生对于原子结构的知识还停留在初中阶段,认为核外电子只是单纯地绕原子核做圆周运动,完全没有掌握亚层轨道、电子自旋这些基本概念。由于高中原子结构与性质相关知识的缺失,这部分学生初到大学,以前学习的知识体系突然被颠覆,面对无机化学课程,特别是原子结构与性质的内容就会束手无策,觉得难懂、难学。
(2) 学生还没适应大学学习的抽象思维。高中的大部分知识都非常具体,着重学习现象与结论,例如A和B反应生成C和D并伴随着怎样的实验现象,对于反应机理或物质内在结构的学习只是停留在皮毛阶段。然而大学着重学习原理和结构与性质内在的联系,需要具备抽象的思维来理解原理。而大一学生刚从高中毕业,还没有具备大学化学专业课学习所必需的抽象思维能力。
根据以上调研可以发现,无机化学课程是化学类专业大一新生踏入大学的第一门专业课,教师在教学中需要深入了解学生现有的知识水平,对接高中的知识,尽量想办法把抽象的概念具象化,并在教学中逐渐培养学生的抽象思维,这是对无机化学课程教师的一大挑战。
研究表明[2],学生在学习的过程中看到陌生概念和规律时,总是不断在大脑中搜索与此相关的信息,再根据相关信息进行筛选和处理。当发现新问题与旧知识有相似点时,会进行比较和推测,使用类比法正是遵循这个过程。类比的一个重要特征就是用一个熟悉的事物去说明陌生的事物,用浅显的事理来说明复杂抽象的事理,达到其他逻辑推理方法所不能达到的目的。因此,使用类比法不仅遵循学生的学习规律,同时也能锻炼学生的创造性思维能力。所以,类比教学对教育的改革和发展有着重要的实践意义。
采用类比法教学使课程中抽象的概念具象化,很多高校化学教师积累了成功的经验。例如郭玉鹏[3]使用类比法应用在物理化学热力学函数关系式的教学中,帮助学生记忆复杂的热力学函数关系式,最终帮助学生提高学习效果。杨风霞和连照勋[4]采用公式类比、模型类比、概念类比和判据类比的方法对物理化学知识进行总结与归纳,便于学生掌握和复习。黄四平等[5]将类比思维应用于有机化学教学中,有效地提高教学效果和学生的学习效果,拓宽学生的知识视野、培养学生的创新思维。唐正姣等[6]将类比教学应用于化工原理课程中,引导学生使用类比法解决填料吸收塔与板式精馏塔的计算问题,达到提高教学效果的目的。借鉴他们的成功经验,我们也尝试将类比法应用于无机化学物质结构内容的教学中,将抽象的概念具体化、形象化,希望通过类比教学能使学生对四个量子数的概念有深入的理解和掌握。
2 四个量子数的物理意义
进行类比法教学前,需要理解四个量子数的由来:推导和求解单电子原子的薛定谔方程(Schrödinger equation)[7],如式(1)所示:



式中me与mN分别为电子和原子核的质量。因此,将式(2)代入式(1)即可得到单电子原子的薛定谔方程,如式(4)所示:

实验证明,使用分辨率较强的分光镜观察氢原子光谱时,当电子由2p轨道跃迁到1s轨道时得到的不是一条谱线,而是靠得很近的两条谱线。这一现象不能用n,l,m三个量子数进行解释。因为2p和1s从n,l,m三个量子数的角度来看都只是一个能级,这种跃迁只能产生一条谱线。1925年两位荷兰学生乌伦贝克(George Eugene Uhlenbeck)和古德斯密特(Samuel Abraham Goudsmit)根据氢原子和碱金属光谱的精细结构等诸多实验事实[11],发展了行星模型,提出电子不仅有轨道运动、还有自旋运动具有自旋角动量这一假说。自旋角动量在磁场方向的分量Msz由自旋磁量子数ms决定[12],如式(5)所示:

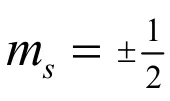
根据以上单电子原子薛定谔方程的求解即可得到四个量子数的物理意义。主量子数n是描述原子中电子出现概率最大区域离核的远近[1]。n= 1,代表第一层,这是离核最近的电子层;n= 2,代表第二层;n= 3,代表第三层。因此,n值是量子化的,n值越大代表电子离核越远,能量越高。对于单电子的氢原子和类氢离子来说,主量子数n决定了电子的能量;对于多电子原子或离子,核外电子的能量除了取决于主量子数n以外,还与其他因素有关,如角量子数l。
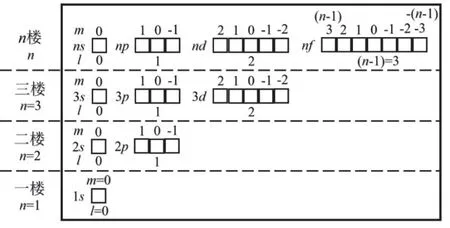
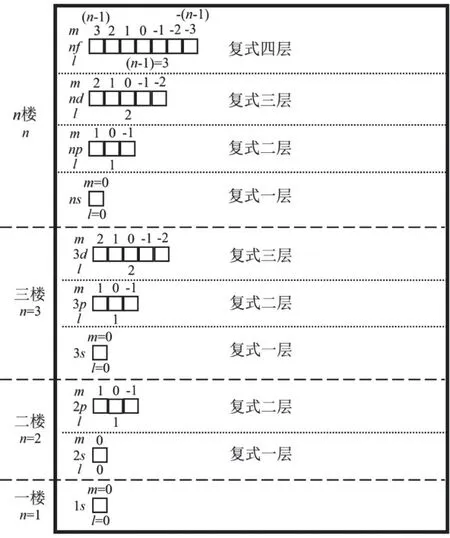
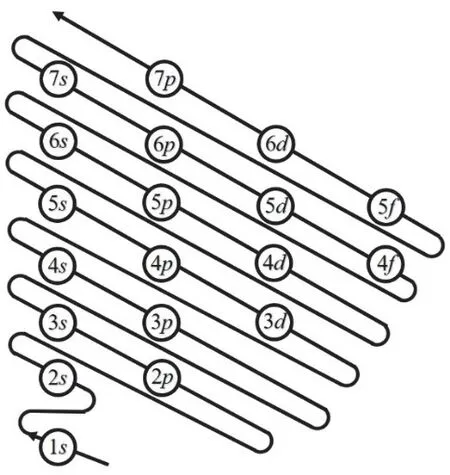
角量子数l的取值为0,1,2,3,4,…,(n− 1),分别用符号s,p,d,f,g来表示。因此,l的取值受主量子数n的限制,只能取从0到(n− 1)的整数,共有n个值。角量子数l的物理意义是代表原子亚层轨道的形状。l= 0,表示s轨道,形状为球形;l= 1,表示p轨道,形状为哑铃形;l= 2,表示d轨道,形状为花瓣形;l= 3,表示f轨道,形状更复杂。对于多电子原子或离子来说,其能量由主量子数n和角量子数l共同决定[13]。对于n相同,l不同的原子轨道,l越大轨道能量E越大,例如E4s 磁量子数m的取值为0,±1,±2,±3,±4,…,±l,即m的取值受角量子数l的影响,从0到±l,共有(2l+ 1)个取值[14]。磁量子数m的物理意义是决定原子轨道在核外空间中的取向[8]。当角量子数l=0时,表示球形的s轨道,这时磁量子数m只有一种取值0,因此s轨道在核外空间中只有一种分布方向,即以核为球心的球形分布;l= 1时,表示哑铃形的p轨道,m有三种取值0和±1,说明p轨道在核外空间坐标系有三种不同的分布方向。一般情况下,磁量子数m与原子轨道的能量无关,因此三种不同取向的p轨道,其能量相等;l= 2时,表示花瓣形的d轨道,m有五种取值0,±1和±2,说明在核外空间中有五种不同的分布方向,这5种d轨道能量简并,即简并度为5。 综上所述,n,l,m这三个量子数可以决定原子轨道的离核远近、形状和空间取向,而ms则决定电子的自旋方式。因此,四个量子数确定之后,电子在核外空间的运动状态就确定了。 如果将以上抽象的知识直接向刚进大学的大一新生进行讲授,学生一时肯定难以接受新概念和新知识,例如原子轨道代表原子体系单电子波函数等概念。因此,为了帮助学生越过抽象思维的“能垒”,我们先采用类比教学的方法向学生构建“虚拟教室与教学楼”模型将四个量子数的概念及其物理意义具象化。 对于单原子或离子,如氢原子或者类氢离子,无论主量子数n等于多少,原子亚层轨道的能量都相同,即Ens=Enp=End=Enf。因此,我们向学生构建出“虚拟教室与教学楼”模型,如图1所示,用来说明四个量子数的概念。将电子比作学生,楼层比作电子层,楼层中的复式比作电子亚层,一间教室比作一个原子轨道。当n= 1时,只有1个s轨道,对应教学楼一楼只有一间教室,教室里面有两位学生,一位学生面向黑板,另一位学生背向黑板,代表1s轨道有两个自旋相反的电子;n= 2时,对应教学楼二楼有四间教室,分别是一间2s教室和三间2p教室,每间教室有两个坐向相反的座位;同理,n= 3时,教学楼三楼有一间3s教室、三间3p教室和五间3d教室,每间教室有两个坐向相反的座位。n≥ 4的情况也是以此类推。 图1 单电子体系“虚拟教室与教学楼”模型 对于多电子原子或离子,结合图2“虚拟教室与教学楼”模型进行类比教学。n= 1时,只有1个s轨道,对应教学楼一楼只有一间教室,教室里面有两位坐向相反学生,代表1s轨道填充两个自旋相反的电子;n= 2时,有1个2s轨道和3个2p轨道,对于多电子原子或离子2p轨道的能量大于2s轨道,因此我们将复式楼层比喻为电子亚层:教学楼二楼是二层复式楼层,复式一层只有一间教室,代表2s轨道,教室里有两个坐向相反的座位,代表可容纳两个自旋相反的电子;复式二层有三间教室,代表2p三个能量简并的轨道,每间教室里面有两个坐向相反的座位,复式二层共4间教室,教室数等于n2(n= 2);同理,n= 3时,教学楼三楼是三层复式楼层,复式一层只有一间教室,二层有三间教室,三层有五间教室,复式二层共9间教室,教室数等于n2(n= 3);n≥ 4的情况也是依此类推。 与此同时,我们在讲授时特别强调主量子数、角量子数与磁量子数间的约束关系,如图1、图2所示:例如对于多电子体系,教学楼的楼层数等于主量子数,每一楼层的复式层代表电子亚层,也即代表角量子数,因此楼层数与复式层数的数量关系,也就是主量子数与角量子数的约束关系,每一层复式有若干教室,教室数目代表磁量子数,即复式层数与教室数的关系,也代表着角量子数与磁量子数的约束关系。 图2 多电子体系“虚拟教室与教学楼”模型 另外,我们也利用“虚拟教室与教学楼”模型向学生讲授电子排布的三大规则:能量最低原理、泡利不相容原理和洪特规则,引导学生掌握1–18号元素的电子排布规律。 在课堂上采用以上类比教学,大部分学生对四个量子数的概念及其物理意义在头脑中产生了清晰的图像,也初步地理解了1–18号元素的电子排布规律,说明我们类比教学取得理想的成果。但是单凭以上的知识,学生还不足以完全掌握其他基态原子的电子排布。对于多电子原子,原子轨道径向分布的不同,导致了屏蔽效应和钻穿效应的出现,引起了多电子原子能级交错的现象。例如原子序数为15–20的元素,E4s 图3 电子填充能级顺序图 最后,为了检验本次教学改革的效果,我们进行了随堂测验,考查1–36号的元素的基态原子的电子排布。发现与往年相比,学生都普遍获得较好的成绩,说明采用这种类比教学方法取得满意的效果。说明这种把抽象的概念具象化、形象化的类比教学法取得了成功。同时,我们在无机化学后续内容的教学中逐渐加强培养学生的抽象思维。 提出问题:一直以来,不少学生反映无机化学课程的物质结构部分难学难懂,特别是觉得四个量子数非常抽象而学得一知半解,导致对后续的内容完全不知所云。 解决问题:为了帮助学生解决这一难题,我们采用类比教学的方法将抽象的四个量子数的内容具象化——利用“虚拟教室与教学楼”模型进行类比,将电子比作学生,楼层比作电子层,楼层中的复式比作电子亚层,一间教室比作一个原子轨道,将看不见摸不着的抽象概念形象化、简单化。同时,向学生推荐使用类比法将抽象的内容具体化,能帮助学生培养抽象思维,帮助学生适应大学的学习。 课后反响:通过学生的课堂表现与随堂测验的结果,发现学生的理解和掌握程度比往年都要理想,说明当前的类比教学取得理想的教学效果。这也激励我们今后将类比教学方法运用于更多的知识点教学上,帮助学生理解得更深入,掌握得更扎实。同时也希望学生能够将类比思维应用于日后的学习与科研之中。 不足:“虚拟教室与教学楼”模型也存在其不足之处: (1) 未能强调自旋并无经典的可对应量; (2) 未能体现洪特规则; (3) 没法解释屏蔽效应和钻穿效应带来的多电子原子轨道能级交错; (4) 该模型使用是否为复式楼层去类比单电子与多电子体系,实际上,原子或分子体系是不分单电子或多电子体系,两者应是统一自洽的,本模型并没有建立一个更完善的模型去统一描述单电子与多电子体系,这是本模型的缺点。但是如果建立这样的模型,势必需要引入介绍更深奥难懂的概念,例如两个电子之间的交换相关作用等,只会增加学生的理解难度。如果我们讲授的是本科高年级课程结构化学,甚至是研究生课程量子化学,引入更深奥的概念去构建更完善的模型是很有必要的。但我们的初衷只是为了让刚踏入校园的大一新生掌握四个量子数的物理意义以及其能级的能量高低,才使用“虚拟教室和教学楼”模型进行类比,如果引入更深奥的理论去构建更完善的模型,我们认为这是不切实际的,学生肯定很难理解和接受。当然,我们在讲授的过程中会以思考题的形式让学生寻找该模型的缺点,最后我们肯定也会在讲授过程中强调其中的缺点,以防学生进入理解误区。 这是当前“虚拟教室与教学楼”模型的不足,这也是在后续的教学实践中需要提高与改进之处。在这里抛砖引玉,希望能跟同行进行交流并改进。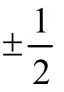
3 四个量子数的类比教学
4 结语
