酸碱滴定中强碱滴定弱酸滴定初始曲线的数学解释
——以NaOH滴定HAc为例
2021-07-14孙树喆张泽浩张斌
孙树喆,张泽浩,张斌
1山东大学化学与化工学院,济南 250100
2山东大学泰山学堂,济南 250100
3山东大学生命科学学院,山东 青岛 266237
酸碱中和滴定是无机及分析化学实验中常见的基础实验操作,在测定复杂酸(碱)性物质含量方面具有广泛应用。在酸碱中和滴定实验过程中,滴定曲线由于生动形象地反映了整个滴定过程中的关键节点,对广大学生理解和掌握酸碱中和滴定具有不可替代的重要作用。在化学专业基础课分析化学酸碱滴定法一章的学习过程中,通过比较强碱滴定强酸(以氢氧化钠滴定同浓度盐酸为例)的滴定曲线与强碱滴定弱酸的滴定曲线(以氢氧化钠滴定同浓度醋酸为例),可以发现二者的滴定曲线走势在滴定初始阶段存在差异,《分析化学》(武汉大学主编,第6版,上册,以下简称教科书)中仅给出定性分析和解释[1]。国内外分析化学教学中使用影响力较高的教科书对此也都给出类似的定性叙述[2–4]。借鉴当前通过数学解析和曲线绘制建立滴定分析模型的经验[5],本文尝试利用酸碱滴定过程中的平衡关系式,建立数学模型模拟氢氧化钠滴定醋酸的反应过程。结合计算机绘图工具在精确绘制酸碱滴定曲线中的应用[6],本文将通过函数图像的直观走势针对教科书中相关定性解释给出定量验证。
1 氢氧化钠(NaOH)滴定醋酸(HAc)滴定曲线的数学推导
1.1 基本公式的回顾
在滴定过程中,反应体系中存在以下几个平衡关系式。对于HAc的解离过程HAc ⇌H++ Ac−,其平衡常数表达式为:

忽略该酸碱滴定时的放热情况,室温25 °C时存在:

由电荷守恒可知:

由物料平衡可知:

由pH的定义可知pH = −lg[H+]。
1.2 必要假设的引入
为方便推导,在不影响滴定曲线总体形状的基础上引入以下假设:作为滴定标准液的NaOH溶液浓度较大,以至于其加入HAc溶液后不对体系体积产生影响。由此推出上述平衡式(4)中c即为HAc的初始浓度,参照教科书[1]上数值,设c为0.1000 mol·L−1,(4)式即可化为:

由于假设滴定过程中体积不变,所以[Na+]与加入NaOH的物质的量成正比,即可以用[Na+]来表示加入NaOH的物质的量。
1.3 相关方程的推导
在以上基本公式、假设和推论的基础上,进行如下合理推导。
设滴定过程中,

由平衡式(2)可知:
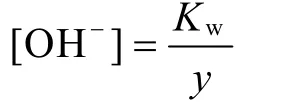

由推论(5)可知

将式(6)、(7)、(8)代入平衡式(1),得:
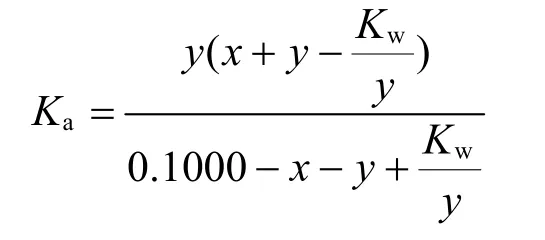
整理可得,

注意到Kw/y<< 0.1000Ka/(y+Ka)-y,合理忽略最后一项,可得:

由pH = −lg[H+]及式(6)可得:

将式(1)、(6)、(10)代入式(9)得:
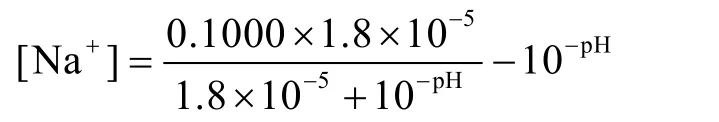
1.4 函数图像的验证
以pH为自变量、[Na+]为因变量作函数图像,即图1所示。
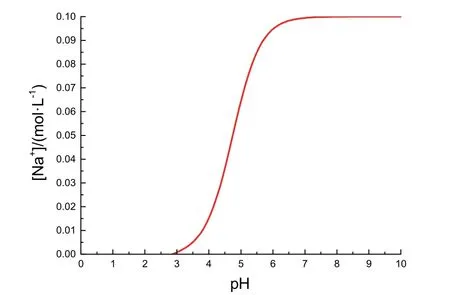
图1 [Na+]关于pH变化的函数图像
以[Na+]为自变量、pH为因变量作函数图像,由函数对称性可知,该函数与图1中函数互称反函数,两者图像关于y=x对称,即图2所示。
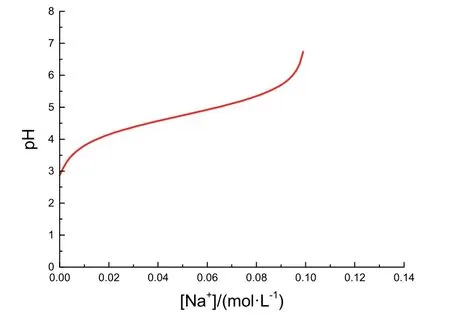
图2 pH关于[Na+]变化的函数图像
1.5 图像差异的解释
图2中大致反映了滴定过程中pH变化与[Na+],即加入NaOH物质的量的关系。观察图2,可以看出滴定开始前体系pH约为3,经过一个坡度倾斜程度先大后小的pH变化过程,在接近滴定终点时产生一个突变,后愈发平缓增大。与教科书原图比较,本图存在如下两点差异。
第一,本图开始时图像坡度更大,是因为忽略加入NaOH后的体积变化,[OH−]迅速增大,pH升高速度较快。第二,终点过后的pH并非原图中随NaOH过量加入而趋近13,是因为我们假设忽略了加入NaOH溶液后的体积改变。
由于初始阶段(2.9 ≤ pH ≤ 6.0)的研究更为重要,因此在图像形状基本相符的情况下,此两点差异不影响我们对其图像成因的描述。
2 图像理论解释的数学验证
2.1 理论解释
我们注意到,在教科书中对于曲线初始部分的坡度变化进行了如下解释:“滴定开始之后,曲线的坡度比滴定HCl更倾斜,这是因为HAc的解离度很小,一旦滴入NaOH后,部分的HAc被中和而生成NaAc,由于Ac−的同离子效应,使HAc的解离度变得更小,因而H+浓度迅速降低,pH较快增大。”
2.2 数学验证
针对教科书中所给理论的定性解释,结合以上对滴定曲线的数学推导过程,我们也采用数学方法进行合理性验证。
2.2.1 解离度与氢离子浓度的关系推导
定义α为HAc在整个滴定过程的解离度,依然采用上述对c的赋值,即c= 0.1000 mol·L−1。滴定过程存在以下两个反应:

假设(11)迅速完全反应,可得:

将式(1)、(2)、(6)、(7)、(9)、(10)代入得:
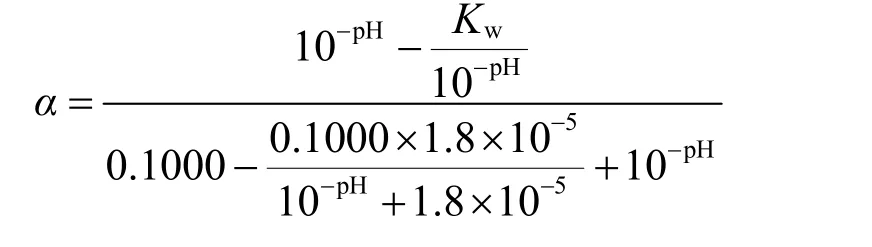
2.2.2 解离度与氢离子浓度关系的图像验证
以pH为自变量、α为因变量作图,即图3所示。
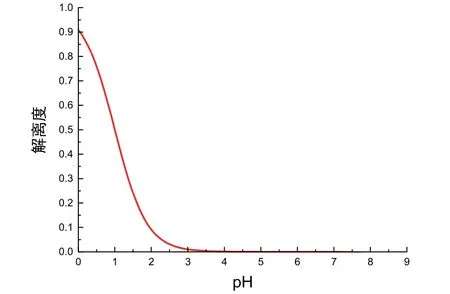
图3 解离度关于pH变化的图像(c= 0.1000 mol·L−1)
由于仅在α和pH大于0时图像具有化学意义,故我们仅需要观察第一象限中曲线的变化规律。观察图3容易看到,随着滴定进行,[H+]逐渐降低,pH逐渐升高,α数值先迅速降低后趋于平缓。即HAc解离度随pH的升高先迅速减小后趋于0,这与教科书书中对初始阶段滴定曲线坡度变化的定性解释相符。
2.2.3 实验条件与图像的优化
事实上,当我们令c=1.000 mol·L−1时,此时NaOH浓度更大,上述1.2节中体积不变的假设更加合理,因此其图像变化趋势更符合上述解释。以pH为自变量、α为因变量作图,如图4所示。观察发现其走势更为明显,同时证明该数学模型对初始阶段曲线斜率变化解释的合理性。
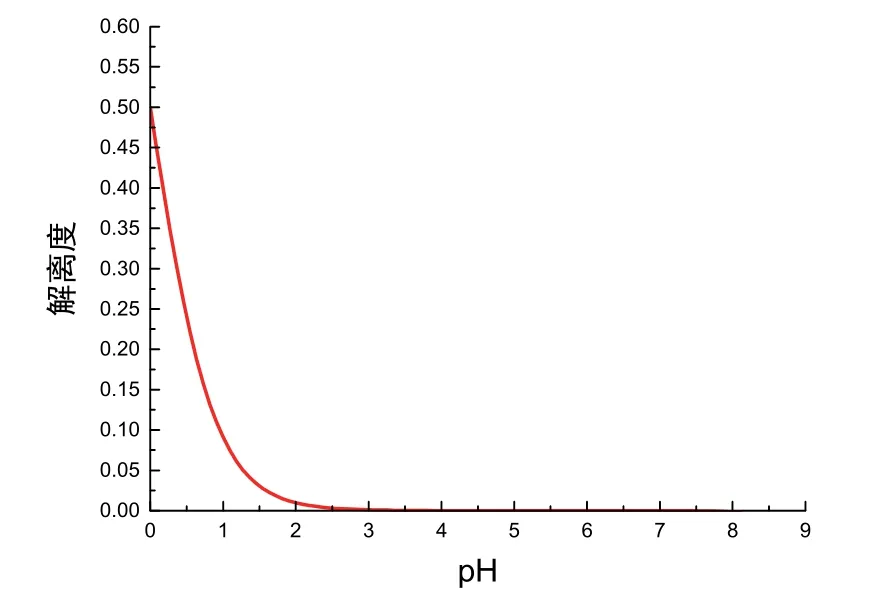
图4 滴定初解离度关于pH变化的图像(c= 1.000 mol·L−1)
2.2.4 pKa对滴定初始解离度影响的初步模拟
对于不同强度的弱酸而言,其滴定曲线在初始阶段的变化情况不尽相同。为说明弱酸强度对于初始阶段解离度的影响,我们研究了不同强度的弱酸的解离度随着pH变化的变化趋势。分别以pH为自变量,以α为因变量,利用2.2.1节中推得表达式作图,如图5所示。观察图5,推测不同强度弱酸的解离度在滴定初始阶段随pKa的增大而下降,其对应滴定曲线坡度越大。
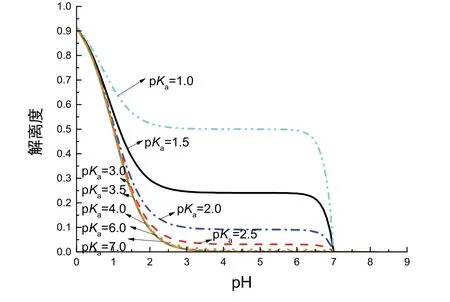
图5 滴定初始阶段不同弱酸解离度关于pH变化的图像(c= 0.1000 mol·L−1)
3 结语
本文用数学方法从pH变化定量解释了其图像前半部分与强酸强碱滴定曲线不同的原因。NaOH滴定HAc曲线初始阶段特殊的原因是忽略加入NaOH后的体积变化,[OH−]迅速增大,pH升高速度较快。与此同时,从解离度变化角度验证了教科书中定性解释的合理性。随着滴定进行,[H+]逐渐降低,HAc解离度随pH的升高先迅速减小后趋于0,体系pH先迅速变化后趋于平缓。与此同时,通过数学曲线模拟pKa和浓度不同时滴定初解离度的变化,我们发现当弱酸初始浓度较大、pKa较大(pKa≥ 3.0)时,初始阶段解离度骤降程度越大、滴定曲线pH变化越明显,这是下一步虚拟实验建立的理论基础。
当前以学科交叉为核心的虚拟大学化学实验教学探索不断推进,在节省实验时间、提高学生兴趣、巩固理论基础等方面成效显著[7],我们也会借助于此进行其他滴定曲线差异性的相关研究。这为本科生和分析化学爱好者深入理解该酸碱滴定过程提供了一种新的思路和方法,并可以调整条件扩展到络合滴定、沉淀滴定等多种滴定操作中,有助于教师在教学中采用定量的方法对学生在酸碱滴定中的疑问进行解释,并有利于提高学生利用基本数学知识和工具处理化学问题的思考能力。
