Fe(II)-Pd(II)异金属有机分子笼的制备及其物化性能研究
——推荐一个新颖的综合化学实验
2021-07-14潘梅李超捷侯雅君苏成勇
潘梅,李超捷,侯雅君,苏成勇
1中山大学化学学院,广州 510275
2珠海市第四中学,广东 珠海 519015
金属有机分子笼(metal-organic cages,MOCs)有着固定的结构和特定大小的尺寸和空腔,由金属离子和有机配体在配位驱动下自组装得到,在主客体化学、吸附、催化等不同领域都有着重要的应用前景。与金属有机框架(MOFs)的无限延展的结构不同,金属有机分子笼是一种分立的三维寡聚体。金属有机分子笼与纯有机分子笼相比,配体与金属的配位键的键能(62.7–209 kJ·mol−1)介于弱相互作用力(< 41.8 kJ·mol−1)与共价键(> 250.8 kJ·mol−1)之间。在组装过程中,不但可以对出现的一些错误连接进行纠正自修复,还可以保证最终得到产物具有较好的化学稳定性。为了使分子笼得到更丰富的物理化学性质,科研工作者尝试用金属配体替代传统的纯有机配体,这样最终形成的分子笼一般有两个或以上不同的金属中心,并具有相对稳定的配位结构和独特的物化性能。在本文中,我们将介绍一种较为简单的制备异金属有机分子笼的方法,该过程的Fe(II)金属有机配体能够相对快速简洁地得到,从而能够相对容易地获得含Fe(II)-Pd(II)的异金属有机分子笼。
MOCs是超分子化学的一个重要分支,也是目前科学前沿的热点研究内容之一。国内的大学化学实验教学论文中,介绍配合物的制备和性能研究的报道已有不少[1–9],介绍MOFs的相关实验教学论文也有些许[10–13],但介绍有机-金属分子笼的制备和物化性能研究的教学论文少之又少。为了将化学核心素养进一步融入进大学化学实验中,很有必要让本科生提前对该领域的科研前沿进展有一定的认识,以培养出更优秀的新世纪化学创新人才。本文介绍的实验通过分步自组装策略,只需要三步便可以得到目标金属-有机分子笼MOC-42。进一步利用本科所学的波谱分析理论知识,对MOC-42的核磁和紫外吸收光谱等进行研究,探究其结构和分解动力学等物理化学性能。该研究内容发表在2018年12月的Journal of the American Chemical Society上[14]。我们在此基础上,将相关研究成果建设成为本科生的综合化学实验课题,这也是国内首例在在本科化学实验中介绍异金属有机分子笼的教学文章。
该制备MOC-42的实验成功率高且可行性强;同时包含了有机合成和无机合成实验的操作;通过表征MOC-42的结构,可以提高学生对核磁共振波谱的进一步认识;通过探究MOC-42的分解动力学,可提高学生将化学理论课上的知识与实验相结合,提高学生处理数据和科学做图的能力。该实验有利于提高学生的科学探究和创新意识,培养学生严谨求实的科学态度,在探究中学会与人合作,从而成为具有科学精神与社会责任的“化学人”。
1 实验内容
1.1 实验目的
(1) 通过查阅文献,了解金属有机分子笼的应用前景和研究现状。
(2) 掌握金属-有机分子笼MOC-42的合成原理和方法。
(3) 掌握核磁共振谱和紫外-可见吸收光谱用于金属有机分子笼研究的测试与分析方法。
(4) 利用过渡态理论、Arrhenius公式等物理化学理论知识,掌握探究Fe(II)中心分解动力学的原理与方法。
1.2 实验原理
在本实验中,我们利用含铁的金属有机配合物作为金属配体。由于该铁(II)金属配体具有3个未配位的吡啶端基,因此构成三齿配体构筑基元。选用平面四配位的Pd2+与铁(II)金属配体进行配位自组装,可得到截角八面体构型的金属-有机分子笼MOC-42 (如图1所示)。其中8个含Fe的金属配体即为八面体的八个面,八面体的六个截角为6个Pd2+,故也可以称之为是Fe8Pd6型的异金属-有机分子笼。
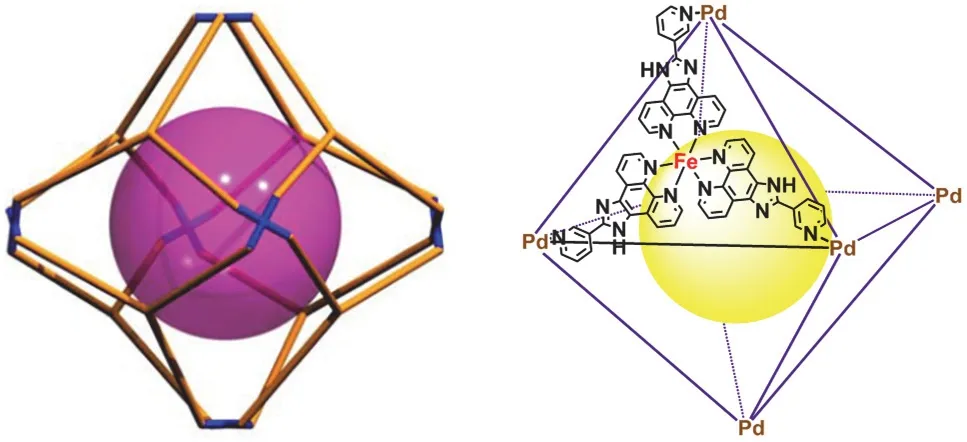
图1 MOC-42的结构示意图
铁(II)配合物的解离可以认为是准一级反应,可以在不同温度下,通过紫外-可见吸收光谱监测Fe(II)中心在520 nm处吸光度随时间的变化,根据阿伦尼乌斯公式以及准一级反应速率常数公式,求得分解反应的活化能。
lnk= lnA−Ea/(RT)
lnA= lnA0−kt
其中,Ea为解离反应的表观活化能。在温度变化不大时,Ea可视为常数;A为频率因子,在碰撞理论中A代表反应物有效碰撞的频率;R为理想气体常数,数值为8.314 J·mol−1·K−1。T为热力学温度,单位为K。A0和A分别为Fe(II)配合物在520 nm处起始时刻和任意时刻下的吸光度,k为准一级反应速率常数,t为时间。
利用准一级反应速率常数公式,将一定温度下所测得的吸光度A随时间的变化作图,拟合后可得一条直线,其斜率即为Fe配合物的分解速率常数k。根据阿伦尼乌斯公式,再将不同温度下得到的k作图也可拟合得到一条直线,其斜率即为Fe(II)配合物分解反应的表观活化能Ea。
进一步根据过渡态理论,反应速率常数k与反应的活化焓Δ≠Hmϴ和活化熵Δ≠Smϴ有关,即Eyring-Polanyi方程,其中kB为玻尔兹曼常数,h为普朗克常数。
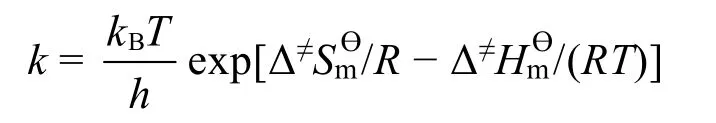
该方程又可以写做以下形式:
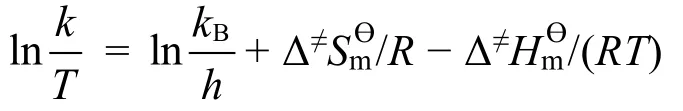
由ln(k/T)对1/T作图,所得到的直线的斜率和截距计算后可分别得到Δ≠Hmϴ和Δ≠Smϴ。而反应的吉布斯自由能Δ≠Gmϴ可由下面的公式得到。
Δ≠Gmϴ= Δ≠Hmϴ−TΔ≠Smϴ
1.3 主要仪器和试剂
1.3.1 试剂
吡啶-3-甲醛、1,10-邻二氮杂菲-5,6-二酮、乙酸铵、四氟硼酸化亚铁(II)、四(乙腈)四氟硼酸钯(II)、冰乙酸、二甲基亚砜、乙酸乙酯,所有试剂均为市售分析纯,未经纯化直接使用。
1.3.2 仪器
Bruker AVANCE III型400 MHz超导核磁共振谱仪(德国布鲁克公司),Shimadzu UV 3600型紫外-可见-近红外分光光度计(日本岛津公司)。
1.4 实验内容
1.4.1 2-(3-吡啶)-1H-咪唑[4,5-f][1,10]菲罗啉(以下简称为L)的合成
实验流程如图2所示,向25 mL配有搅拌磁子的圆底烧瓶中加入124 mg (0.59 mmol) 1,10-邻二氮杂菲-5,6-二酮、75 mg (0.7 mmol)吡啶-3-甲醛,0.91 g (11.8 mmol)醋酸铵和5 mL冰醋酸,在115 °C下加热回流3 h。将反应物冷却至室温后加入20 mL的去离子水进行稀释,然后用滴管向混合物中缓慢滴加浓氨水并持续搅拌,可以看到逐渐有大量黄色沉淀生成,抽滤,并用水洗涤,再用乙醇重结晶即可。干燥后称重并计算产率。核磁表征。
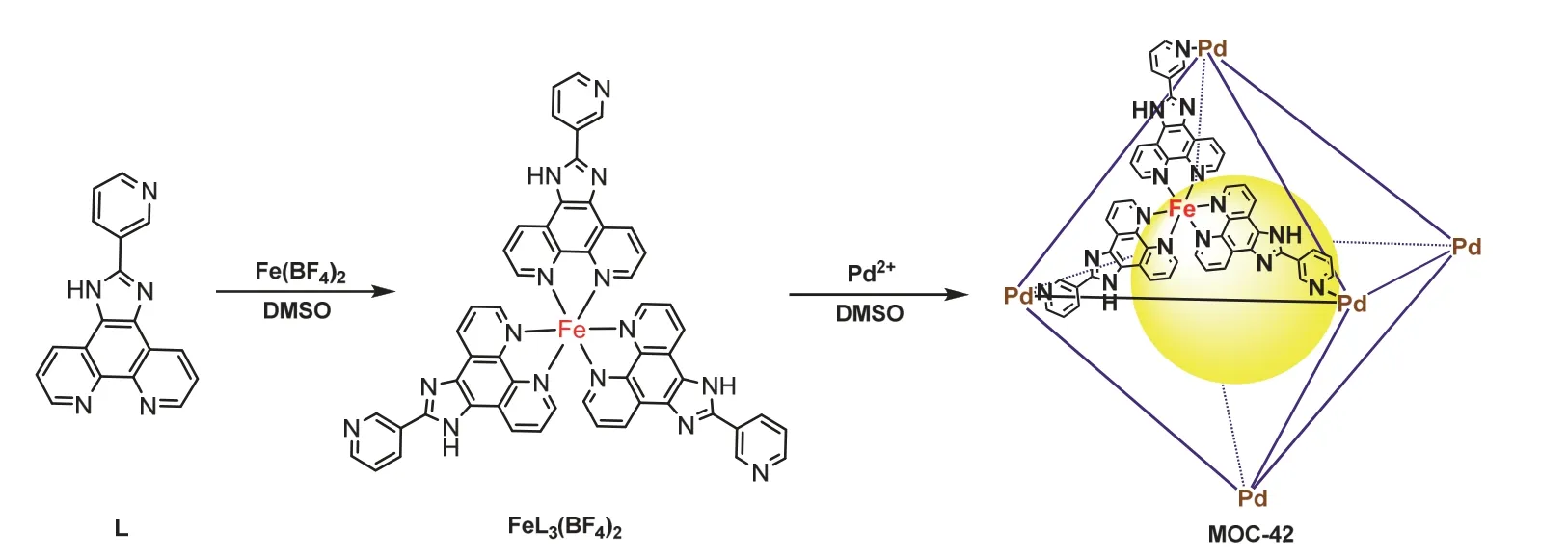
图2 MOC-42合成流程示意图
1.4.2 金属配体FeL3(BF4)2的合成
在10 mL的圆底烧瓶中加入66.9 mg (0.23 mmol)有机配体L,18 mg (0.08 mmol) Fe(BF4)2和5 mL的DMSO。在常温下搅拌1 h即可,可以看到反应液的颜色呈血红色。反应结束后向反应液中加入适量的乙酸乙酯,便可得到大量的血红色沉淀,离心干燥后称重并计算产率。核磁表征。
1.4.3 分子笼MOC-42的合成
在5 mL的圆底烧瓶中加入56 mg (0.05 mmol) FeL3(BF4)2,16.7 mg (0.04 mmol) Pd(CH3CN)4(BF4)2和3 mL的DMSO,并让反应液在80 °C下加热3 h,反应结束后加入15 mL的乙酸乙酯,即可看到有大量鲜红色的沉淀物析出,离心干燥后称重并计算产率。核磁表征。
1.4.4 MOC-42的核磁滴定实验
为了进一步确定MOC-42的结构为Fe8Pd6型的异金属有机分子笼,可以通过核磁滴定加以验证。分别配制浓度都为8 mmol·L−1的FeL32+(A液)和Pd2+(B液)的DMSO-d6溶液。首先取320 μL的A液和80 μL的B液,将两种溶液混合装入核磁管中,在80 °C下加热30 min后做1H NMR测试;然后再向核磁管中加入80 μL的B液,此时A液和B液的体积比为4 : 2,重复上述的操作直至A液和B液的体积比达到4 : 4。对比FeL32+和不同比例下的核磁谱图,观察其中的区别,尝试解释为什么MOC-42是Fe8Pd6型的异金属有机分子笼。
1.4.5 探究酸性条件下FeL32+与MOC-42的分解动力学
为了比较金属配体FeL32+与成笼之后的分解动力学的差异,我们向FeL32+和MOC-42中加入较大浓度的酸,以此来探究两者在强酸性条件下的分解动力学。配制0.04 mmol·L−1的金属配体FeL32+和0.005 mmol·L−1的MOC-42溶液,向其中加入H2SO4至浓度为0.5 mol·L−1。然后用UV-Vis吸收光谱仪对样品在不同温度下进行原位测试。观察吸收光谱在520 nm处的1MLCT特征吸收带的吸光度随时间的变化。利用准一级反应速率常数公式和阿伦尼乌斯公式作图,可以得到分解反应速率常数k和反应的表观活化能Ea。在此基础上进一步通过Eyring-Polanyi方程以及吉布斯自由能定义式,可以得到分解反应的活化焓Δ≠Hmϴ和活化熵Δ≠Smϴ以及吉布斯自由能Δ≠Gmϴ。具体方法可参考实验原理部分。
2 数据分析方法
2.1 MOC-42核磁表征
L的核磁共振氢谱为1H NMR (400 MHz, DMSO-d6, 298 K): δ 9.52 (d, 1H), 9.06 (dd, 2H), 8.91 (d,2H), 8.72 (dd, 1H), 8.60 (dt, 1H), 7.86 (br, 2H), 7.67 (q,J= 4.6 Hz)。
FeL3(BF4)2的核磁共振氢谱为1H NMR (400 MHz, DMSO-d6, 298 K): δ 14.58 (s, 3H), 9.50 (s, 3H),9.14 (d, 3H), 9.07 (d, 3H), 8.79(d, 3H), 8.63 (d,J= 8.3 Hz, 3H), 7.82 (d,J= 19.6 Hz, 6H), 7.77 7.67 (m, 9H)。
MOC-42的核磁共振氢谱为1H NMR (400 MHz, DMSO-d6, 298 K): δ 10.01 (s, 24H), 9.17 (s, 24H),8.82 (d, 24H), 8.71 (m, 24H), 7.74 (m, 24H), 7.56 (s, 24H), 7.46 (m, 48H), 7.37 (m, 72H) (如图3所示)。
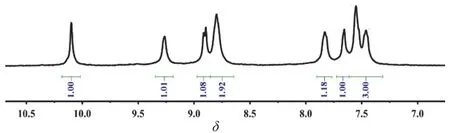
图3 MOC-42的1H NMR谱图
2.2 MOC-42核磁滴定
核磁滴定实验结果如图4所示,可以看到当一开始向金属配体FeL32+中加入少量Pd2+时,两者已开始发生反应,且已经可以看到有MOC-42的特征峰产生,但此时谱图中有着许多杂峰,这说明了溶液中可能存在着多种配位组装体。随着Pd2+的逐渐加入,核磁谱图的杂峰逐渐减少,直至Fe : Pd的物质的量之比为 4 : 3,也就是该自组装分子笼反应的化学计量比,此时溶液中的产物基本只有MOC-42一种。再继续增加Pd2+至过量,谱图不再有明显的变化,这也说明了得到的自组装产物为能量最低的化学热力学稳定的产物,该分子笼结构形成后可以稳定的存在于溶液中。
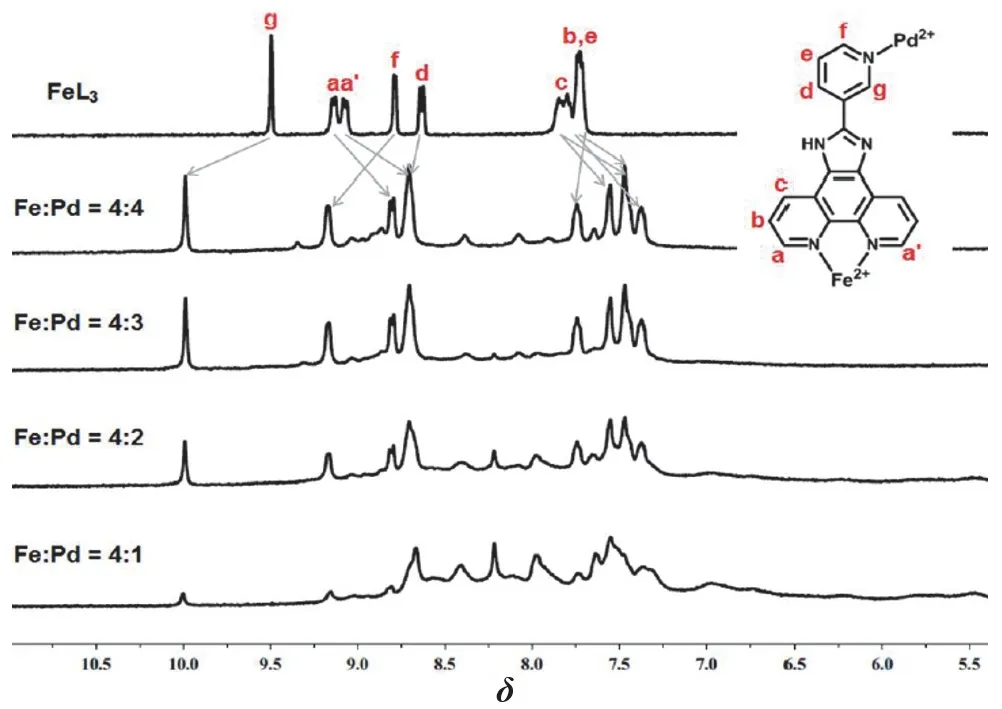
图4 MOC-42的核磁滴定谱图
2.3 MOC-42的分解动力学
在实验过程中可以观察到,相同条件下MOC-42中配位后的金属配体FeL32+解离速率要比单独的金属配体FeL32+的小很多。以35 °C下测试的紫外-可见吸收光谱为例,如图5所示,在加入酸2.5小时后FeL32+在520 nm处的吸收峰强度下降大于0.2;而MOC-42经历6 h后,520 nm处的吸收峰仅有微弱降低,很直观地说明了MOC-42中配位后的FeL32+更加稳定。在21 °C、25 °C、30 °C和35 °C下进行测试,将520 nm处吸光度的对数值对时间t作图并进行线性拟合,可以得到如图的一系列的拟合直线,这些直线的斜率即为该条件下的解离速率常数k。从图6中不难看出,在相同条件下,MOC-42中Fe(II)金属中心的解离速率常数比金属配体FeL32+的要小两个数量级。
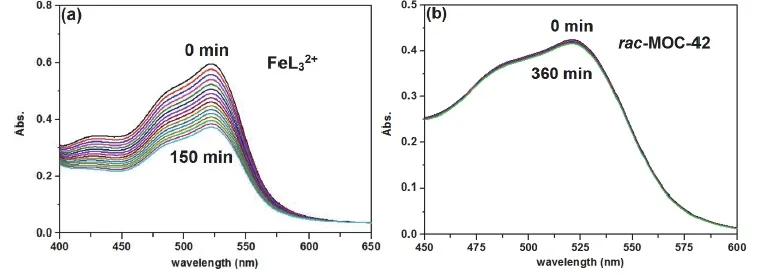
图5 不同时间下 (a)和MOC-42 (b)在35 °C的酸性溶液中的紫外-可见吸收光谱
进一步将不同温度下的解离速率常数的对数lnk对温度的倒数1/T作图并进行线性拟合。如图7所示,金属配体FeL32+和MOC-42计算得到的Fe(II)中心的分解活化能分别为126.6 kJ·mol−1和135.9 kJ·mol−1。可以看出两者的分解活化能相差不大。用不同温度下分解速率常数和温度比值的对数ln(kD/T)对温度的倒数1/T作图并进行线性拟合,结果如图8所示。由直线的斜率以及截距可以分别计算出分解反应的活化焓Δ≠Hmϴ和活化熵Δ≠Smϴ。其中,金属配体FeL32+和MOC-42的Δ≠Hmϴ数值分别为124.4 kJ·mol−1和133.3 kJ·mol−1。FeL32+的活化焓更小,表明金属配体FeL32+分解所需能量更低。而对于活化熵Δ≠Smϴ,FeL32+和MOC-42的Δ≠Smϴ分别为76.9 J·K−1·mol−1和69.4 J·K−1·mol−1,这表明金属配体FeL32+更倾向于发生分解反应。由上面得到的热力学数据可以计算得到,FeL32+和MOC-42分解反应的吉布斯自由能Δ≠Gmϴ分别为101.5 kJ·mol−1和112.7 kJ·mol−1,这表明MOC-42中的Fe(II)金属中心相对于自由配体FeL32+来说更难发生分解反应。
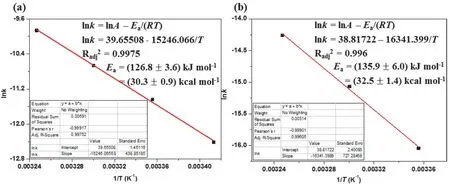
图7 (a)和MOC-42 (b)在酸性溶液中的分解反应表观活化能Ea的拟合结果
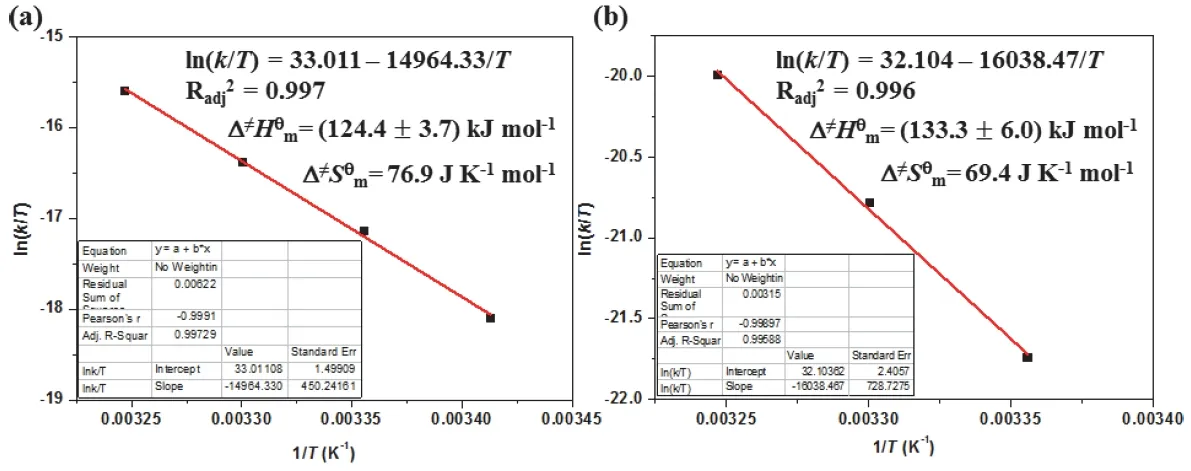
图8 (a)和MOC-42 (b)在酸性溶液中的分解反应活化焓的拟合结果
综上,在化学动力学因素方面,MOC-42的解离速率常数要远小于FeL32+。而在化学热力学因素方面,FeL32+和MOC-42的热力学数据相差并不大。虽然FeL32+和MOC-42的热力学数据可以在一定程度上解释MOC-42中的Fe(II)金属中心更难发生分解反应,但与动力学因素相比并没有起到决定性的作用。因此,MOC-42中Fe(II)中心的分解被显著抑制主要是由动力学因素控制的。
3 实验安排和教学组织建议
本实验建议采用模块化教学,可以分为三个阶段来进行学时安排。第一阶段是L和FeL3(BF4)2的合成及其核磁表征,需要6小时;第二阶段为MOC-42的合成及其核磁表征和核磁滴定实验,需要6小时;第三阶段为紫外-可见吸收光谱探究MOC-42的分解动力学,需要6小时。
该实验课参与的学生人数,每个教学时段为12–16人。其中,FeL3(BF4)2与MOC-42的合成以两个同学为一组来进行实验。核磁相关表征则是全体同学共同参与,一起学习测试与分析数据的方法。探究分解动力学的实验,建议将参与实验的学生分为四组,每组同学负责测试一个温度下的分解速率常数k。
4 实验注意事项和安全须知
(1) 配体与分子笼在合成的过程中,应用溶剂充分洗涤干净,把产品转移至离心管中,用力摇晃,再用离心机进行分离。因用量较少,不建议进行过滤。洗涤干净后,将固体在60 °C左右烘干,这样产品在核磁上才会有较为清晰的产物信号。
(2) 吡啶-3-甲醛要现取现用,因为其较容易被氧化,用完后也应避光保存。为保证安全,取用的时候需要带上口罩和手套,并在通风橱内进行。
(3) 实验中使用的四(乙腈)四氟硼酸钯(II)有轻微的污染性,勿将其直接排入环境中,应倒入相应的废液桶中。
(4) 如果核磁表征后发现产品不纯,可以用少量良溶剂将产品恰好溶解完全,再用不良溶剂进行沉淀洗涤,反复几次,便可提高产品的纯度。
(5) 核磁滴定实验需要合理安排时间,每组同学负责一个比例的核磁滴定测试样品的准备。然后将核磁管统一加热半小时以上,一起进行测试。
(6) 注意测试MOC-42的核磁谱图时,测试样品在氘代试剂中的浓度不应该太低,否则核磁信号会较弱。
5 结语
本文介绍了用分步自组装策略构筑金属有机笼,并对其进行物理化学性能研究的一个新的综合化学实验。本实验新颖实用,在合成上用尽可能简洁的步骤得到异金属有机分子笼,在表征方法上让学生更进一步地认识核磁在现代化学中的应用。在探究Fe(II)中心的分解动力学中,用学生较为熟悉的紫外-可见吸收光谱仪结合物理化学的基础知识来进行实验探究,有利于训练本科生处理数据以及作图的基本能力。该实验有助于引导学生独立思考与提出具有探究价值的化学问题,进一步帮助学生发展创新意识素养和科学探究能力。
