将“锂键”概念拓展到化学概论课程的氢键知识教学
2021-07-14臧宏瑛王永慧李阳光
臧宏瑛,王永慧,李阳光
东北师范大学化学学院,多酸科学教育部重点实验室,长春 130024
当今科技战是大国竞争的主战场。在这一背景下,作为化工、材料、能源、生物技术等领域的相关基础学科,化学学科与技术飞速发展,新的理论、概念不断地拓展我们知识的边界。大学化学教学不仅要使学生掌握化学学科的基础知识,还需要扩展教学内容,引导学生适当接触前沿研究,尤其是与热点领域相关的前沿研究。这种教学内容的扩展,首先需要考虑新知识与化学基础知识体系的联系。所引入的新知识应该能与学生所学的基础知识相印证,这样不但易于学生学习和接受新知识,又能助其复习和理解基础知识。其次,新知识的扩展应选择易引起学生兴趣的内容,例如与学生日常生活相关的知识。
分子间相互作用在决定物质结构和性能时起着十分关键的作用。氢键有方向性,它是由氢原子和高电子密度区域相互吸引而形成,氢键特性被广泛应用于生命科学以及晶体工程学领域中。锂与氢属于同一主族元素,锂键同氢键类似,但又存在很多不同之处。对电池中锂键化学的基本和深刻理解对于构建安全、高性能的锂电池至关重要。近年来,因锂电池在新能源汽车中的广泛应用,锂键这一概念受到越来越多研究人员的关注,很适合作为扩展内容,引入大学化学教学。本文作者以讲授氢键这部分知识为例,探讨如何将科学前沿发现之一的“锂键”作为远迁知识拓展融合到氢键概念讲授中,以拓宽学生的视野,提高学生学习兴趣,培养学生的创新思维。
1 锂键的概念与发展
20世纪初, Huggins、Latimer和Rodebush[1]首先提出氢键概念。随后他们和Pauling[2,3]在1920–1936年期间完善了氢键理论。在后来的深入研究中,氢键理论得到了充分的发展,并成为大学化学教学中认识分子间相互作用的一个重要的基础知识。1959年,Shigorin[4]首次提出类比于氢键的锂键概念。锂和氢是同族(即IA族)单价元素,Shigorin在比较氢键和锂键的红外吸收光谱时发现两者有相似之处。最初,这种提法因为缺乏足够的理论和实验证明而没有被广泛接受。直到1970年,Allen[5]通过理论计算证明锂键的存在,这一概念才引起人们重视。1975年,科学家首次从实验上证实锂键的存在,其形式如下:X···Li―Y (X为H2O、NH3、(CH3)2O、(CH3)3N等分子中电负性大的O和N原子,可以接受Li原子形成锂键;Y为与锂原子共价连接的电负性较大的卤素原子,如Cl、Br);若为(LiY)2单元,Y还可以是OH、F、NH2、NF2等基团[6]。1978年,Ault和Pimentell[7]在研究一些配合物基质隔离的光谱时指出氢、锂在周期表中属同族元素,它们的原子半径都较小,具有易于脱落的价层电子ns1(H只有1个核外电子),氢能形成氢键, 则锂在一定条件下也能形成类似于氢键型的锂键(表1)。今天人们已经对锂键的概念形成共识,当锂与带有孤对电子的电负性较大的原子或基团接近时(也可扩展到电负性较弱的基团),产生类似于氢键的静电相互作用称为锂键(图1)。
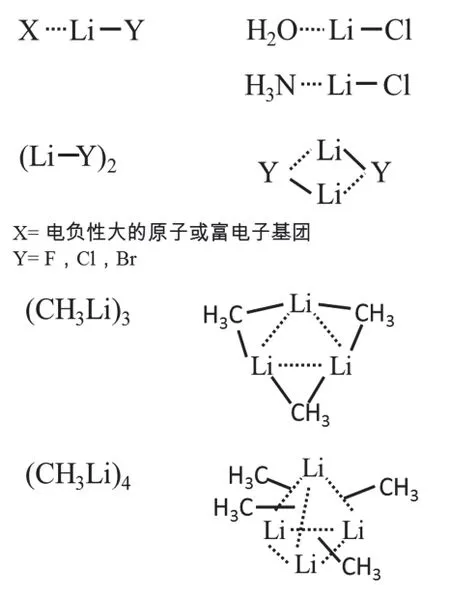
图1 锂键的化学表达通式及部分三聚体、四聚体锂键化合物锂键形式

表1 氢、锂化学键键长、偶极矩部分实验数据
锂硫电池中,硫与电极上的主客体不寻常的相互作用曾是个长期困扰研究人员的问题。诺贝尔奖获得者Goodenough[8]于2015年通过锂键作用解释了这个问题,指出多硫锂化物(Li2Sx)中的Li和基底上给电子官能团之间形成的锂键,能够阻止Li2Sx在电解液中的溶解,进而缓解Li2Sx在锂硫电池的穿梭效应。Li2Sx和给电子体之间的锂键是一种偶极-偶极作用,使7Li的NMR信号向低场移动,锂多硫化物和富电子供体(例如吡啶氮)之间的锂键被验证为偶极-偶极相互作用。值得注意的是,Li键的形成引起了Li信号向NMR谱中低场位移,这也是H键的典型特征。Li键已被广泛用于解释多硫化锂与硫主体之间的相互作用。我国科学家在这一领域也有深入研究。例如清华大学张强教授团队[9]首次利用密度泛函理论计算和实验手段确定了锂键的几何构型、键级、巴德电荷、偶极迁移等特征。该工作证实锂键不仅可以描述Li2Sx和硫载体之间的相互作用,还可以阐释液态电解质中锂离子的溶剂化结构和金属锂负极表面的锂成核机制。除硫正极外,还期望锂键能解释锂离子电池中Li与有机正极之间的相互作用,并提供有关充电/放电机理的见解。锂键为理解电解质中的锂-溶剂/阴离子相互作用提供了机会,锂键通过形成离子-溶剂配合物来改变电解质的稳定性,锂键降低溶剂的最低未占据分子轨道(LUMO)能级会促进电解质的分解[10]。锂键还能够调节电池中的锂转化率。在锂金属负极中,锂的剥离和沉积与锂键的演化密切相关。在Li+还原过程中,来自电解质的Li逐渐失去与溶剂的接触,从负极获得电子,并同时与负极骨架形成新的键,造成不同的锂还原超电势,从而影响锂的转化率[11]。
2 锂键的分类与本质
根据前线分子轨道理论计算的锂键键能大小,可以将锂键分为三类[12,13]。类型一:(LiH)2和(LiF)2的二聚体中的锂键,通式记作Li―Y···Li―Y,在这一类型中锂键键能最大,通常大于104 kJ·mol−1;类型二:代表性化合物如H2O···LiF,它与供体分子形成的锂键,通式记作X···Li―Y (X = NH3,H2O,CH3OH;Y = H,F,Cl),该类型的锂键键能在41.8–104 kJ·mol−1之间,是常见锂键的键能大小;类型三:含锂化合物如LiH和LiF与含有π键的分子之间形成的锂键,例如,C2H4···LiH,C2H2···LiF,这类锂键键能最弱,小于41.8 kJ·mol−1。
另外,按照成键类型,锂键可分为:(1) 离子型锂键络合物,该类络合物以静电相互作用为主;(2) 共价型锂键络合物,该类络合物Y为电负性较小的基团或原子(Y = H,BeH,BH2,CH3),形成多中心键(Li―Y)n(2 ≤n≤ 6);(3) 离子型和共价型共存的锂键络合物,该类络合物中既包含静电相互作用也包括共价相互作用。
(Li-Y)2分子的二聚体会发生环状聚合,聚合能(DE)为单体二聚时放出的能量,DE值近似为负2倍锂键键能。而X···Li―Y分子,多数为直线型结构,形成络合物X···Li―Y过程所放出的能量称为络合能(CE),数值近似为锂键键能的负值。DE或CE的数值由荷移能和静电作用能综合作用计算得出数值。当Y为电负性较小的H、C、Be、B等时,与锂形成的键具有一定的多中心特征, 荷移能对聚合能贡献较大,因此,该类络合物称为共价型锂键络合物。当Y为电负性较大的F、O、N等时, 静电相互作用能对聚合能贡献特别大,荷移能贡献很弱,因此称离子型锂键络合物。综上,对锂键络合物的DE值或CE值的讨论,实际是对锂键本质的讨论,通过对比不同成分对锂键的贡献,可知静电作用为锂键的本质。
3 锂键与氢键的联系与区别
锂键与氢键有很多共同点。它们都存在电子给予体和接受体的相互作用;在形成的配合物或聚合物中,H―X或Li―X键均导致键长伸长,其伸缩振动频率都向低频方向位移;对于对称性的配合物或聚合物,它们的成键原理类似,可用分子轨道理论解释。但对非对称性的配合物或聚合物,其成键原理各有一些差异,体系较为复杂。
尽管锂键与氢键有一些相同之处,但是它们之间也存在着明显的不同(表2)。首先,氢键是在质子给体和受体之间形成的,具有饱和性和方向性;但是,因为锂原子的金属性和更大的半径,锂键并没有饱和性和方向性的限制。第二,从核磁表征的结果来看,氢键具有部分共价键的性质,但是锂由于其金属性质,锂键更具静电性。锂化合物倾向于形成多聚物,但在气态碱金属卤化物中也存在一定浓度的二聚物,在这些二聚物中,锂和两个原子作用形成所谓的锂键[14]。第三,锂键偶极矩更大、键能更强,当电子给体相同时,锂键键能按Y = F,Cl,Br的顺序依次增大,而氢键键能按Y = F,Cl,Br的顺序依次减小;锂键复合物中的电荷是从电子给体向Li―Y中的Li原子转移,Li原子是主要的电子受体,氢键复合物中的电荷是从电子给体向HY转移,并进行电荷分配,Y原子是主要的电子受体;形成复合物后,锂原子的净电荷减小而氢原子的净电荷增加,锂原子能量降低而氢原子能量升高;电荷转移在氢键比在锂键中发挥着更重要的作用,静电作用在锂键比在氢键中占有更主导的地位[15]。比如锂硫电池中Li2S6@石墨烯吡啶氮上的键能为0.64 eV (61.75 kJ·mol−1),而氢键为0.04–0.22 eV (3.86–21.23 kJ·mol−1)[8,9]。此外,锂键的键能要远小于Li―O (341 kJ·mol−1)和Li―F(573 kJ·mol−1)离子键的键能。第四,氢键中H―Y和H···X的间距相差很大,然而锂键中Li―X和Li···Y更加均匀。第五,锂键中锂的传输和氢键中氢传输不同,锂更加容易传输,并且锂的传输能垒对配位原子的类型不敏感。
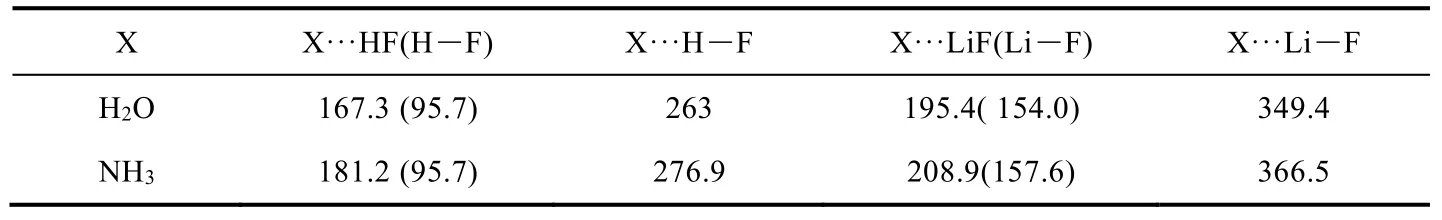
表2 HF、LiF与水、氨(X)形成氢键和锂键前后的键长对比(pm)
4 教学建议
在“化学概论”中讲解氢键知识的章节,可以导入锂键的化学知识作为氢键知识学习的巩固与拓展。从“被‘电量不足’支配的恐惧感”等生活中常见的情景出发,结合真实人物事迹(瑞典皇家科学院将2019年诺贝尔化学奖授予John B. Goodenough、M. Stanley Whittingham和Akira Yoshino三位科学家,以表彰其在锂电池发展上所做的贡献),可以有效调动学生的注意力和课堂投入。通过锂键和氢键性质的对比,可以加深学生对于氢键的理解。同时,锂键化学的新能源研究热点属性可以引导有兴趣的学生主动查阅文献、关注最新研究成果,启发学生进行自主学习和淘金式学习。并参与新能源相关的创新实验。对于青年教师而言,通过不断关注前沿研究动向,可实现教学和科研的共同进步和发展。
5 结语
锂键是一个与氢键有相关性的科学概念。对于前沿性、难易程度、与基础知识体系的联系等方面而言,锂键都适合作为氢键知识的扩展,引入大学化学的教学中。在传统经典氢键教学过程中引入锂键知识,可以使课堂生动有趣,激发学生的学习兴趣,提升学生的学习积极性,开阔学生的视野,夯实学生的化学基础,激发学生的创新潜能。另外,研究前沿新知识的引入能够督促授课教师掌握最新研究动向及成果,提升教学水平的同时提升自己的科研能力。希望本文对化学概论教材改革和课堂教学有所帮助。
