多光谱法结合分子模拟技术研究多西他赛与人血清白蛋白的作用
2021-07-14霍彩霞何丽君田淑丽
霍彩霞, 何丽君, 石 雷, 狄 婧, 田淑丽
(1.兰州城市学院化学化工学院,甘肃兰州 730070 2.兰州交通大学化学与生物工程学院,甘肃兰州 730070)
多西他赛(Docetaxel,DT)在临床上用于治疗乳腺癌、卵巢癌、子宫癌、胃癌、胰腺癌、肺癌等癌症,该药主要是通过生物细胞内的特殊调控抑制癌细胞的扩散,从而发挥特异性免疫作用[1,2]。作为紫杉醇的衍生药物,DT的抗肿瘤活性优于紫杉醇,但会对人的运动神经、消化系统等表现出一定的毒副作用[3]。目前,多数药物能够达到治疗效果的方式是药物进入血液与蛋白结合形成配合物,经血液运输到达人体患病处释放药物分子[4]。在药物治疗期间,通过水果及谷物摄入辅酶可以提高人体的抗氧化力和免疫力,但同时也会影响药物的治疗效果。有关DT的研究报道多见于高活性低毒性的多西紫杉醇剂型的开发[5,6]、治疗机理及耐药性的研究[7,8]、联合药物治疗安全评价[9,10]等,对于DT和人血清白蛋白(Human Serum Albumin,HSA)相互作用的研究较少。
本文以DT和HSA作为研究对象,综合利用荧光光谱法、紫外光谱法、红外光谱法、圆二色谱法,并结合分子模拟对接技术,对DT与HSA的相互作用机理以及辅酶对DT-HSA体系的影响进行了详细探究。从分子层面讨论DT在人体内的药用机制,为用药期间的临床试验和食品摄入提供有益信息。
1 实验部分
1.1 仪器与试剂
RF-5301PC荧光光度仪(日本,岛津公司);UV-2550紫外可见分光光度计(日本,岛津公司),Nicolet Is 10傅里叶变换红外光谱仪(美国,Thermo Nicolet公司);Olis DSM 1000双光束圆二色光谱仪(美国,OLIS DSM公司)。
人血清白蛋白(HSA,Sigma)储备溶液:用pH=7.40 Tris-HCl缓冲溶液配成1.0×10-5mol·L-1;多西他赛(DT)储备溶液:先加1滴丙酮溶解DT(纯度≥98%,贵州迪大生物科技有限公司),再用无水乙醇配成1.0×10-3mol·L-1。华法林(Warfarin,WF)和布洛芬(Ibuprofen,IBU)溶液的浓度均为2.0×10-3mol·L-1;辅酶Q10(CQ10)、辅酶A(CoA)、维生素B1(VB1)、维生素C(VC)、核黄素(VB2)、维生素E(VE) 及L-氧化型谷胱甘肽(GSH)溶液,浓度均为1.0×10-4mol·L-1;溶液于4 ℃避光保存。实验用水均为超纯水。
1.2 实验方法
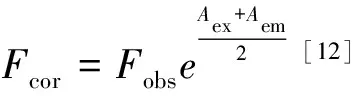
实验2:于1 cm比色皿中移入3.0 mL HSA溶液,设定λex=220~302 nm,逐次增加1 nm,在温度为298 K下,扫描HSA的荧光光谱;再加入40 μL 1.0×10-3mol·L-1的DT溶液进行反应,测定DT-HSA的三维荧光光谱;扣除等量缓冲溶液与配体的荧光干扰。
实验3:以pH=7.40的Tris-HCl缓冲溶液为参比,测定HSA、DT及摩尔比为1∶1 DT-HSA体系的傅里叶红外光谱,对DT-HSA体系和DT的红外光谱差减得到与DT作用后HSA的红外光谱。用软件Nicolet Omnic和Peakfit V4.12对与DT作用前后HSA的红外光谱酰胺Ⅰ带进行Gauss峰拟合、基线校正、去卷积以及二阶导数处理。
实验4:以Tris-HCl缓冲溶液为参比,池径1 mm,扫描速度2.2 nm·s-1,扫描HSA与DT-HSA体系在200~280 nm波长范围内的圆二色谱,考察反应前后HSA中α-螺旋结构含量的变化情况。
实验5:使用Schrödinger 10.2和该软件的Glide模块分别进行人血清白蛋白与药物的对接。先进行蛋白质结构准备,包括加氢、对缺失的原子和残基及loop区进行修补等,进而产生格点,最后与配体分子进行对接。
2 结果与讨论
2.1 荧光猝灭机理
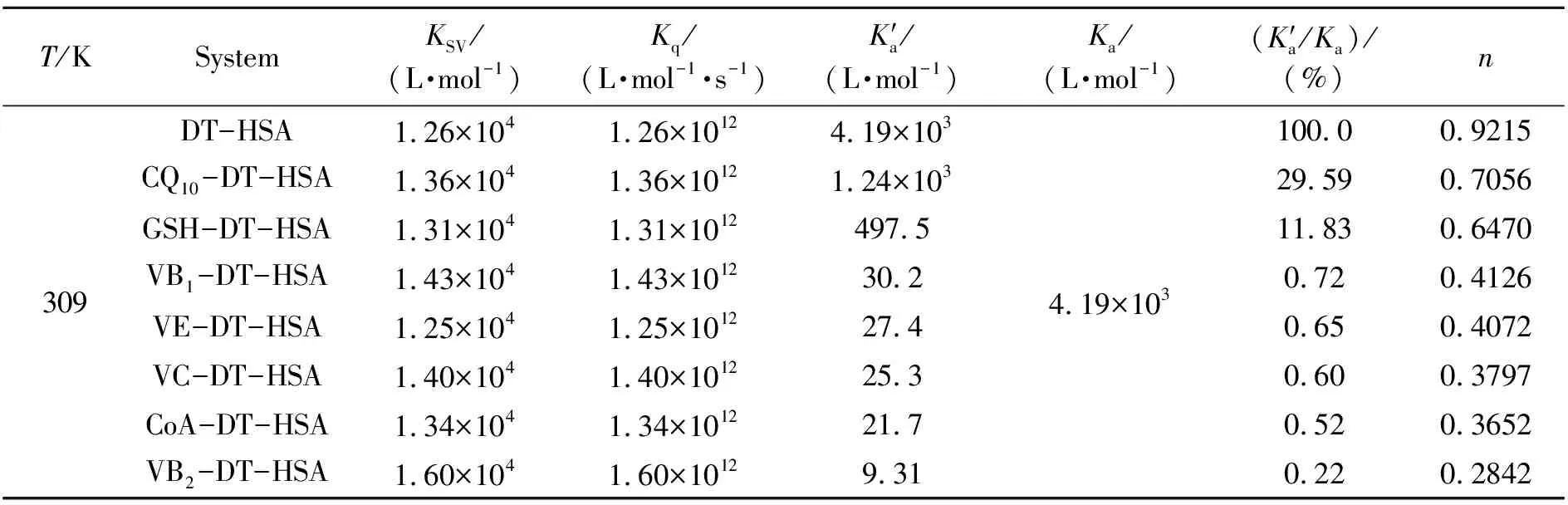
图1右上角为DT-Tris-HCl体系的荧光光谱曲线,在波长280 nm激发下,DT在310 nm处发射峰的荧光强度随其浓度的增大而增强,同时对HSA在336 nm处的最大荧光特征峰强度也会产生影响,进行空白扣除。从图1可看出,随着DT浓度的增大,HSA的荧光发射峰强度有规律的降低,峰位发生明显蓝移,说明DT对HSA的内源荧光具有猝灭作用。以Stern-Volmer方程[13]处理实验温度下DT对HSA的荧光猝灭数据,得到猝灭速率常数Kq和动态猝灭常数KSV(表1)。KSV随着温度的升高而减小,同时,Kq值远大于小分子对HSA的最大扩散碰撞猝灭常数2.0×1010L·mol-1·s-1,可初步推断DT对HSA荧光的猝灭机制为静态猝灭。

图1 温度309 K下DT对HSA的荧光发射光谱(pH=7.40)Fig.1 Fluorescence emission spectra of HSA in the presence of DT at temperature 309 K(pH=7.40)λex=280 nm;cHSA=1.0 μmol·L-1,cDT(1-8)=0,3.3,6.6,9.9,13.1,16.4,19.7,22.9 μmol·L-1.

表1 DT-HSA体系的猝灭常数、结合常数、结合位点数和希尔系数
由DT-HSA体系的紫外光谱(图2)可知,随着药物浓度增大,HSA在波长278 nm处的吸光度逐渐增强,峰位蓝移4 nm,表明DT与HSA结合形成配合物[13,14]。差谱图显示,DT-HSA与DT的差谱曲线(a)和HSA吸收谱线并不重合,这进一步佐证DT与HSA的相互作用为静态猝灭过程。

图2 温度309 K下DT-HSA体系的紫外吸收光谱(插图为差谱图)Fig.2 UV spectra of DT-HSA system at temperature 309 K(The inset corresponds to the absorption spectra of HSA and the difference spectra between HSA-DT and DT at the same concentration,cHSA=cDT=10.0 μmol·L-1)cHSA=10.0 μmol·L-1,cDT(1-8):0,3.3,6.6,9.9,13.1,16.4,19.7,22.9 μmol·L-1.
2.2 结合常数、作用力和结合距离
DT与HSA的静态猝灭作用符合公式:lg[(F0-F)/F]=lgKa+nlg[Q][4],求得二者间的结合常数Ka和结合位点数n(表1)。Ka随实验温度升高而减小,结合常数达到103数量级,n近似等于1,说明DT分子在HSA有一个结合位点,二者作用形成1∶1的配合物。依据实验温度下DT-HSA体系的热力学参数平均值(ΔH=-29.30 kJ·mol-1,ΔS=-24.94 J·mol-1·k-1,ΔG=-21.66 kJ·mol-1),结合Ross等[15]的研究可判断,DT与HSA通过氢键和范德华力共同作用,二者的结合是一个放热、熵减自发进行的反应。
根据Förter的偶极-偶极非辐射能量转移定理可以计算出DT与HSA的结合距离[13]。HSA荧光光谱与DT紫外光谱图叠加部分的积分面积J=1.49×10-10cm3·L·mol-1,临界距离R0=0.78 nm,DT与HSA的结合距离r=1.48 nm<7 nm,且R0 Hill方程的希尔系数nH可以用来分析配体分子与蛋白质结合的协同性作用。根据文献报道[16]求得实验温度下的nH(表1),由nH的平均值约等于1可知,DT分子与HSA中Tyr与Trp残基的结合对后继配体和蛋白质的结合影响不大,即无药物协同作用。 首先通过比较激发波长在280 nm(同时激发Trp和Tyr残基的荧光)和295 nm(只激发Trp残基的荧光)时HSA的荧光猝灭程度,确定药物与蛋白结合的具体位置[17]。在温度309 K,对DT-HSA体系在λex/λem=280/336 nm和295/336 nm处的荧光强度进行F/F0~cDT/cHSA线性拟合,得到方程斜率k280=-0.0083 和k295=-0.0051,说明DT对HSA的猝灭曲线没有重叠,且280 nm激发时降低程度更大,表明Trp和Tyr残基均参与反应,DT在HSA中的结合位点主要处于亚螺旋域ⅡA。 另设定荧光探针华法林/布洛芬与HSA的浓度比为1∶15时测定DT-HSA体系的荧光强度。结果表明,温度309 K下,三元体系WF-DT-HSA和IBU-DT-HSA的Ka与DT-HSA(4.19×103L·mol-1)相比,Ka(WF-DT-HSA)(24.5 L·mol-1)减小,Ka(IBU-DT-HSA)(1.93×104L·mol-1)增大,但华法林对Ka值的影响明显大于布洛芬,说明华法林与DT共用同一个结合位点ⅡA siteⅠ[12]。 2.5.1 同步荧光测定同步荧光光谱根据荧光发色团的最大发射波长处微环境的变化信息可以判断蛋白质的构象变化[12,13]。固定HSA浓度,增加DT含量,Δλ=15 nm时HSA中酪氨酸残基的荧光猝灭程度较小(KSV=2.20×102L·mol-1),峰位不变;Δλ=60 nm时色氨酸残基最大峰的荧光强度显著降低(KSV=1.16×104L·mol-1),且略有蓝移。这说明DT与HSA的结合位点更偏向色氨酸残基。 2.5.2 三维荧光光谱通过三维荧光光谱等高图,建立HSA及DT-HSA体系完整信息的指纹图谱(图3)。峰1是HSA中肽链羰基骨架的特征峰,峰2反映HSA的生色团Trp和Tyr残基的光谱特性[18]。峰1峰顶坐标(λex/em,F)=(234/334,288.141),峰2峰顶坐标(λex/em,F)=(283/336,421.031)。加入DT后,HSA的荧光峰峰1(234/328,184.648)蓝移6 nm,峰2(283/334,371.381)蓝移2 nm,其荧光强度分别降低了35.92%和11.79%。说明Trp和Tyr残基所处微环境的极性减弱,疏水性增强,构象发生了变化。 图3 HSA、DT-HSA的三维荧光等高线图Fig.3 Three-dimensional fluorescence contours of HSA and DT-HSA cHSA=1.0 μmol·L-1,cDT=13.1 μmol·L-1 2.5.3 傅里叶变换红外(FT-IR)光谱分析蛋白质在红外区的特征吸收带主要有蛋白质骨架C=O伸缩振动引起的酰胺Ⅰ带(1 700~1 600 cm-1)及包含C-N伸缩和N-H弯曲振动耦合信息的酰胺Ⅱ带[19]。FT-IR差谱图(图4a)显示,在加入DT后,HSA的特征峰强度降低,酰胺I带由1 640 cm-1移至1 572 cm-1,O-H伸缩振动峰移动相对微弱,这可能是由于DT和HSA分子间的C=O、O-H基团相互作用形成较强的分子间氢键[20],破坏了HSA中维系原有二级结构稳定性的氢键,同时表明DT与HSA形成配合物中存在氢键。 酰胺Ⅰ带包含不同的二级结构信息,对蛋白质研究更有价值。通过对酰胺Ⅰ带的多次拟合(图4b和4c)确定各子峰与不同二级结构的对应关系,可根据积分面积得到β-折叠(1 610~1 637 cm-1)、无规则卷曲(1 638~1 649 cm-1)、α-螺旋(1 650~1 660 cm-1)、β-转角(1 660~1 680 cm-1)和反β-折叠(1 680~1 700 cm-1)等HSA二级结构的含量。药物DT与HSA作用后,β-折叠和α-螺旋含量分别由25.95%和41.88%下降至15.42%和27.37%,β-转角、无规则卷曲及反β-折叠含量分别由14.53%、10.43%、7.21%增加到22.27%、23.64%和11.30%,而且总增加量和总降低程度基本相同。说明HSA与药物作用后,其二级结构在内部发生转化,对其构象产生了影响。 图4 红外(IR)差谱图和酰胺Ⅰ带高斯拟合图Fig.4 IR difference spectrum and Gauss fitting graph of amide Ⅰ of HSA and DT-HSA system 2.5.4 圆二色(CD)谱法验证HSA构象变化通过分析CD图进一步证实了DT对HSA主链构象的影响[18]。从图5可知,在208和217 nm处出现两个负的特征肩峰,这是HSA中α-螺旋结构的特征峰。随着与DT反应,特征峰强度升高,α-螺旋的含量由39.49%降至24.78%。说明DT通过与蛋白质主肽键结合,维持α-螺旋结构的氢键作用减弱,变为伸展的多肽,导致HSA的构象发生改变。 图5 DT-HSA体系的圆二色谱图Fig.5 CD spectra of DT-HSA 通过分子模拟技术可以更直观的了解药物与HSA的结合位点和作用力类型。从图6a和6b可看到,HSA有足够空间与DT分子相互作用,药物小分子周围的疏水性残基Ala291、Leu(238,219)和Trp214与DT中的甲基存在微弱的疏水作用,带正电荷的His440、Arg(222,218)、Lys(444,195)残基与DT分子中带有孤对电子的羰基氧和苯环形成较强的范德华力;Pro447、Cys448、His440、Glu(188,294,292)和Asp451与小分子间存在氢键。 图6c展示分子静电表面,用蓝色、红色和白色代表正电荷、负电荷和中性残基,分析发现DT分子周围中性残基较多,静电作用存在的可能性较小。DT分子距离Trp214较Tyr452近,说明DT主要猝灭的是HSA中色氨酸的内源荧光,这与前文结论一致,也是对作用力研究的验证和补充。 图6 DT与HSA相互作用的分子模拟Fig.6 Molecular simulation of interaction between DT and HSAa.Molecular docking simulation and 3D diagram;b.Interaction 2D map;c.Electrostatic surface map. 固定HSA与辅酶的浓度比为3∶1,加入不同浓度DT溶液,测定辅酶-HSA和辅酶-DT-HSA体系λex/λem=280/336 nm处的荧光强度,以探究辅酶对HSA及DT-HSA体系的影响。DT对HSA的荧光猝灭效率Q=[(F0-F)/F0]×100%,结果显示,当辅酶单独存在时,对HSA存在较强的荧光猝灭作用,其猝灭程度表现为VB2>CoA>VC>VE>VB1>GSH>CQ10,见表2。 表2 辅酶对DT与HSA相互作用的影响 分析表2中数据,发现辅酶-DT-HSA三元体系的动态猝灭常数Kq值数量级仍为1012,远大于最大动态猝灭速率常数2.0×1010L·mol-1·s-1,说明辅酶的存在对猝灭机制没有影响,仍为静态猝灭;但三元体系的Ka和n都减小,其中VB2影响最大。辅酶对HSA的荧光猝灭效率Q越大,对DT与HSA的结合影响越大,7种辅酶对DT-HSA体系的影响与对HSA荧光猝灭程度的影响表现一致。表明辅酶优先占据结合位点,极大降低了DT与HSA的结合,缩短了DT在人体内的停留时间。可见,辅酶在人体中与药物竞争结合,由此影响药物的疗效。患者在用药期间应当合理安排膳食,以增强机体免疫力,在确保治疗效果的同时降低药物的副作用。 在模拟生理条件下,DT与HSA的猝灭常数随温度的升高而降低,结合紫外光谱证实,DT对HSA内源性荧光的猝灭作用为静态猝灭,用静态猝灭双对数公式计算得到DT与HSA的结合位点数n约等于1。DT-HSA的热力学参数ΔH和ΔS均小于零,表明氢键和范德华力对维持配合物(1∶1)稳定性起重要作用,用分子对接技术进行验证并补充,二者间也存在微弱的疏水力。DT与HSA的结合距离r约为1.48 nm,其主要结合位点位于HSA的亚结构域ⅡA site Ⅰ。nH≈1表明在HSA的结合位点处,药物分子间几乎不存在协同效应。 同步荧光光谱、三维荧光光谱、红外光谱和圆二色谱表明,DT使HSA中Trp残基微环境极性减弱,α-螺旋结构含量减小,构象发生改变。辅酶与DT形成竞争,对DT与HSA的结合有抑制作用,但不影响其猝灭机制。2.3 药物协同性
2.4 结合位点的确定
2.5 DT对HSA构象的影响



2.6 分子对接

2.7 辅酶对HSA及DT-HSA体系的影响
3 结论
