烷基磺酸蒽醌电解质的合成及其在液流电池中的应用
2021-07-10叶子祥储富强林本才
吕 腾,叶子祥,李 泾,储富强,林本才,2
(1常州大学材料科学与工程学院;2江苏省光伏科学与工程协同创新中心,江苏常州 213164)
大规模储能技术可以有效解决可再生能源发电的随机性、间歇性和波动性等问题,实现平滑功率输出、跟踪计划发电,从而提高电网对可再生能源发电的消纳能力,有利于解决弃风、弃光等问题,同时对电网调频、调峰也会发挥重要作用。液流电池(RFB)是一种新型的电化学储能装置,具有能量储存和功率输出彼此独立、结构简单、储能规模大、循环寿命长及安全性高等优点[1-2]。目前,商业化程度最高的液流电池是全钒液流电池(VRFB),但VRFB 价格昂贵,且钒具有一定毒性,废钒电解液的后处理麻烦,还会对环境造成很大的危害[3-5]。
针对VRFB的缺点,近年来研究人员陆续开发了水性有机液流电池(AORFB)[6]和非水性有机液流电池(NAORFB)[7],它们的电解液选用了可持续性更好且种类丰富的具有氧化还原活性的有机分子,例如紫精[8]、茂金属[9]、吡啶鎓[10]、醌[11]、2,2,6,6-四甲基哌啶-1-氧基(TEMPO)[12]、吩嗪衍生物[13]和其他有机小分[14],这些研究为新型RFB 的研究开辟了新的思路。在各种氧化还原活性有机分子中,蒽醌(AQ)已作为AORFB中的阳极电解液得到了广泛研究。液流电池的容量取决于电解质的浓度,而电解质的溶解度却与溶液的pH 值密切相关。大部分AQ分子主要应用于酸性或碱性AORFB[15],这是因为在酸性或碱性溶液中蒽醌及其衍生物才具有较高的溶解度,进而提高液流电池的容量。但是AQ分子在酸性或碱性条件下却容易发生化学降解[16],如在酸性液流电池中,AQ 合成的蒽醌衍生物AQDSH2的氧化还原电势相对于SHE向正向正移了0.21 V,极大地限制了整个电池的开路电压,并且酸性支持电解质和溴基阴极电解液具有很强的腐蚀性和危害性[17]。相较于酸性支持电解质,蒽醌衍生物在碱性AORFB 中稳定性虽然有所改善,但仍会发生化学降解。蒽醌衍生物的降解是其溶解度降低、液流电池容量下降的主要原因。虽然蒽醌在中性溶液中稳定,但其溶解度较低,严重限制了液流电池的容量。因此,提高蒽醌及其衍生物在中性溶液中的溶解度,是推进其在液流电池中应用、提高液流电池容量的关键[18]。
本文以1,2-二羟基蒽醌、2,6-二羟基蒽醌和1,4-二羟基蒽为原料与丙烷磺内酯反应,合成了3种烷基磺酸基蒽醌,通过在蒽醌分子上修饰磺酸基团提高其在中性水溶液中的溶解性,详细对比研究了3 种烷基磺酸基蒽醌的化学结构、性能及其在中性水系有机氧化还原液流电池中的实际应用性能。
1 实验部分
1.1 实验试剂
本实验所用的化学试剂均为分析纯试剂。丙烷磺内酯,2,6-二羟基蒽醌,1,2-二羟基蒽醌,1,4-二羟基蒽醌,NaH购自阿拉丁试剂公司。NaCl,N,N-二甲基甲酰胺,二甲基亚砜,盐酸购自国药集团化学试剂有限公司。实验中所用水均为去离子水。
1.2 烷基磺酸基蒽醌的合成
1,2-AQPSH2合成步骤如下[19]:将2.40 g 1,2-二羟基蒽醌(0.01 mol)加入到三口烧瓶中,以100 mL的二甲基亚砜作为溶剂,滴加等摩尔量的丙烷磺内酯(1.22 g),再加入0.48 g的NaH(0.02 mol),氮气氛围下80 ℃下加热反应24 h,冷却至室温后将其进行抽滤,将得到的固体溶解于1 mol/L NaOH 水溶液中,再滴加过量的盐酸,析出固体产物,再将固体产物过滤后用乙醇反复洗涤3 次,干燥后得到1, 2-AQPSH2。
2, 6-AQDPSH2的合成步骤如下:将2.40 g 2, 6-二羟基蒽醌(0.01 mol)加入到三口烧瓶中,以100 mL的N,N-二甲基甲酰胺作为溶剂,按摩尔量比为1∶2 滴加丙烷磺内酯(2.44 g),再加入0.48 g的NaH(0.02 mol),氮气氛围下80 ℃下加热反应24 h,冷却至室温后将其进行抽滤,将得到的固体溶解于1 mol/L NaOH 水溶液中,再滴加过量的盐酸,析出固体产物,再将固体产物过滤后用乙醇反复洗涤3次,干燥后得到2,6-AQDPSH2。
1,4-AQPSH2的合成步骤如下:将2.40 g的1,4-二羟基蒽醌(0.01mol)加入到三口烧瓶中,以100 mL的N,N-二甲基甲酰胺作为溶剂,滴加等摩尔量的丙烷磺内酯(1.22 g),再0.48 g 的NaH(0.02 mol)提供碱性环境,氮气氛围下80 ℃下加热反应24 h,冷却至室温后将其进行抽滤,将得到的固体溶解于1 mol/L NaOH水溶液中,再滴加过量的盐酸,析出固体产物,再将固体产物过滤后用乙醇反复洗涤3次,干燥后到1,4-AQPSH2,如图1所示。
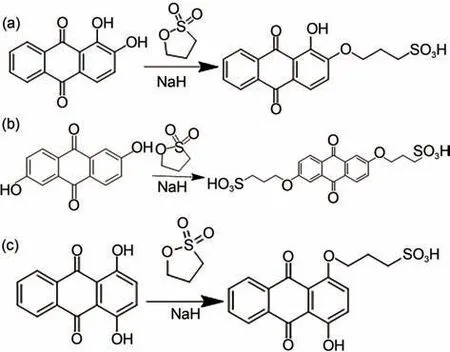
图1 (a)1,2-AQPSH2;(b)2,6-AQDPSH2;(c)1,4-AQPSH2 的合成示意图Fig.1 Synthetic schematic diagram of(a)1,2-AQPSH2;(b)2,6-AQDPSH2;(c)1,4-AQPSH2
1.3 核磁表征
采用Varian 400 MHz 核磁仪对1, 2-AQPSH2、2,6-AQDPSH2和1,4-AQPSH2的化学结构进行表征。
1.4 电化学测试
使用CHI1660E电化学工作站通过三电极系统记录CV曲线(三电极包括预浸在3.0 mol/L NaCl溶液中的Ag/AgCl参比电极,铂丝对电极,使用约有50 nm 二聚体的氧化铝颗粒抛光处理5 mm 玻璃碳工作电极)[20]。对配制好的1mmol/L蒽醌衍生物的1 mol/L NaCl水溶液以25 mV/s的电压扫描速率进行CV测试。
制备一定溶度梯度的1~5mmol/L 1, 4-AQPSH2/1 mol/L NaCl溶液,并用紫外分光光度计测试其吸光度,研究其溶解度。
使用电化学工作站通过三电极系统记录RDE曲线。在测试之前,将溶液用高纯度N2吹扫30 分钟,电极以特定速度旋转,同时电压以25 mV/s的速度从-0.05~-0.7 V 进行线性扫描。根据Levich方程计算得到1,4-AQPSH2的扩散系数,见式(1)
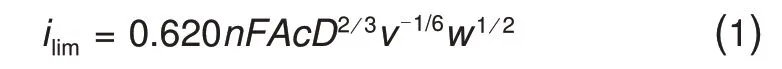
其中,ilim(A/cm2)表示物质传递极限电流密度,n表示反应中电子传递的摩尔数2,F表示法拉第常数96485 C/mol,A表示电极面积0.196 cm2,D表示单位为cm2/s 的扩散系数,v表示运动黏度0.01 cm2/s,w表示电极的转速,单位为rad/s,c表示1,4-AQPSH2的主体浓度,2×10-6mol/cm3。使用Butler-Volmer 方程转化的Tafel 方程计算得到1,4-AQPSH2速率常数,见式(2)
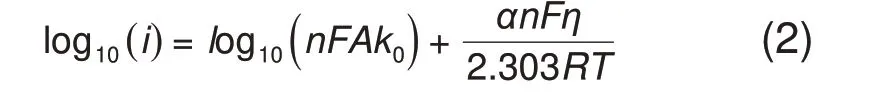
其中,n为2,通用气体常数R为8.314 J/K,温度T为293K,i是测得的电流密度,η是过电位。
使用LANHE 电池测试系统(CT 2001A-5V/3A8CT-Q)对液流电池单电池进行循环测试。
2 结果与讨论
2.1 核磁共振氢谱图(1H NMR)
图2 为1, 2-AQPSH2(a)、2, 6-AQDPSH2(b)和1, 4-AQPSH2(c)的核磁氢谱图。由图2(a)中可知,2.0~4.0 ppm的三个峰是连接在蒽醌上的磺酸内酯上三个亚甲基特征吸收峰,6.0~7.8 ppm处的5个峰是1,2-AQPSH2苯环上的质子峰,图2(b)是2,6-AQDPSH2的核磁氢谱图,2,6-AQDPSH2是对称结构,2.1、3.0 和4.0 ppm 处的峰是三个亚甲基的质子峰,6.8、6.9 和7.1 ppm 处的峰是苯环上的质子峰,图2(c)是1, 4-AQPSH2的核磁氢谱图,如图所示其化学结构与核磁氢谱图也能一一对应,这些结果表明1,2-二羟基蒽醌、2,6-二羟基蒽醌和1,4-二羟基蒽与丙烷磺内酯反应,成功制备了1, 2-AQPSH2、2,6-AQDPSH2和1,4-AQPSH23种烷基磺酸基蒽醌。
2.2 循环伏安法测试(CV)
采用循环伏安法分别测试了1,2-AQPSH2、2,6-AQDPSH2和1, 4-AQPSH2的氧化还原性质,结果如图3 所示。从图中可以看出,3 种烷基磺酸基蒽醌的循环伏安曲线均具有对称结构的氧化还原峰,而且氧化峰和还原峰之间的差距均小于70 mV ,这些结果表明1, 2-AQPSH2、2, 6-AQDPSH2和1,4-AQPSH2的氧化还原均具有良好可逆性,且有较快的电化学动力学性能。随着烷基磺酸基的引入,1, 2-AQPSH2、2, 6-AQDPSH2和1, 4-AQPSH2的可逆氧化还原电位相对于二羟基蒽醌发生了一定的正向偏移,这对于吸电子基团是正常现象,由于2, 6-AQDPSH2上接有两个烷基磺酸基,导致2, 6-AQDPSH2比1, 2-AQPSH2和1, 4-AQPSH2有更大的正向偏移,1, 2-AQPSH2和1, 4-AQPSH2中都含有羟基,羟基的存在对它们电位正向偏移具有抑制作用,导致2, 6-AQDPSH2与1, 2-AQPSH2、1,4-AQPSH2的电极电位相差很大[21]。与标准氢电极(SHE)相比,1,2-AQPSH2、2,6-AQDPSH2和1,4-AQPSH2的可逆氧化还原电位分别为-0.20V、0.61 V和-0.21 V。因此,1,2-AQPSH2和1,4-AQPSH2可以作为液流电池阳极电解质,2,6-AQDPSH2可以用作液流电池的阴极电解质。
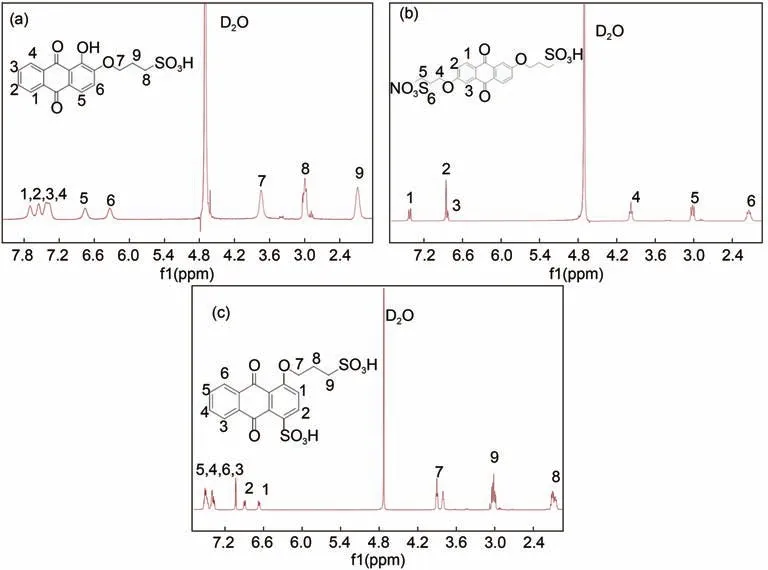
图2 1,2-AQPSH2(a),2,6-AQDPSH2(b)和1,4-AQPSH2(c)的核磁氢谱图Fig.2 The 1H NMR spectra of 1,2-AQPSH2(a),2,6-AQDPSH2(b)and 1,4-AQPSH2(c)
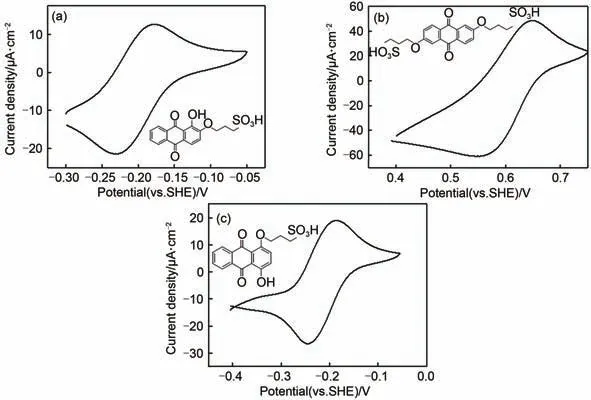
图3 1,2-AQPSH2(a),2,6-AQDPSH2(b)和1,4-AQPSH2(c)的循环伏安曲线图Fig.3 CV curves of 1,2-AQPSH2(a),2,6-AQDPSH2(b)and 1,4-AQPSH2(c)
2.3 溶解度测试
通常,电解质在溶液中的溶解度决定了液流电池储能容量的大小。1,2-AQPSH2、2,6-AQDPSH2和1,4-AQPSH2室温下在1 mol/L NaCl水溶液中的溶解度通过紫外分光光度计测得,1,2-AQPSH2和2, 6-AQDPSH2在1 mol/L NaCl 水溶液中的溶解度较低,分别为0.03 mol/L、0.04 mol/L,不具备实用价值。与1, 2-AQPSH2和2, 6-AQDPSH2相比,1, 4-AQPSH2溶解度较大。如图4(a)所示,由紫外分光光度计测得1,4-AQPSH2溶解度与吸光度的关系图[图4(b)],并通过公式计算得到1, 4-AQPSH2在1 mol/L NaCl 水溶液中的溶解度为0.7 mol/L。相对于二羟基蒽醌在水中的溶解度为1mmol/L,磺酸基修饰后的1, 4-AQPSH2在pH=7 的水溶液中溶解度得到了极大的提升,其主要原因是氧烷磺酸根的亲水性促进了1, 4-AQPSH2在水中的溶解[22]。1, 4-AQPSH2与其他已报道的AORFB 进行比较表明,1,4-AQPSH2可以作为高溶解度、低成本和低氧化还原的液流电池电解质。
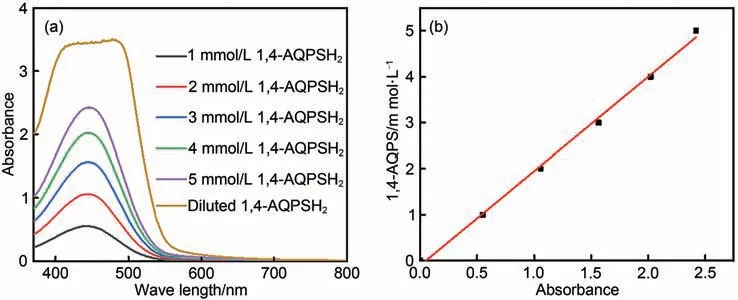
图4 (a)1~5mmol/L与稀释的饱和1,4-AQPSH2溶液的吸光度图;(b)1,4-AQPSH2溶度与吸光度的关系图Fig.4 (a)Absorbance graph of 1~5 mmol/L and diluted saturated 1,4-AQPSH2 solution;(b)Relation graph between solubility and absorbance of 1,4-AQPSH2
2.4 旋转圆盘电极测试(RDE)
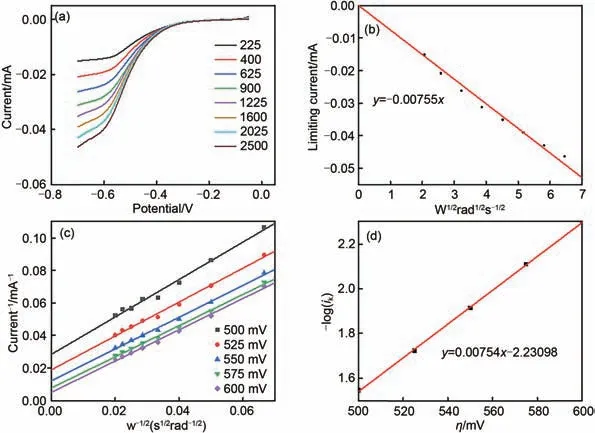
图5 (a)在1.0 mol/L NaCl溶液中以25 mV/s扫描速率在225~2500 r/min之间的不同旋转速率下,对2 mmol/L 1,4-AQPSH2进行RDE测试;(b)极限电流与转速平方根的Levich图;(c)从(a)在不同的过电势得出的Koutecky-Levich图(电流的倒数与旋转速率的平方根);(d)在不同的过电势下从(c)导出的Butler-Volmer方程的拟合图Fig.5 (a)The RDE test was performed on 2 mmol/L 1,4-AQPSH2 in 1.0 mol/L NaCl solution at 25 mV/s scan rate at different rotation rates between 225~2500 rpm;(b)Levich diagram of limiting current and square root of speed;(c)Koutecky-Levich diagram(reciprocal of current and square root of rotation rate)derived from(a)at different overpotentials;(d)The fitting diagram of the Butler-Volmer equation derived from(c)under different overpotentials
采用旋转圆盘电极法测试了1,4-AQPSH2的电化学动力学参数,测试结果如图5所示。图5(a)是在不同转速下(225~2500 r/min),测量相对于Ag/AgCl从-0.05~-0.7 V 的伏安曲线图。图5(b)是图5a 显示的极限电流与旋转速率的平方根进行线性拟合得到Levich 图,再根据Levich 方程,可以计算得到1, 4-AQPSH2的扩散系数2.85×10-5cm2/s。图5(c)是在不同过电势(500~600 mV)下旋转速度的平方根与其所显示的电极电流线性拟合所得的Koutecky-Levich 图。图5(d)是根据图5(c)中不同电势下线性方程关于Y轴截距所显示的电流(ik)的对数形式与不同电势的线性拟合得到的Tafel 图,依据Butler-Volmer 方程转化的Tafel 方程,计算得出1,4-AQPH2的电子转移速率常数为3.88×10-2cm/s。1, 4-AQPSH2的扩散系数和电子转移速率常数远高于常见的无机氧化还原活性阳离子,如VO2+/,V3+/V2+[24],Fe3+/Fe2+[25]等,因此1,4-AQPSH2在电池测试时具有较好的极化曲线和电化学性能,可用于液流电池阳极电解质材料。
2.5 单电池测试
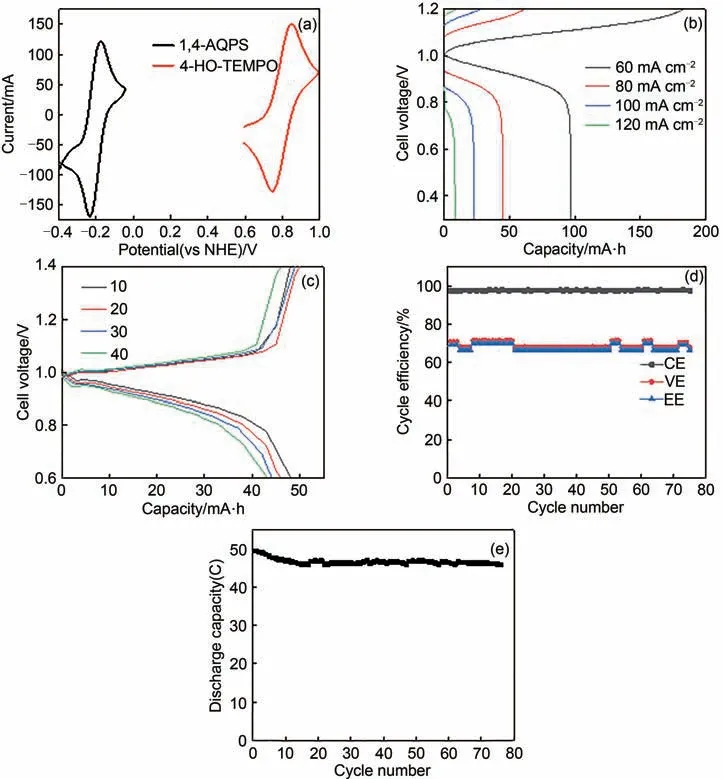
图6 (a)1,4-AQPSH2和4-HO-TEMPO的循环伏安图;(b)0.05 mmol/L 1,4-AQPSH2‖212Nafion‖0.1 mmol/L 4-HOTEMPO电池在60、80、100和120 mA/cm2 电流密度下的充放电图;(c)电流密度为60 mA/cm2时,电池在第10、20、30、40圈的充放电曲线;(d)电池在60 mA/cm2 的电流密度下的循环测试图;(e)电池在60 mA/cm2 的电流密度下的放电容量图Fig.6 (a)Cyclic voltammogram of 1,4-AQPSH2 and 4-HO-TEMPO;(b)Charge and discharge graph of battery(0.05 mmol/L 1,4-AQPSH2‖212Nafion‖0.1 mol/L 4-HO-TEMPO)at 60,80,100 and 120 mA/cm2;(c)Charge and discharge graph of battery at the 10th,20th,30th,and 40th circles at 60 mA/cm2;(d)Cycle test graph of battery at 60 mA/cm2 current density;(e)The discharge capacity diagram of the battery at a current density of 60 mA/cm2
为了考察1,4-AQPSH2作为阳极电解质在液流电池中的性能,我们配制了0.05 mol/L 1, 4-AQPSH2的阳极电解质,以0.1 mol/L氮氧自由基哌啶醇(4-HO-TEMPO)为阴极电解质,以1 mol/L NaCl水溶液作为支持电解质,以Nafion212作为离子交换膜组装了1, 4-AQPSH2/4-HO-TEMPO 液流电池单电池。图6(a)是1, 4-AQPSH2和4-HO-TEMPO的循环伏安曲线图,由图可知它们的氧化峰和还原峰的中值电势为-0.2 V 和8.0 V,因此1, 4-AQPSH2/4-HO-TEMPO 电池的开路电压约为1.0 V。在不同电流密度下对电池进行充放电测试(60~120 mA/cm2),得到容量-电压曲线[图6(b)]。从图6(b)中可知随着电流密度的增大,电池的电阻逐渐增大,电池的电压效率逐渐减小,但在60 mA/cm2时电池的库仑效率较低,可能是因为第1个循环中电解液对电极的浸润不够充分所致,几个循环之后库仑效率恢复到正常[图6(c)]。电流密度为60 mA/cm2时,电池内阻较小,在电流密度为60 mA/cm2,电压范围为0.3~1.2 V,进行电池循环测试,测试结果如图6(d)所示:电池的能量密度约为68%,库仑效率约为97%,电压效率约为69%。由图6e 可知在电流密度为60 mA/cm2下经过75个充放电循环测试,电池的放电容量没有明显的降低,表明1, 4-AQPSH2在该体系中具有良好的稳定性[26]。
3 结论
为提高蒽醌衍生物在中性水系溶液中的溶解度,设计合成了3 种烷基磺酸基蒽醌。与1, 2-AQPSH2和2, 6-AQDPSH2相比,1, 4-AQPSH2的具有更大的溶解度。1, 4-AQPSH2在1 mol/L NaCl水溶液中溶解度高达0.7 mol/L,且具有较大的扩散系数(2.85×10-5cm2/s)和较快的电子转移速率常数(3.88×10-2cm/s)。组装了1,4-AQPSH2/TEMPO液流电池单电池,开路电压达到1.0 V,单电池可以在60 mA/cm2的电流密度下稳定运行50圈以上,能量效率保持在68%以上。这些结果表明1, 4-AQPSH2可以用于中性水系液流电池的阳极电解质,有助于推动中性水系有机氧化还原液流电池的应用和发展。
