丹皮酚通过调节中脑星形细胞神经营养因子的表达及细胞质/核易位抑制类风湿关节炎成纤维滑膜细胞炎症反应
2021-07-09邵玉宝鲍兰馨汪陶荣李文昊周文瀚戴锦辰陈萌檬赵大海陈晓宇
邵玉宝,鲍兰馨,汪陶荣,李文昊,周文瀚,戴锦辰,陈萌檬,叶 静,赵大海,陈晓宇,
(安徽医科大学基础医学院1.组织胚胎学教研室、2.病理学与病理生理学、3.形态学实验中心、4.临床医学系,安徽 合肥 230032;5.安徽医科大学第二附属医院呼吸内科,安徽 合肥 230601)
类风湿关节炎(rheumatoid arthritis,RA)是一种慢性全身性的免疫疾病,通常表现为手脚关节肿胀和疼痛,周围血管和神经也可能会参与其中[1]。在RA关节中经常观察到的先天性和适应性免疫反应的慢性激活以及相关的缺氧和低血糖水平,对内质网(ER)造成了相当大的负担,最终可能导致未折叠蛋白反应(UPR)与内质网相关蛋白降解(ERAD)一起被激活[2]。UPR会促进ER膜上蛋白活化转录因子(activating transcription factor 6,ATF6)发生剪切,进一步激活PI3K-AKT-NF-κB通路,促进炎症的进一步发生;同时激活PERK的磷酸化,激活下游eIF2α磷酸化,最终促进NF-κB的活化[3]。中脑胶质细胞神经营养因子(mesencephalic astrocyte derived neurotrophic factor,MANF)与BIP78以钙依赖形式相互作用定位在内质网膜。当炎症发生时,引发内质网应激,内质网中Ca2+释放入胞质,MANF分泌。MANF可减轻多种由ER应激所引起的损伤,如减小肝损伤,促进神经再生,角膜修复,抑制骨关节炎等[4-5]。研究表明,MANF能够抑制胶原诱导的兔关节炎的发展[4]。在肝癌细胞中,MANF在SUMO蛋白的作用下向细胞核转移,与核因子p65(nuclear factor kappa-B p65,p65)结合并抑制其转录活性[5]。
丹皮酚是从毛茛科植物牡丹的干燥根皮中提取物出来的一种有效成分,具有广泛的抗炎活性[6]。丹皮酚具有良好的对抗ER应激效果,可以改善衣霉素损伤的小鼠主动脉的内皮依赖性舒张,通过5'腺苷单磷酸激活的蛋白激酶和过氧化物酶体增殖物激活的受体δ激活,进一步降低ER应激水平及GRP78、ATF6、eIF2α蛋白表达及ROS的过量生产并提高NO的生物利用度[7-9]。
目前,丹皮酚与MANF的关系尚不明确,丹皮酚是否会影响MANF的表达,是否会影响MANF细胞质/核易位。本文主要研究丹皮酚通过对MANF蛋白表达水平及细胞质/核易位的调控对RA成纤维滑膜细胞炎症反应影响。
1 材料与方法
1.1 材料
1.1.1细胞与试剂 人类风湿关节炎成纤维滑膜细胞(RA-FLSs)购买于上海冠导生物工程有限公司。TRIzol(15596026),购买于InvitrogenTM;NEAA(PB180424)、ITS-A(PB180430)、NaP(PB180422)及胎牛血清(164210)购买于普诺赛生命科技;DMEM培养基(SH30022.01)购买于Hyclone;CCK-8(C0037)购买于碧云天生物技术;TNF-α(H8916)购买于Sigma公司;MANF(ab67271)、p65(8242T)与Actin(ab8226)购买于Abcam;N-cadherin(3195S)、Vimentin(5741S)、β-Tublin(15115S)、GAPDH(5174S)与Lamin-B(17416S)购买于Cell Signaling Technology;逆转录试剂盒PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit(6210A)购买于Takara公司;实时荧光定量试剂盒Applied BiosystemsTMSYBRTMGreen(4385610)购买于ThermoFisher公司;
1.1.2仪器 激光扫描共聚焦显微镜LSM880(德国);电泳仪(DYY-10,北京六一仪器厂);Image-Pro plus 图像处理系统;荧光定量仪PCR-ABI(赛默飞世尔科技,美国);多功能酶标仪(PerkinElmer,美国);GraphPad Prism 7.00数据处理软件。
1.2 实验方法
1.2.1细胞培养 RA-FLSs培养在高糖DMEM培养基中,添加质量分数为1%的非必须氨基酸(NEAA)、胰岛素-转铁蛋白-硒(ITS-A,1mmol·L-1)、丙酮酸钠(NaP)及1%的胎牛血清(FBS),于37 ℃、5% CO2细胞培养箱中,每2 d更换一次新鲜培养基。
1.2.2细胞增殖抑制 将对数生长期的细胞铺在96孔板中,每孔100 μL(1 000个细胞),使用TNF-α(10 μg·L-1)刺激12 h后,加丹皮酚处理48 h。更换新鲜培养基,每孔添加10 μL CCK-8检测试剂,于37 ℃继续培养2 h,酶标仪检测460 nm处吸光度值。
1.2.3免疫印迹 取对数生长期的细胞,铺6孔板中,待细胞铺满皿底面积一半时,TNF-α(10 μg·L-1)处理12 h,丹皮酚浓度处理24 h,获取细胞沉淀块。细胞重悬在磷酸盐缓冲溶液(PBS)中,添加2 X SDS裂解液(100 mmol·L-1Tris-Cl(pH 6.8)、4%(W/V)SDS、20%(V/V)Glycerol、200 mmol·L-1DTT(Dithiothreitol))得蛋白溶液,其中PBS ∶2 X SDS=1 ∶1(V/V)。使用BCA试剂盒进行蛋白浓度测定,SDS-PAGE电泳时每个孔道加10 μg蛋白样品,转膜,4 ℃孵育一抗MANF、NF-κB-p65、Actin、GAPDH、β-Tublin、Lamin-B、ATF6、N-cadherin、Vimentin(1 ∶1 000)过夜;二抗于室温孵育1 h,使用TBST洗3次,每次10 min,ECL化学发光曝光1-5 min,显影。
1.2.4实时荧光定量PCR 取对数生长期的细胞,铺6孔板中,待细胞铺满皿底面积一半时,TNF-α(10 μg·L-1)处理12 h,丹皮酚浓度处理24 h,获取细胞沉淀块,使用TRIzol进行裂解及RNA提取。使用反转录试剂盒进行反转录得到cDNA(100 μg·L-1)作为模板,加入IL-6(5 μmol·L-1)和TNF-α(5 μmol·L-1)引物,使用SYBR Green预混液扩增mRNA,扩增程序设置为35个循环(95 ℃ 15 s,60 ℃ 30 s),在荧光定量PCR仪中检测荧光信号。以未处理组为对照,通过2^-ddCt方法进行定量分析,获取不同处理方式中mRNA水平的表达情况。引物信息如下:IL-6,正向“5′-CCTTCGGTCCAGTTGCCTTCTC-3′”,反向“5′-AGAGGTGAGTGGCTGTCTGTGT-3′”;TNF-α:正向“5′-CCTCTCTCTAATCAGCCCTCTG-3′”,反向“5′-GAGGACCTGGGAGTAGATGAG-3′”。
1.2.5细胞迁移 使用记号笔在6孔板底部画水平横线,取对数生长期的细胞,铺6孔板中,待细胞铺满皿底面积一半时,TNF-α(10 μg·L-1)处理12 h,丹皮酚浓度处理48 h。使用枪头在6孔板中垂直画线以确定每次观察位置相同,PBS洗去漂浮细胞,更换新鲜培养基,于显微镜下拍照。将细胞放在培养箱中继续培养12 h,选取相同的位置再次拍照,通过ImageJ统计空白处面积所占比例,以比较不同处理方式中细胞的迁移效率。
1.2.6免疫荧光 细胞爬片经消毒灭菌后置于6孔板中,将处于对数生长期的RA-FLSs铺于细胞爬片,待细胞贴壁,TNF-α(10 μg·L-1)处理12 h,使用丹皮酚(50 μmol·L-1)处理24 h。移除培养基,PBS洗3次,使用4%多聚甲醛进行固定10 min,30 g·L-1的BSA封闭1 h后使用p65(1 ∶50)与MANF(1 ∶100)抗体进行免疫一抗标记,4 ℃孵育12 h;荧光二抗(1 ∶1 000)室温孵育1 h,DAPI室温孵育10 min,洗去残留二抗及DAPI后封片。使用激光共聚焦显微镜检测细胞中p65与MANF蛋白的表达量及表达位置。
1.2.7核蛋白分离 RA-FLSs经过TNF-α处理12 h后,加丹皮酚处理24 h。将收取的细胞团块用细胞质裂解液(10 mmol·L-1HEPES、1.5 mmol·L-1MgCl2、10 mmol·L-1的KCl、0.5 mmol·L-1的DTT、0.05%(V/V)的NP-40,pH 7.9)进行重悬,同时在其中加入蛋白酶体抑制剂及PMSF试剂,冰上裂解40分钟,收取上清即为胞质蛋白。将沉淀使用细胞核裂解液(5 mmol·L-1HEPES、1.5 mmol·L-1MgCl2、0.2 mmol·L-1EDTA、0.5 mmol·L-1DTT、26%(V/V)甘油,pH 7.9)进行重悬,冰上裂解30 min后离心,所得上清即为细胞核蛋白。通过Western blot检测MANF和p65的细胞质/核易位水平。
1.3 统计学处理采用GraphPad Prism 7.0统计学软件,并以均数±标准差(mean±SD)的形式呈现,两组间的值的比较以t检验,多组间均数差异性比较以单因素方差分析(One-way ANOVA)为主,两两比较采用SNK-q分析。
2 结果
2.1 丹皮酚抑制滑膜细胞的异常增殖检测RA-FLSs对丹皮酚的耐受程度,Fig 1 A所示,当丹皮酚浓度低于100 μmol·L-1时,不会影响FLSs的活性(t=2.856,P=0.4448)。使用TNF-α(10 μg·L-1)刺激FLSs细胞12 h,丹皮酚(1、10、50、100 μmol·L-1)处理细胞48 h,结果Fig 1 B所示,对处于炎症状态下的FLSs,丹皮酚达到50 μmol·L-1可对其异常增殖产生抑制作用(t=4.497,P=0.0394)。
2.2 丹皮酚抑制滑膜细胞的迁徙细胞迁移实验显示Fig 2 A,与TNF-α组相比,丹皮酚浓度为100 μmol·L-1对RA-FLS的迁徙产生抑制作用(t=8.998,P=0.001)。进一步研究了丹皮酚对细胞迁徙相关蛋白N-钙粘蛋白(N-cadherin)、波形蛋白(Vimentin)表达的影响。如Fig 2 B所示,与对照组相比,TNF-α组N-cadherin、Vimentin蛋白水平均升高;与TNF-α组相比,丹皮酚(100 μmol·L-1)处理48 h能够降低N-cadherin(t=22.9,P=0.001)、Vimentin(t=29.69,P=0.001)。

Fig 1 Paeonol can inhibit the abnormal proliferation of fibroblast synoviocytes induced by TNF-α

Fig 2 Paeonol can inhibit the expression of migration-related protein
2.3 丹皮酚通过ER应激增加MANF的表达使用Western blot方法检测丹皮酚对RA-FLSs中MANF蛋白表达变化。如Fig 3所示,FLSs经过TNF-α(10 μg·L-1)处理12 h,丹皮酚(1、10、100 μmol·L-1)处理24 h,与对照组相比,TNF-α组中细胞MANF表达增加(t=9.498,P<0.01);与TNF-α组相比,1 μmol·L-1丹皮酚处理后即可观察到MANF增加(t=19.45,P<0.01),MANF上游蛋白ATF6变化趋势与MANF基本保持一致。
2.4 免疫荧光观察丹皮酚促进MANF的核位移通过免疫荧光检测,对转录因子p65及MNAF蛋白的表达情况即细胞定位进行检测。结果如Fig 4 A、B显示,与对照组相比,TNF-α(10 μg·L-1)处理12 h后的FLSs尚不能观察到MANF的细胞质/核易位增加。与TNF-α组相比,使用丹皮酚(50 μmol·L-1)处理24 h后,MANF细胞质/核易位水平增加(t=21.16,P<0.01)。
2.5 核蛋白检测丹皮酚促进MANF的核位移为了对丹皮酚促进MANF细胞质/核易位的程度进行量化,通过对RA-FLSs细胞的核蛋白与胞质蛋白进行分离,分别检测其中的p65与MANF蛋白表达。如Fig 5显示,在细胞核中,MANF蛋白水平在丹皮酚(10 μmol·L-1)处理后升高(t=38.81,P<0.01);与之对应,转录因子p65在经过TNF-α(10 μg·L-1)诱导后入核明显,当使用丹皮酚(10 μmol·L-1)处理后,细胞核中p65水平降低(t=3.541,P<0.01)。同时可以观察到,在胞质蛋白中,p65蛋白变化水平与细胞核内变化趋势相反,当TNF-α刺激后,细胞质中p65水平降低,当使用丹皮酚处理后,细胞质中p65蛋白水平恢复。
2.6 丹皮酚抑制滑膜细胞的炎症反应通过RT-qPCR检测炎症因子mRNA,如Fig 6 A、B所示,与TNF-α(10 μg·L-1)组相比,丹皮酚(10 μmol·L-1)能够抑制炎症因子TNF-α、IL-6的mRNA异常转录(t=9.233,P<0.01;t=6.053,P<0.01)。通过在FLS细胞中稳定表达p65-promoter,研究丹皮酚对p65转录因子的活性抑制,结果如Fig 6 C所示,TNF-α刺激可增强p65的转录活性(t=38.81,P<0.01),而丹皮酚(1、10、50、100 μmol·L-1)可以剂量依赖性降低p65的转录活性,且当浓度为1 μmol·L-1即有统计学意义(t=44.09,P<0.01)。
3 讨论
天然产物丹皮酚具有良好的抗炎效果,在传统中药中已被广泛使用,其安全性有足够的保证[8]。在研究RA的过程中,以FLSs当作研究模型,FLSs在RA的疾病发展中起到重要作用[10]。本研究首先对丹皮酚安全性进行验证,当丹皮酚浓度达到100 μmol·L-1时,不会对FLSs活性产生明显的抑制作用。RA表现为RA-FLSs细胞的异常增殖及侵袭,药物通过抑制RA-FLSs细胞异常增殖产生对RA的抑制作用[10]。钙黏附蛋白N-cadherin和波形蛋白Vimentin在细胞侵袭和迁移过程中发挥重要作用[11-12]。研究中,丹皮酚对RA-FLSs的异常增殖及N-cadherin和Vimentin蛋白水平均产生抑制(Fig 2B)。
RA形成的原因复杂,多种细胞参与其中,如B细胞、T细胞、单核巨噬细胞、FLS细胞等[13]。而MANF是一种分泌蛋白,其表达和分泌量的增加有助于在不同种类细胞间产生其保护作用[14]。如MANF可以促进免疫细胞表型从促炎性巨噬细胞转变为修复性抗炎性巨噬细胞[12]。MANF启动子ERSE-Ⅱ受ATF6所调控,其分泌与内质网应激水平密切相关[15-16]。MANF上游ER应激相关蛋白ATF6表达在丹皮酚作用下维持在较高水平(Fig 3)。当RA-FLSs细胞中MANF表达量增高,又可以进一步对周围其他参与RA进展的炎症细胞产生抑制作用,与药物形成协同,预期可以产生更好的炎症抑制效果。与直接使用MANF纯化蛋白进行相比,丹皮酚使用成本更低。

Fig 3 Paeonol promoted MANF expression

Fig 4 Paeonol increased level of protein MANF in nucleus
中脑星形胶质细胞源性神经营养因子(MANF)首次发现是作为一种星形胶质细胞条件培养基中的一种新的多巴胺能神经营养因子[17]。最近的研究表明,MANF可以在SUMO的介导下,由细胞质转移到细胞核中,通过与转录因子p65结合并抑制其转录活性而产生炎症抑制作用[10]。通过免疫荧光及核、浆蛋白分离实验,证明丹皮酚能够促进MANF细胞质/核易位(Fig 4、5)。在抑制p65转录活性这条通路上,增加MANF细胞质/核易位水平,将大大提高其炎症抑制能力。转录因子p65在活性状态下能够激活包括IL-6、IL-1β、TNF-α等多种炎症因子的表达[18]。通过克隆p65启动子,将其外源表达在RA-FLSs细胞中。结果显示p65的转录活性剂量依赖性的受到丹皮酚影响(Fig 6)。总之,丹皮酚能够有效的增加MANF蛋白的表达,并且促进MANF蛋白的核转移,从而抑制转录因子p65的活性,发挥其抑制炎症的功能。
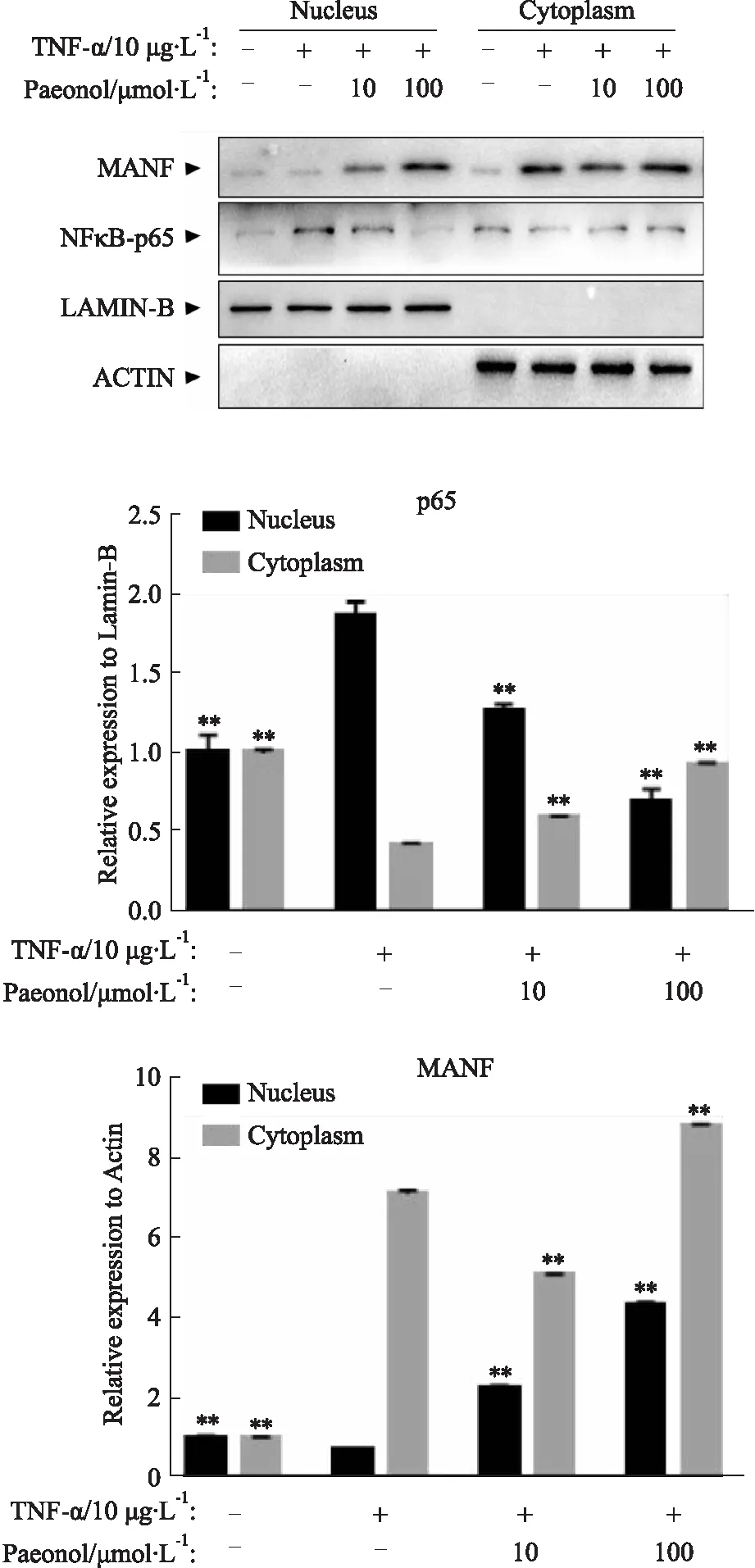
Fig 5 Paeonol inhibits RA-FLSs inflammatory progression by promoting nuclear transfer of MANF

Fig 6 Paeonol can produce an inflammatory effect by inhibiting the transcriptional activity of p65
