2018—2019年山东地区猪繁殖与呼吸综合征病毒分子流行病学调查
2021-07-06梁俊超王宗升刘红祥郝尧光王辉之
梁俊超 , 李 坤 , 袁 飞 , 王宗升 , 刘红祥 , 郝尧光 , 王辉之 , 刘 东 , 于 录
(1.吉林大学动物医学学院 人兽共患病研究所 人兽共患病研究教育部重点实验室 , 吉林 长春 130062 ; 2.青岛易邦生物工程有限公司 动物基因工程疫苗国家重点实验室 , 山东 青岛 266000)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是一种高度接触性传染病,猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)是PRRS病原,该病毒是一种有囊膜的单股正链RNA病毒,基因组大小15 kb左右,包含9个开放阅读框。GP5蛋白由ORF5基因编码,含有PRRSV主要的中和抗原表位,在诱导中和抗体及免疫交叉保护方面具有重要作用[1]。据ORF5基因序列分析[2],我国PRRSV流行毒株主要为基因Ⅱ型,且主要为谱系1、谱系3、谱系5和谱系8。
本试验通过收集2018—2019年山东地区PRRSV临床可疑样品,对阳性样品中PRRSV毒株进行ORF5基因测序分析,了解近年山东地区PRRSV的流行趋势,旨为今后PRRSV的防控提供理论依据和参考。
1 材料与方法
1.1 病料收集处理 2018—2019年从山东多个地区(如青岛、潍坊、德州、聊城等)采集493份疑似PRRSV感染的猪脾脏、肺脏等病料,病料经研磨处理后,按照文献[3]介绍的RT-PCR方法进行抗原检测。检测ORF5基因所用的引物:上游:5′-CATTTCATGACACCTGAGACCA-3′;下游:5′-AGAGCATATATCATCACTGGCG-3′。RT-PCR扩增条件:94 ℃预变性2 min;94 ℃变性15 s,54 ℃退火30 s,68 ℃延伸1 min,32个循环;68 ℃延伸10 min。
1.2 主要试剂 RNA提取试剂盒,购自TaKaRa公司;高保真反转录试剂盒,购自罗氏公司;LA-Taq DNA聚合酶,购自宝生物工程(大连)有限公司。
1.3 PRRSVORF5基因测序 将PRRSV RT-PCR阳性产物序列送至生工生物工程(上海)股份有限公司进行测序。
1.4 核苷酸进化分析 通过软件DNASTAR Lasergene对送检测序PRRSVORF5基因进行序列同源性比对分析,利用MEGA 6.0软件对所测PRRSVORF5基因序列进行遗传进化分析。
1.5 氨基酸进化分析 通过软件DNASTAR Lasergene对送检测序PRRSV GP5蛋白氨基酸位点进行分析,并基于ORF5基因序列,通过NetNGlyc l.0 Sever在线软件(http://www.cbs.dtu.dk/services/NetNGlyc/)预测并分析相应氨基酸序列的糖基化位点。
2 结果
2.1 RT-PCR检测 将2018—2019年山东省多个地区送检疑似PRRSV病料共493份进行RT-PCR检测,目的条带大小为603 bp,检测结果若出现目的条带,表明病料中PRRSV抗原检测结果为阳性。部分RT-PCR检测结果见图1。送检病料RT-PCR检测结果见表1。从表1可知,2018年和2019年送检病料中,PRRSV阳性率分别为20.79%和24.09%,其中保育仔猪病料PRRSV阳性率均为最高,分别为37.93%和29.89%。

图1 ORF 5基因的PCR扩增Fig.1 Amplification of ORF 5 gene by PCRM:DL2 000 DNA相对分子质量标准; 1~12:送检样本ORF5基因片段; 13:阴性对照; 14:阳性对照;15~18:送检样本ORF5基因片段M:DL2 000 DNA marker; 1-12:ORF5 gene fragment of samples; 13:Negative control; 14:Positive control; 15-18:ORF5 gene fragment of samples

表1 2018—2019年不同送检病料PRRSV阳性率Table 1 Positive rate of PRRSV in different samples from 2018 to 2019 (%)
2.2 PRRSVORF5基因同源性比对分析 从PRRSV阳性样品中挑选34份PRRSV的PCR产物送检进行ORF5基因测序,经比对后确认得到34个603 bp的样品PRRSVORF5基因序列。样品PRRSVORF5基因序列按照“送检年月-样品编号-送检市区缩写”进行编号。34个样品PRRSVORF5基因序列与相应谱系标准毒株序列通过DNASTAR软件进行比对,结果见表2和图2。从图2可知,34个样品PRRSVORF5基因序列之间同源性为81.3%~100%,与基因Ⅱ型PRRSV同源性高于基因Ⅰ型PRRSV,与基因Ⅱ型PRRSV的4个谱系代表毒株同源性为81.7%~99.3%。

表2 34个PRRSV ORF 5基因序列与标准毒株同源性对比Table 2 The homology of 34 PRRSV ORF 5 gene sequences compared with the standard strains (%)

图2 34个PRRSV ORF 5基因核苷酸同源性分析Fig.2 Nucleotide homology analysis of 34 PRRSV ORF 5 gene
2.3 PRRSVORF5基因遗传进化分析 34个样品PRRSV的ORF5基因序列通过MEG 6.0软件绘制遗传进化树,见图3。从图3和表3中可知,2018—2019年山东地区34个样品PRRSV主要分布在谱系1和谱系8,占比分别为55.88%和41.18%。从表3中可知,2018年谱系1和谱系8中样品PRRSV分别占比为50.00%和41.67%;2019年谱系1和谱系8中样品PRRSV分别占比为59.10%和40.90%。

图3 34个PRRSV ORF 5基因序列进化树分析Fig.3 Evolutionary tree analysis of 34 PRRSV ORF 5 gene sequences•:谱系1、3、5和谱系8的PRRSV标准毒株•:PRRSV standard strain of lineage 1,3,5 and lineage 8

表3 2018—2019年34个PRRSV在不同谱系占比Table 3 The proportion of 34 PRRSV in different lineages from 2018 to 2019
2.4 PRRSV GP5蛋白氨基酸位点变异分析 通过DNASTAR软件将34个样品PRRSV GP5蛋白氨基酸序列与标准毒株进行比对,结果见图4。从图4可知,34个样品PRRSV GP5蛋白氨基酸以点突变为主,未见插入突变,3个样品PRRSV在36aa处存在缺失突变。信号肽区域aa1-25、aa24-39及aa57-61三个区域氨基酸点突变集中程度较高。

图4 34个PRRSV GP5蛋白氨基酸同源性分析Fig.4 Amino acid homology analysis of 34 PRRSV GP5 proteins3个方框: 3个PRRSV在36aa处存在缺失突变3 boxes: Deletion mutation of 3 PRRSV was found at 36aa
aa27-30(V27LVN30)是非中和抗原表位,又称诱饵表位,aa37-45(S37HLQLIYNL45)是中和抗原表位(Protein neutralization epitope,PNE),其中识别位点被认为是H38和 I42YN44,而结合位点被认为是L39QL41[4-7]。从图4可知,在诱饵表位区域,不同谱系样品PRRSV氨基酸位点突变分别为V27→A27、L28→F28、L28→P28、N30→S30和N30→D30。在中和表位区域,不同谱系样品PRRSV氨基酸位点突变分别为H38→N38、H38→Y38、L39→S39、L39→T39、L39→I39和N44→S44。据相关研究报道,R13和R151是PRRSV潜在的毒力位点,与病毒毒力密切相关[8-9]。从图4可知,不同谱系样品PRRSV的R13和R151位点发生突变,分别为R13→H13、R13→Q13、R151→K151和R151→T151。
从表4可知,2018—2019年34个样品PRRSV的潜在毒力位点突变率最高,为82.35%。2018—2019年不同谱系的样品PRRSV潜在毒力位点、中和表位位点和诱饵表位位点均发生不同程度突变。

表4 2018—2019年34个PRRSV GP5蛋白氨基酸位点变异分析Table 4 Amino acid variation analysis of 34 PRRSV GP5 proteins from 2018 to 2019
2.5 PRRSV GP5蛋白潜在N-糖基化位点变异分析 通过NetNGlyc l.0 Sever在线软件,对34个样品PRRSV GP5蛋白氨基酸序列的N-糖基化位点进行预测分析,结果见表5。从表5可知,与NADC 30相比,谱系1中2018年和2019年PRRSV糖基化位点增加1个的样品占比分别为50.00%(3/6)和53.85%(7/13),2019年糖基化位点增加2个的样品占比为23.08%(3/13);与JXA1相比,谱系8中2018年和2019年PRRSV糖基化位点减少1个的样品占比分别为40.00%(2/5)和44.44%(4/9)。
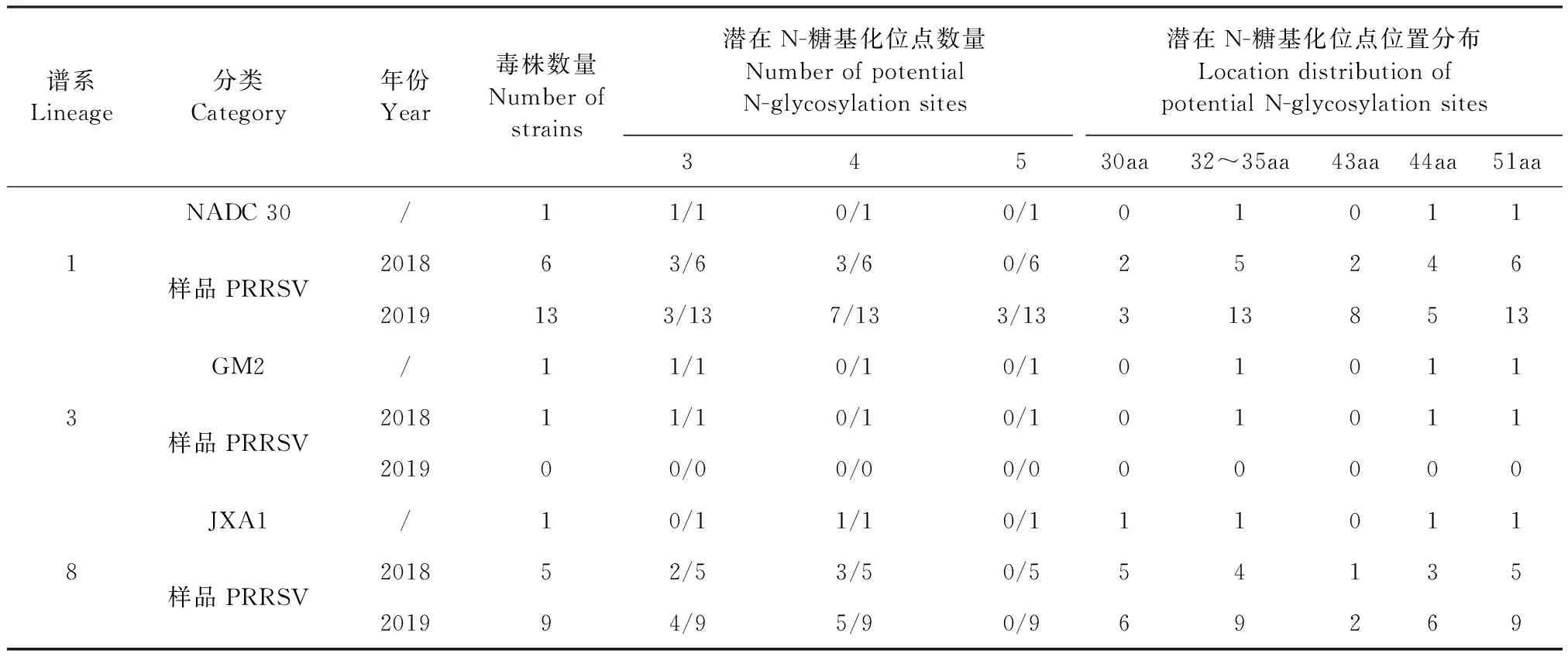
表5 2018—2019年34个PRRSV的GP5蛋白潜在N-糖基化位点数量及位置分布Table 5 Number and location of potential N-glycosylation sites of 34 PRRSV GP5 proteins from 2018 to 2019
3 讨论
目前我国PRRSV感染仍十分普遍,且已成为猪场的常在疾病[10]。从RT-PCR检测结果可知,2018年和2019年全年PRRSV抗原阳性率较往年报道相比有所下降[11],但感染率仍较高,其中保育仔猪病料PRRSV阳性率最高,与姚亚辉统计结果相符[12]。
2018—2019年山东地区共测序34个PRRSV样品,经ORF5基因同源性比对分析发现,34个PRRSV样品与经典疫苗毒株VR2332、MLV及欧洲株LV同源性相对较低,与谱系8中HP PRRSV JXA1、HuN4、TJ及谱系1中的NADC 30 PRRSV的同源性相对较高。据报道,PRRSV同源性高低影响PRRS疫苗毒株的田间保护效果[13]。从遗传进化分析结果可知,谱系1中样品PRRSV即NADC30 like PRRSV或已成为山东地区田间流行优势野毒毒株,这与刘艳艳报道结果相符[11]。
据报道,PRRSV的诱饵表位与中和表位在中和抗体产生的过程中发挥关键作用,尤其在感染早期,可抑制免疫系统识别中和表位,导致中和抗体产生延迟[14]。此外,PRRSV重要抗原表位氨基酸位点发生突变,将影响抗原抗体结合,有利于病毒免疫逃避,导致PRRSV疫苗株的免疫效果不佳甚至免疫失败[15-17]。从氨基酸位点变异分析结果可知,2019年与2018年相比,谱系1中样品PRRSV诱饵表位及中和表位氨基酸位点突变率呈上升趋势,潜在毒力位点突变率高,由此推测PRRSV重要抗原位点突变可能更有利于病毒的免疫逃避,而谱系8中样品PRRSV诱饵表位及中和表位氨基酸位点突变率呈下降趋势,潜在毒力位点突变率呈上升趋势,由此推测可能由于疫情、存栏影响导致该PRRSV逃避机体免疫的压力下降,使其突变率下降,但其重要抗原位点仍在不断变异,增加防控难度。
研究发现,中和表位附近N-糖基化位点具有屏蔽作用,且该位点缺失能增强免疫原性、敏感性及中和抗体的中和能力,不利PRRSV的免疫逃避[4,8,14],此外,PRRSV的N-糖基化位点数目、位置的变化影响抗体对病毒的中和能力及病毒对宿主细胞的侵染力[18]。从GP5蛋白潜在糖基化位点变异分析结果可知,2019年与2018年相比,谱系1中样品PRRSV相比NADC 30 PRRSV的糖基化位点数量增加的比例明显升高,由此推测这可能更利于PRRSV逃避机体的免疫,增加PRRSV的防控难度;谱系8中样品PRRSV相比JXA1的糖基化位点数量减少的比例略有升高,由此推测这可能更有利于机体免疫识别,PRRSV免疫防控更需重视。
4 结论
山东地区现阶段PRRSV呈现多样化、复杂化,其中NADC 30 like PRRSV或已成为田间流行的优势野毒毒株,这或将导致PRRSV疫苗保护效果下降。结合临床生产,PRRS防控不能单纯依赖疫苗,更需提高猪场生物安全水平和饲养管理水平,猪群健康对PRRS防控至关重要。综上所述,PRRSV防控需综合防控。
