颞下颌关节退行性变早期髁突软骨细胞行为改变的实验研究
2021-07-05方苓力谭玺叶雨丝黄兰何瑶
方苓力 谭玺 叶雨丝 黄兰 何瑶
重庆医科大学附属口腔医院 口腔疾病与生物医学重庆市重点实验室重庆市高校市级口腔生物医学工程重点实验室 重庆401147
颞下颌关节骨关节炎(temporomandibular joint osteoarthritis,TMJOA)是一种低炎症性病变[1-2],以关节软骨进行性破坏为主要特征,同时伴有关节盘,滑膜及软骨下骨的改变[3-4]。
髁突软骨退行性变则是TMJOA的典型表现,其细胞生物学行为的研究是TMJOA相关研究的重要组成部分。正常情况下髁突软骨包含4个不同成熟阶段的软骨细胞,从表层向下依次分为纤维软骨细胞层,多形态细胞层/增殖细胞层,前肥大软骨细胞层/扁平细胞层,以及最下层的肥大软骨细胞层[5-7]。作为咀嚼系统的重要组成部分,关节区一定程度的负荷,对维持关节结构和功能的稳态有重要意义[8]。口颌系统的平衡失调,如宿主关节表面适应能力的降低和/或功能性负荷超限,将导致关节区超负荷受载,引起关节软骨渐进性破坏,促使骨关节炎发生[8-9]。因此,明确超负荷应力下的颞下颌关节(temporomandibular joint,TMJ)的反应性改变及TMJOA进展的内在机制,将为后续干预和逆转TMJOA 病变的发生发展提供重要依据。
目前,建立超负荷应力诱导TMJOA的方式主要是通过增大关节表面的力学加载,打破关节软骨的改建平衡,从而引起软骨的退行性改变和软骨下骨的破坏[10]。强制性张口模型是应用比较成熟的超负荷应力诱导的TMJOA模型。此模型也是为数不多能够应用于诱导小鼠关节病变的模型,Sobue等[11]发现1 h·d-1,0.5 N的强制张口应力,连续作用5 d后小鼠出现了适应性软骨细胞增殖,细胞层增厚,基质表达增加的现象[11-12]。Tanaka等[13]使大鼠处于最大开口位1 h·d-1,连续加载20 d出现了软骨退变晚期的表现,如软骨层变薄,表层结构破坏,细胞凋亡增加,排列紊乱,基质降解,并伴随局部细胞巢状增生[13-14]。此外,结合其他增加应力负荷的造模方式诱导的髁突软骨退变表现,基本确定了退变初期的适应性增殖阶段和晚期以凋亡破坏为主的病损确立阶段[15-17]。而对于这2个阶段是如何转变及相关表现,尚缺乏研究探讨。因此,本研究应用Sobue等[11]的小鼠建模方法,延长应力作用时间,旨在探索适应性增殖阶段之后髁突软骨退变早期的软骨细胞生物学行为表现。
除了增殖、凋亡及基质分泌改变这些基本的生物学行为变化以外,近年来研究表明自噬也在骨关节炎进展中发挥重要作用[18]。通过咬合紊乱建立的诱导TMJ退变的模型中发现,在TMJOA病变初期,自噬活性增强,能够通过去除过量的细胞成分来抑制细胞接触并阻断细胞凋亡的诱导,从而减少软骨细胞凋亡和细胞基质的降解。而在病变晚期,与凋亡相关的蛋白基因激活,自噬活性受到抑制,关节退变加重[19-21]。磷脂酰肌醇3-激酶/丝氨酸/苏氨酸蛋白激酶(phosphatidylinositol 3-kinase/protein kinase B,PI3K/Akt)通路是被证实在TMJOA的发生过程中起到重要保护作用的一条信号通路,不仅可以通过PI3K的磷酸化实现磷脂酰肌醇3磷酸的转化,最终使Akt磷酸化而活化,进而参与调控软骨细胞生长及功能[22];还可以通过调控下游因子mTOR的活性影响细胞自噬的表达[23]。在手术、氧化应激或基质分解酶诱导的TMJOA发生过程中,该通路被抑制,导致软骨细胞凋亡增加,软骨基质合成相关蛋白分泌降低,基质分解酶类表达增高,从而促进了关节软骨的进行性破坏[24-25]。
因此,本研究通过给小鼠加载适宜的应力,探究在适应性增殖阶段之后的髁突软骨退变早期,软骨细胞在增殖、凋亡、自噬方面行为的改变以及PI3K/Akt信号通路的表达变化,以期加深对于TMJ退行性变进展的认识,进而为早期干预治疗TMJOA提供相应参考靶点。
1 材料和方法
1.1 动物模型构建
8周龄C57BL/6野生型雄鼠,购自重庆医科大学动物实验中心,随机分成2组,每组5只。实验通过重庆医科大学附属口腔医院伦理委员会审查[批号:2020年伦审(004)号]。根据Sobue等[11]描述的强制张口模型建模,诱导麻醉后固定。实验组清醒时放置开口器,产生0.5 N强制张口力压迫TMJ,1 h·d-1(图1A)。对照组仅固定,10 d后取样。处死前1天腹腔注射5-乙炔基-2’脱氧尿嘧啶核苷(5-ethynyl-2'-deoxyuridine,EdU)试剂A(广州锐博生物科技有限公司)50 mg·kg-1,0.1 mL·g-1体质量(图1B)。
1.2 样本收集
过量水合氯醛处死小鼠,正中矢状面剖开头部。右侧分离出完整下颌骨,拟行激光共聚焦扫描及EdU染色。左侧头部固定后脱钙、脱水、修剪后冠状向包埋标本,制成5 μm厚度石蜡切片行后续染色。
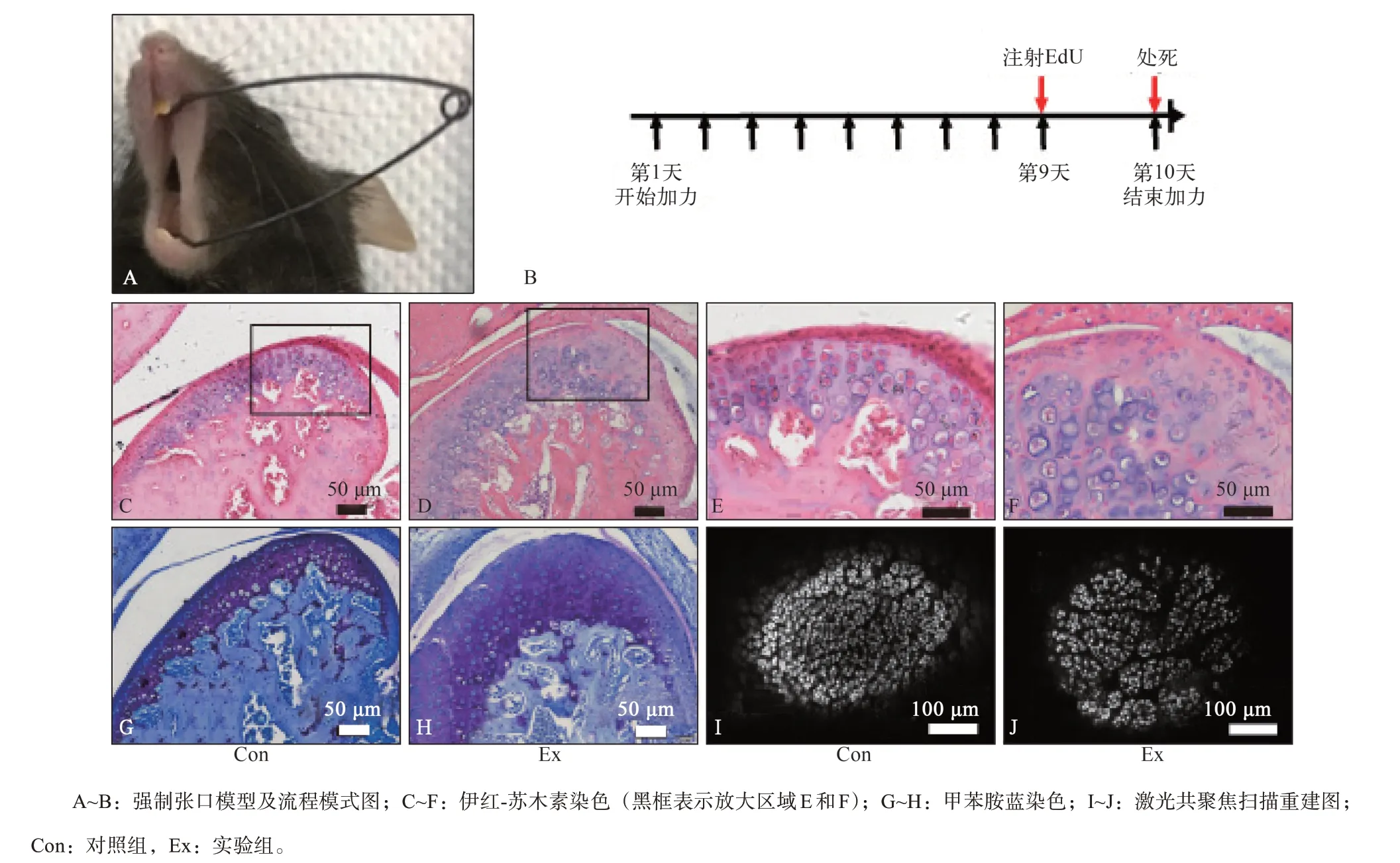
图 1 应力刺激下TMJ软骨的组织形态学表现Fig 1 Histomorphology of TMJ cartilage stimulated by stress
1.3 石蜡切片染色
常规进行苏木精伊红(hematoxylin and eosin,HE)和甲苯胺蓝染色。切片于室温脱蜡、水化,抗原修复15 min,3%过氧化氢孵育10 min,山羊血清封闭20 min,滴加体积分数为1∶100的一抗增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、体积分数为1∶100的半胱氨酸天冬氨酸蛋白酶(cysteine-requiring aspartate protease3,caspase3)、体积分数为1∶200的自噬基因Beclin1、体积分数为1∶100的磷酸化丝氨酸/苏氨酸激酶(phosphorylated Akt,p-Akt)(成都正能生物技术有限责任公司),体积分数为1∶100的Ⅱ型胶原(collagen Ⅱ,Col Ⅱ)、体积分数为1∶100的基质金 属 蛋 白 酶 13 (matrix metalloproteinase 13,MMP13)(北京博奥森生物技术有限公司),体积分数为1∶100的蛋白聚糖(aggrecan,Acan)(武汉三鹰生物技术有限公司),体积分数为1∶100的微管相关蛋白1轻链3(light chain 3,LC3)、体积分数为1∶50的磷酸化雷帕霉素靶蛋白(phosphorylated mammalian target of rapamyoin, p-mTOR)(Abcam Plc公司,美国),4 ℃孵育过夜;山羊抗鼠二抗(北京中杉金桥生物技术有限公司)孵育30 min,二氨基联苯胺(diaminobenzidine,DAB)(北京中杉金桥生物技术有限公司)显色,苏木素(北京百灵威科技有限公司)复染,脱水,透明,封片。
光学显微镜(中国奥林巴斯有限公司)下观察,采用Image-ProPlus6.0图像分析系统(Media Cybernetics图像技术公司,美国),每张切片截取关节软骨内、中、外侧3个部位12×8 cm2面积大小进行积分光密度(integralopticaldensity,IOD)统计。
1.4 髁突软骨激光共聚焦扫描及重建
下颌骨固定后加入10 μg·mL-1的4,6-二氨基-2-苯基吲哚(重庆蒙博生物科技有限公司)500 μL避光孵育24 h,扫描软骨中段,设置同课题组前期研究[26],扫描通道405 nm,扫描深度60 μm,层距2 μm。Leica Application Suite X软件三维重建,观察髁突软骨内细胞分布。
1.5 关节软骨冰冻切片EdU染色
右侧下颌骨脱钙,蔗糖梯度脱水后包埋,8 μm切片。根据EdU试剂盒(C10301,广州锐博生物科技有限公司)染色,固定后滴加2 mg·mL-1的甘氨酸(重庆蒙博生物科技有限公司)1 mL作用10 min,1 mL 0.5%曲拉通(Sigma公司,美国)穿透10 min,Apollo染色反应液孵育30 min,0.5%曲拉通洗3次,10 μg·mL-14,6-二氨基-2-苯基吲哚1 mL复染,激光共聚焦显微镜405 nm和643 nm通道扫描。以7×10 cm2统计阳性细胞数。
2 结果
2.1 TMJ软骨的组织形态学改变
HE染色结果显示:实验组软骨结构完整,细胞层增厚,软骨细胞排列紊乱,总细胞数目减少,内侧细胞减少更明显,但并未出现典型的巢状增生表现(图1C~F)。甲苯胺蓝染色提示:实验组较对照组软骨基质减少(图1G~H)。共聚焦扫描重建显示:实验组细胞排列紊乱,密度降低,局部区域细胞减少明显(图1I~J)。结合适应性增殖阶段和退变后期软骨的表现,认为该期处于软骨退变早期即适应性增殖后的过渡阶段。
2.2 颞下颌关节软骨细胞的基质蛋白表达
Acan和Col Ⅱ是鉴定软骨基质蛋白的主要标记物,实验组Acan明显较对照组减少,其IOD值也降低(图2A~C)。Col Ⅱ在增殖层和前肥大软骨细胞层中表达较对照组有所增加,在肥大软骨细胞层中Col Ⅱ的表达则较对照组减少,但总的IOD测量值实验组比对照组低(图2D~F)。MMP13是主要的基质金属蛋白降解酶,实验组的表达明显增加(图2G~I)。结合以上变化,说明实验组经应力诱导后软骨基质出现降解。
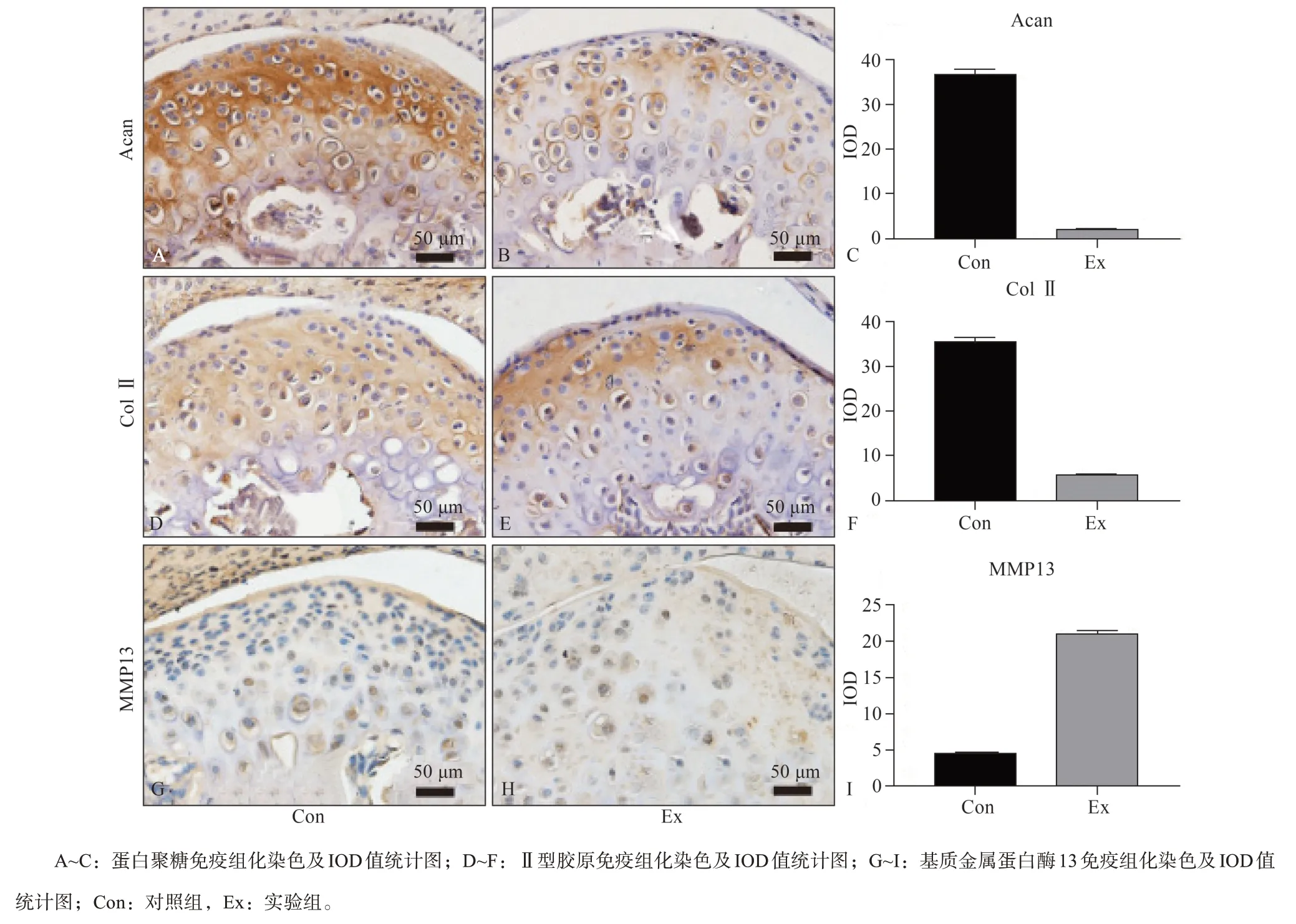
图 2 TMJ软骨的基质表达变化Fig 2 Expression of TMJ cartilage matrix
2.3 颞下颌关节软骨细胞的增殖和凋亡
活体增殖细胞标记结合EdU染色能较准确的反应细胞增殖状态[26],阳性细胞核呈红色,实验组多于对照组(图3A~C)。PCNA也是增殖细胞的常用标记蛋白,实验组阳性细胞的百分率多于对照组,且实验组中可见个别肥大软骨细胞细胞核呈阳性表现,IOD值也大于对照组(图3D~F)。细胞凋亡的主要蛋白酶caspase 3在实验组中阳性表达增加,IOD值也较对照组大(图3G~I)。因此,应力作用下软骨细胞增殖和凋亡活性都较对照组增强。
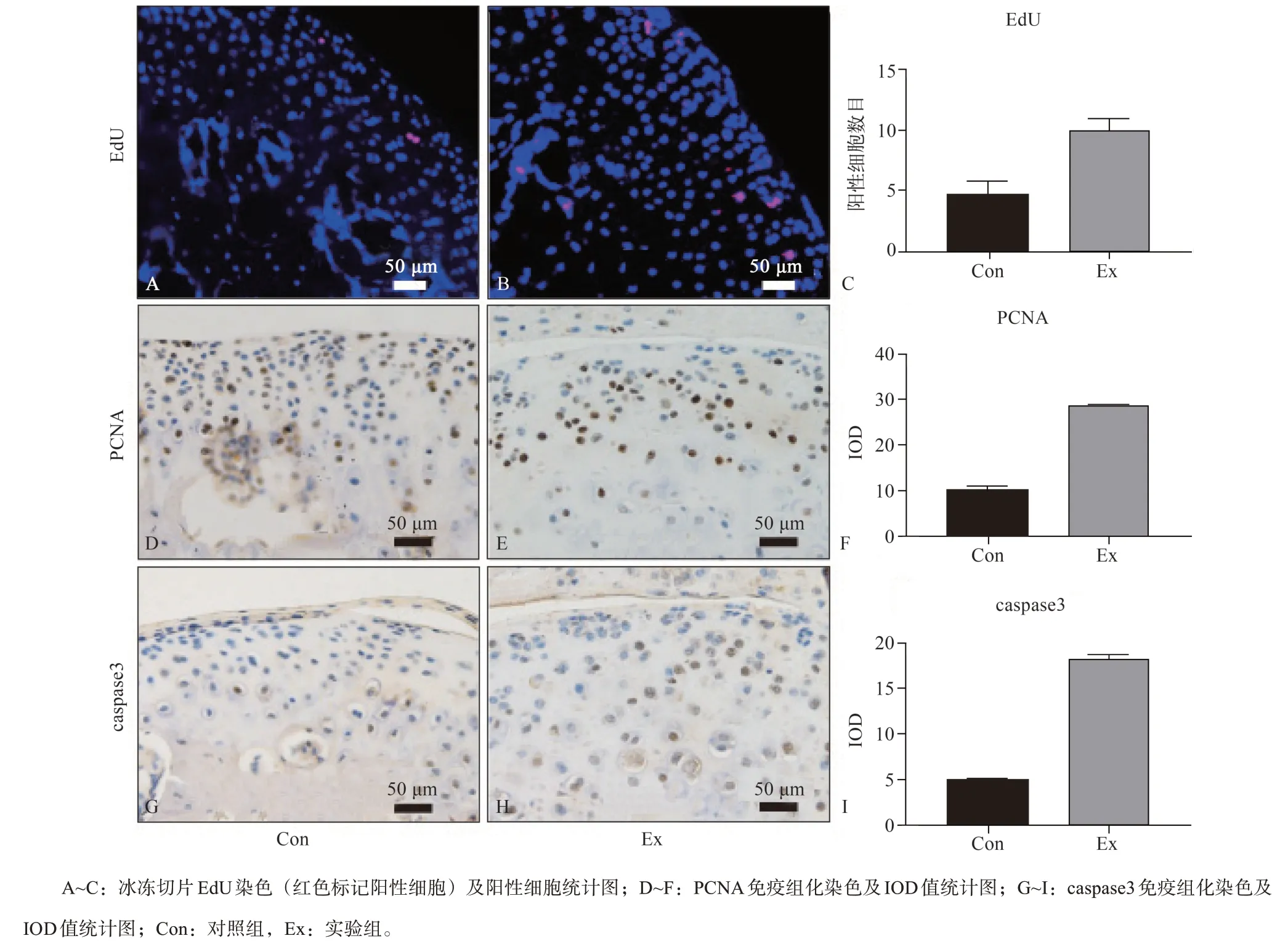
图 3 TMJ软骨细胞在应力作用下的增殖与凋亡表现Fig 3 Proliferation and apoptosis of TMJ cartilage under stress stimulation
2.4 TMJ软骨细胞自噬水平
作为自噬的重要标志性蛋白,Beclin1和LC3是自噬体形成的标志,代表其活化的强度。实验组Beclin1和LC3表达较对照组升高,相应的IOD值也增大(图4),说明在应力作用后的髁突软骨自噬表达增强。
2.5 TMJ软骨中PI3K/Akt通路的变化
在对PI3K/Akt通路关键激活因子检测中发现,实验组p-Akt的表达较对照组明显升高,其IOD测量值也增大(图5A~C)。mTOR作为PI3K/Akt通路的下游关键因子,实验组表达高于对照组(图5D~F)。由此推测应力诱导的髁突软骨退变过程中,伴随PI3K/Akt信号通路的激活。
3 讨论
过大的机械应力是TMJOA发生的重要病因。目前,应力导致TMJOA的模型主要有咬合紊乱模型、强制张口模型、根据饮食硬度改变咀嚼负荷模型等。相较而言,强制张口模型操作可人为量化,一致性好。
Sobue等[11]连续5 d加力1 h·d-1后,小鼠关节出现软骨层增厚,细胞增殖增加等初期表现。而学者们[13-14]加大应力后,大鼠髁突软骨出现典型的确立期表现。目前尚未发现有对TMJ在病变初期到病变确立期这个过渡期关节软骨退变行为表现进行探索的实验。因此,参考Sobue等[11]的实验结果,加力10 d观察到小鼠髁突软骨在细胞层增厚的基础上,出现细胞排列紊乱,数目减少,基质降解的情况,但并没有典型的巢状增生表现,软骨结构保持完整。Utreja等[12]采用与Sobue等[11]一样的加力方式和时间,利用转基因小鼠标记各层软骨细胞,发现应力加载后软骨各层厚度均增加,伴随EdU标记细胞的增加。Utreja等[12]认为在应力作用下细胞软骨层厚度的增加不仅是软骨细胞增殖增加的结果,也可能是髁突软骨中前肥大软骨细胞分化水平增加,从而促进了软骨细胞层增厚。本实验结果显示软骨细胞层厚度增加,但软骨细胞数目减少。结合本研究实验组较对照组EdU和PCNA表达增加的结果,笔者猜测一方面可能是由于软骨细胞在加力前期阶段出现了适应性细胞增殖,软骨层呈增厚的状态,但由于应力持续作用,软骨破坏发生,导致软骨上层及表层细胞数目首先减少,而肥大软骨层的细胞数目还尚未表现出明显减少[27],故而软骨细胞层厚度仍保持较厚状态。此外,MMP13作为软骨细胞分化的重要标志物,在本实验中部分前肥大软骨细胞呈阳性表达,因此另一方面也不排除在应力加载后前肥大软骨细胞向肥大软骨细胞分化加剧,进而引起软骨细胞层增厚的可能。
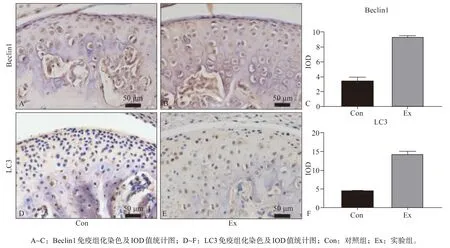
图 4 应力作用下髁突软骨细胞中自噬的表达Fig 4 Expression of autophagy in condylar chondrocytes under stress stimulation
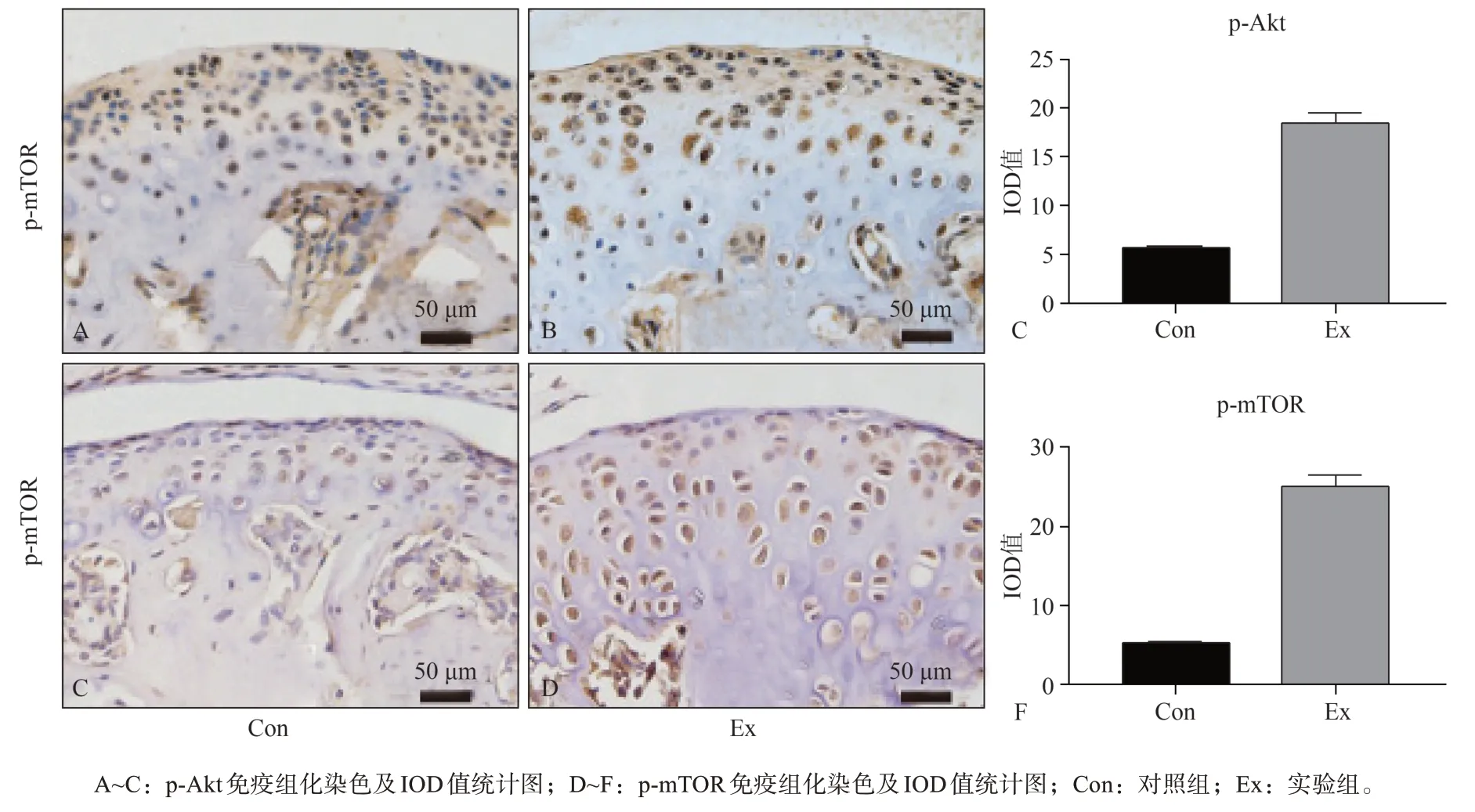
图 5 p-Akt及p-mTOR在应力诱导的TMJ软骨中的表达Fig 5 Expression of p-Akt and p-mTOR in stress-induced TMJ cartilage
近年来,有学者[12,28-29]认为部分分化后的肥大软骨细胞仍保持增殖能力。Kurio等[5]在幼鼠和3个月大的小鼠中用EdU进行增殖细胞示踪,显示EdU标记的软骨前体细胞可向软骨细胞和肥大软骨细胞进行分化和迁移,且分化后的肥大软骨细胞EdU仍呈阳性表达。本研究的结果也显示实验组中PCNA在部分肥大软骨细胞核中呈阳性表达,说明此部分肥大软骨细胞在分化后仍具有增殖潜力。
在OA发生的过程中,自噬水平也会发生相应变化。Zhang等[21]发现,咬合紊乱导致的应力作用初期软骨细胞排列不规则,软骨层出现无细胞区域,LC3、Beclin1以及溶酶体的表达水平升高,电镜下观察到自噬小体的形成,表明自噬活性增强。此外,Yang等[19]也证实了在TMJ早期病变时,细胞自噬和凋亡都被激活,而晚期自噬体与溶酶体的融合过程受阻,自噬活性受到抑制,TMJ病变进一步加重。结合本实验结果,笔者发现在应力诱导的TMJ退变早期,软骨细胞为了对抗应力刺激进行了代偿从而引起自噬的活化。
PI3K/Akt通路参与调控软骨细胞生长发育及生物学行为表现已被众多实验证实[30]。研究[31-32]表明,PI3K/Akt通路促进软骨细胞存活和基质合成。Zhang等[33]发现,一定的压力刺激促进软骨细胞增殖,伴随PI3K/Akt通路激活。此外该通路还影响自噬表达。Xiao等[34]通过抑制PI3K/Akt和mTOR的活性增强了对软骨细胞的保护作用。对于本实验PI3K/Akt和mTOR活性增强,自噬表达增加的结果,提示自噬活性调控可能不仅是PI3K/Akt单独作用的结果。有学者[35]发现,Beclin 1蛋白可以通过与其他因子相互作用来调节细胞自噬水平。Arai等[36]在Beclin 1基因敲除鼠中发现,软骨细胞分化功能受损,软骨基质表达减少。此外,Yang等[37]发现,激活p53可以抑制软骨细胞的自噬表达,促进软骨细胞凋亡。因此,对于应力诱导下髁突软骨自噬的具体调控机制还需要更深入的实验研究。Shanware等[38]将PI3K信号级联、中间代谢和自噬合称为新陈代谢的超级信号网络,其中一个部分障碍会有其他部分的补偿响应。在本实验中应力诱导TMJ退变早期软骨细胞的一系列反应可能也与此有关,具体的调控机制尚需进一步研究明确。
目前,临床上关节疾病的分期主要依据临床体征和影像学检测结果。但相较之下病理学指标更加敏感,能在关节软骨退变早期即体现出细胞和分子表达的改变。而当病理学上软骨退变后期出现比如关节软骨裂隙和吸收等严重表现时,影像检查才可见部分现象,此时依据影像学表现的临床分期,事实上已经错过了关节软骨退变的早期阶段,并不利于TMJ治疗的早期干预和治疗。而依据临床体征进行的分期,由于个体差异较大,和病理学表现建立联系相对更困难。因此如何将关节病变的病理学表现与临床检测相结合,还需要进一步研究探索。一方面,可以通过更精细的影像技术与关节软骨退变的病理改变相关联[39-40]。另一方面,也可以考虑采集体液样本检测关键指标来建立与关节软骨退变病理学表现的联系[41]。
综上所述,退变早期髁突软骨可能仍处于细胞增殖与凋亡的抗衡状态,表现为软骨细胞增殖、凋亡及自噬生物学行为均有一定程度的激活,并伴随PI3K/Akt通路表达活化。
利益冲突声明:作者声明本文无利益冲突。
