黑龙港苜蓿根际土壤真菌群落结构及多样性分析
2021-07-01刘震徐玉鹏王秀领黄素芳赵忠祥阎旭东
刘震 徐玉鹏 王秀领 黄素芳 赵忠祥 阎旭东
摘要:为明确黑龙港地区苜蓿土壤微生物多样性,利用高通量基因测序技术对多年生苜蓿土壤及对照土壤微生物真菌ITS区进行测定,并分析了不同处理间土壤微生物群落特点。结果表明,对照处理获得真菌OTUs 523个,四年生苜蓿处理OTUs 742个。物种分类显示对照处理隶属12门22纲56目107科146属,四年生苜蓿处理隶属10门28纲60目126科186属。各处理水平下均以子囊菌门(Ascomycota)为优势真菌种群,其相对丰度分别为54.69%和61.81%。苜蓿多年建植后可以增加土壤中腐生菌类数量,加快腐殖化进程,有利于提高土壤肥力及有机质含量,同时也可以降低担子菌门等致病菌的相对丰度,对减少植物土传病害起到积极作用。
关键词:黑龙港;苜蓿;土壤微生物;真菌;群落结构;多样性分析
中图分类号:S154.3 文献标志码: A 文章编号:1002-1302(2021)10-0197-04
苜蓿是我国北方重要的饲料作物,拥有高蛋白、生物固氮能力强及适应能力强等特性,近年来已成为北方调整农业种植结构的重要产业[1]。同时,常年种植苜蓿可以显著改善土壤物理结构,Eynard等研究表明,同耕地土壤相比,草地土壤团聚体稳定性约高17%[2]。 Barber通过多年试验得出结论,长期种植苜蓿可提高土壤水稳性团聚体指数,该指数同苜蓿种植年限呈正相关关系[3]。不仅如此,种植苜蓿还会影响土壤养分组成,罗珠珠等研究发现,苜蓿生长达一定年限后,可以显著提高土壤表层轻组有机碳[4];黄祥丰等研究表明,种植苜蓿可以提高0~60 cm各土层有机质、全氮、碱解氮含量[5]。然而,关于苜蓿对土壤的影响主要集中于土壤养分时间及空间变化,对土壤微生物研究较少,吴建峰研究发现土壤微生物可以促进植物根系吸收养分[6],同时土壤微生物也是土壤生态功能的重要指示物[7]。因此,研究微生物组成及其特性有重要意义。
高通量测序技术作为新一代测序技术,通过基因序列对土壤微生物进行分析,在分析微生物群落结构时有巨大优势,能更好地揭示土壤中微生物群落及构成[8]。本研究通过高通量测序方法对沧州市农林科学院试验基地土壤中的真菌群落构成及丰度进行了分析,为苜蓿改良土壤生态环境、提高土壤肥力提供了理论依据。
1 材料与方法
1.1 试验材料
2018年7月15日在河北省沧州市献县北张白村沧州市农林科学院试验基地(116.36E,38.31N)选择四年生苜蓿根际土壤(Y4)作为研究对象,同时选取该研究对象周边未耕作土壤作为对照(CK)。采用五点法取样,每个处理按照梅花形确定5个采样点。每个采样点内选取生长良好的苜蓿样品,去除其周边及表层杂草后,采用抖落法取水平深度 0~20 cm苜蓿根际土壤约10 g为1个采样点,待5个采样点全部取完后充分混匀,采用四分法选取混合均匀的土壤样品保存为1份土壤待测样品。将待测样品装入无菌密封袋,放入装有干冰的泡沫箱中保存。待全部样品采集完成后运输回试验室,超低温冰箱-80 ℃保存。
1.2 试验方法
1.2.1 土壤样品DNA提取及测序 将土壤提取基因组后采用NanoDrop-ND1000分光光度仪测定总DNA浓度,并利用1%琼脂糖凝胶电泳检测总DNA提取质量。选择质量合格的DNA样品进行真菌ITS1区测序,测序工作由北京百迈客科技有限公司完成,使用Illumina-HiSeq平台进行测序。
1.2.2 DNA质量评价 去除低质量Reads,根据PE数据之间Overlap关系将成对的Reads拼接成一条序列。去除Tags两端的Barcode序列及引物序列,去除嵌合体及其短序列等后得到高质量的Clean Tags。然后对拼接好的序列进行进一步的去除嵌合体和段序列得到优质序列。
1.2.3 生物信息分析 使用QIIME 1.8.0[9]软件中的 UCLUST[10]對Tags在97%相似度水平下获得OTU,并基于真菌分类学数据库对OTU进行分类学注释,统计各样品OTU中的丰度信息。
2 结果与分析
2.1 序列统计和微生物多样性
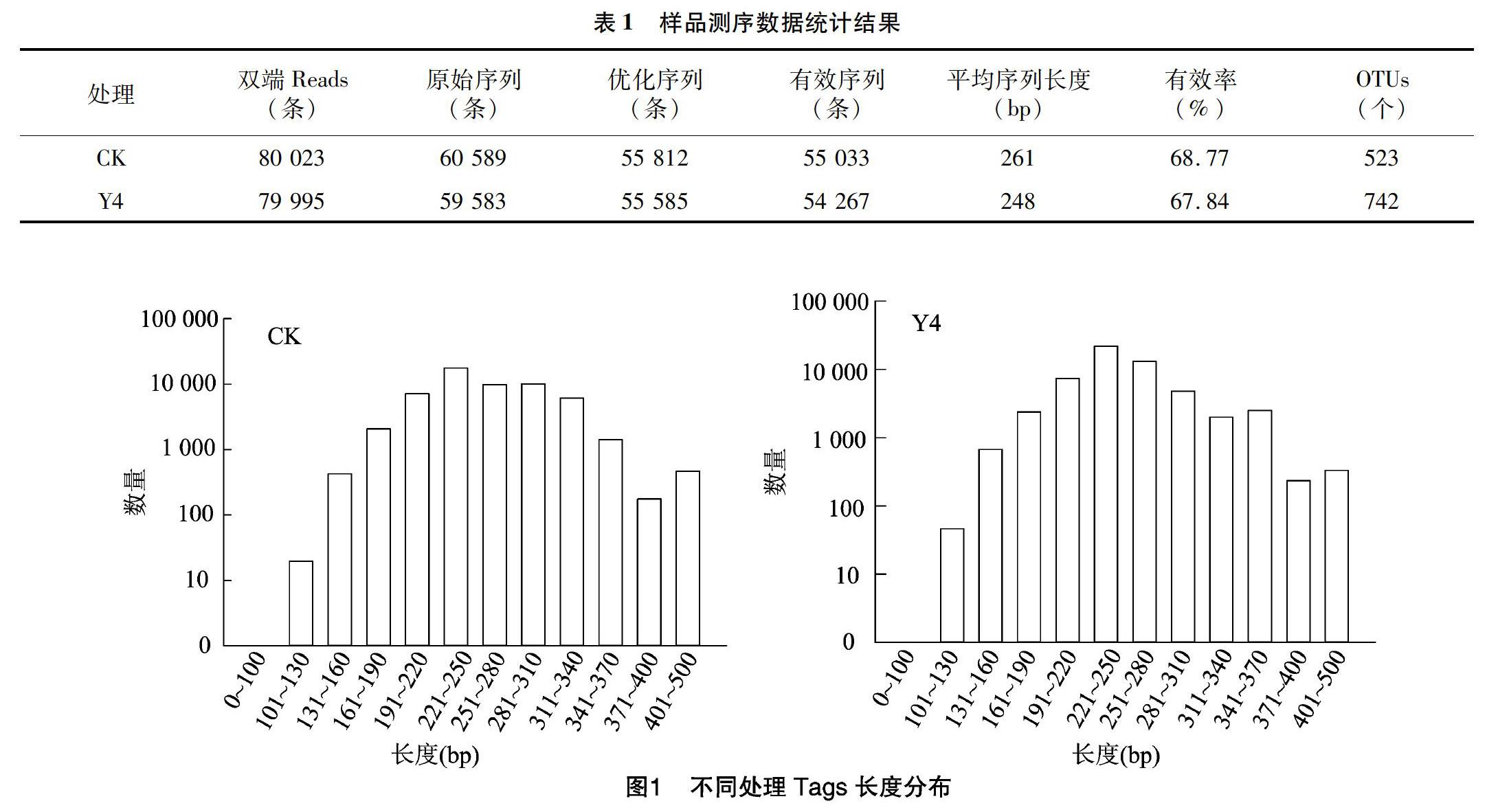
经提取后,四年生苜蓿土壤(Y4)DNA浓度为2.5 ng/μL,D260 nm/280 nm值为4.18,D260 nm/230 nm值为0.03,对照土壤(CK)DNA浓度为1.9 ng/μL,D260 nm/280 nm值为2.88,D260 nm/230 nm值为0.08。各处理土壤样品符合PCR检测标准,进一步以行扩增,其产物经过高通量测序,样品测序数据统计结果见表1,Tags长度分布见图1。
2.2 对照土壤真菌群落组成
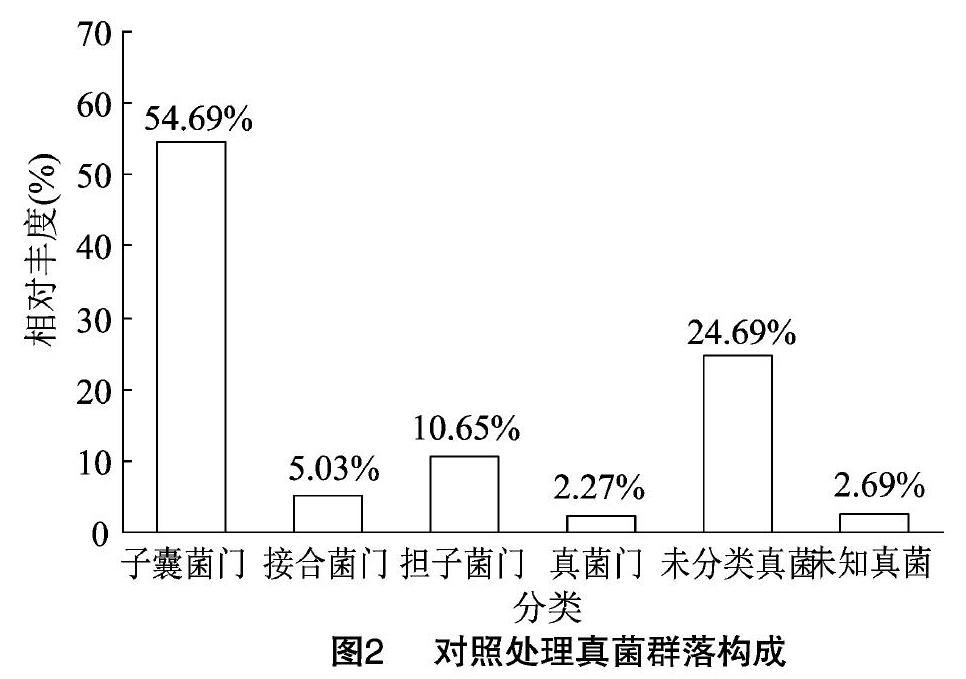
通过对照土壤真菌OTUs分析结果可以看出,其真菌群落隶属于12门22纲56目107科146属。由图2可见,在门水平分类上至少隶属于12个不同的真菌门,其中,相对丰度≥2%的有子囊菌门、接合菌门、担子菌门、真菌门,其相对丰度分别为54.69%、5.03%、10.65%、2.27%;另外还有未能分类的真菌和未知真菌,其相对丰度分别为24.69%和2.69%。
在纲水平上至少隶属于22个纲,相对丰度≥1%的有12个,其名称分别为粪壳菌纲(30.57%)、座囊菌纲(12.84%)、散囊菌纲(8.09%)、酵母菌(2.16%)、锤舌菌纲(1.03%)、新囊菌纲(2.27%)、孢霉纲(3.20%)、毛霉纲(1.83%)、伞菌纲(9.36%)、节担菌纲(1.29%)、未分类真菌(24.69%)和未知真菌(2.69%)。
在目分类水平上隶属于56目,相对丰度≥1%的有12个,分别是肉座菌目(18.23%)、散囊菌目(7.13%)、粪壳菌目(5.85%)、格孢腔菌目(6.05%)、煤炱目(4.36%)、牛肝菌目(3.37%)、被孢霉目(3.20%)、新丽鞭毛菌目(2.27%)、球团目(2.11%)、毛霉目(1.83%)、未分类真菌(27.18%)、未知真菌(18.43%)。
2.3 四年生苜蓿处理土壤真菌生物多样性
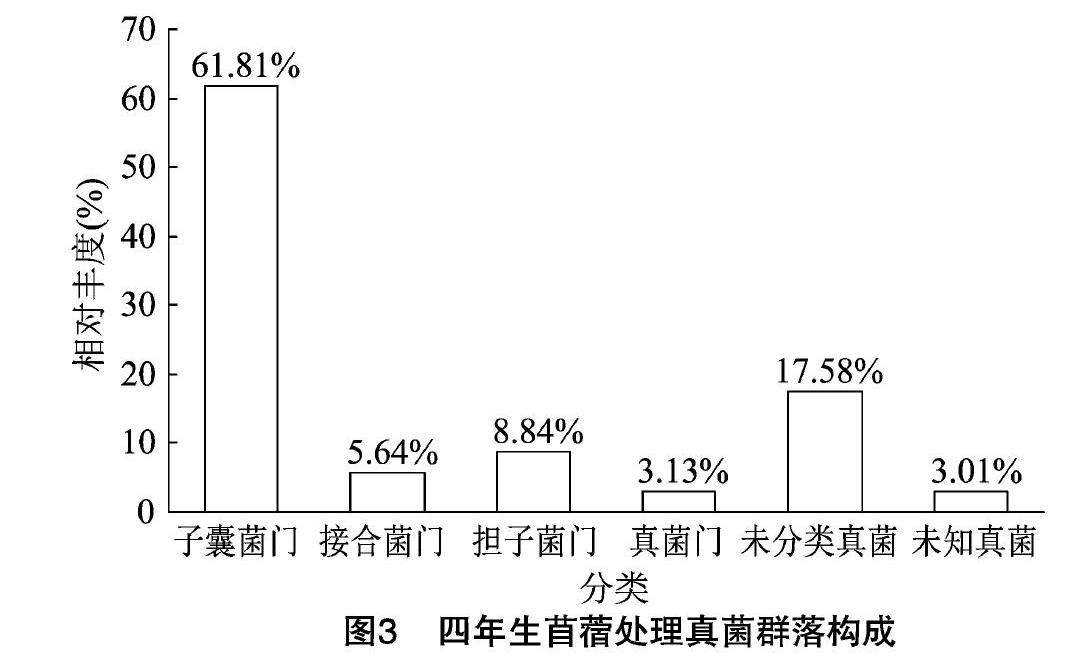
通过对四年生苜蓿土壤真菌OTUs分析结果可以看出,其真菌群落隶属于10门28纲60目126科186属。由图3可见,在门水平分类上至少隶属于10个不同的真菌门,其中,相对丰度≥3%的有子囊菌门、接合菌门、担子菌门、真菌门,其相对丰度分别为61.81%、5.64%、8.84%、3.13%;另外还有未能分类的真菌和未知真菌,其相对丰度分别为24.69%和2.69%。
在纲水平上至少隶属于28个纲,其中,相对丰度≥1%的有12个,其名称分别为粪壳菌纲(37.59%)、座囊菌纲(11.11%)、散囊菌纲(9.73%)、酵母菌(2.03%)、锤舌菌纲(1.35%)、新囊菌纲(3.13%)、孢霉纲(3.20%)、毛霉纲(2.44%)、伞菌纲(7.32%)、节担菌纲(1.52%)、未分类真菌(17.58%)和未知真菌(3.01%)。
在目分类水平上隶属于60目,其中,相对丰度≥1% 的有12个,其名称分别是肉座菌目(22.23%)、散囊菌目(8.99%)、粪壳菌目(8.08%)、格孢腔菌目(5.05%)、煤炱目(4.47%)、牛肝菌目(4.08%)、被孢霉目(3.20%)、新丽鞭毛菌目(3.13%)、球团目(2.27%)、毛霉目(2.44%)、未分类真菌(20.73%)、未知真菌(15.35%)。
2.4 Alpha和Beta多样性分析
Alpha多样性(表2)分析可以看出,Y4处理OUT数量为710,较CK处理OUT数量提高19.13%,ACE指数和Chao1指数也分别提高了19.21%和18.78%,说明Y4土壤中真菌微生物种类及丰度均大于CK土壤。Shannon指数值越大,说明样品中物种多样性越高,结合Simpson和Shannon指数可以看出,Y4土壤中真菌的种类也高于CK土壤,结果同OUT等指数得出的结论相似。
而由图4可见,PCA分析可以代表89.70%的主要信息,其中可以明显看出CK与Y4处理距离较远,差异性较大;而通过Beta多样性组间差异分析也可以直观反映出CK与Y4处理组间差异较大,且达到极显著水平。
3 结论与讨论
土壤中含有大量组成结构复杂的微生物群落[8],这些群落在地球化学循环中起重要的作用[11-13], 不仅影响土壤有机质分解、土壤养分转化
及运移,同时在土壤腐殖质形成、各类土壤污染物的分解以及植物对土壤养分的吸收过程中也发挥一定的功能。通常可以用土壤微生物群落构成来反映土壤微生物多样性,也在一定程度上体现了土壤生态系统的稳定性[14]。一般来说,微生物群落组成的复杂程度与土壤抵御不良生态环境的能力成正比。本试验对多年生苜蓿土壤及对照土壤中真菌群落组成进行了分析,发现常年种植苜蓿在门水平真菌分类相对明确,但在纲水平及目水平下,仍有较大比例真菌不能准确分类。
测序结果表明,对照及四年生苜蓿土壤中均检测到子囊菌门、接合菌门、担子菌门和真菌门,群落组成相对简单。子囊菌门为土壤中的优势群落,对照和四年生苜蓿处理子囊菌门相对丰度分别为54.69%和61.81%,四年生苜蓿的提高7.12百分点;结核菌门、真菌门及未知真菌无明显变化;担子菌门相对丰度分别为10.65%和8.84%,四年生苜蓿的下降了1.81百分点。同对照相比,四年生苜蓿中有部分未分类真菌被检测出,导致该处理中未分类真菌相对丰度下降了7.11百分点。
本试验研究结果表明,盐碱条件并不是子囊菌门真菌生存的限制因素,子囊菌门真菌群落可以在盐碱条件下生存,甚至进一步扩大群落[15-16],该结果同李岩等的研究结果[17-18]相似。子囊菌门为土壤中优势真菌群落,其群落主要由腐生菌构成。腐生菌可以通过分泌多种酶以体外方式分解土壤中的有机质及动植物尸体,形成二氧化碳、无机盐和简单的有机物,为农田土壤中的植物提供养分,是土壤养分循环过程中的重要真菌,说明在黑龙港盐碱地区种植苜蓿可以提高子囊菌门真菌群落相对丰度,进一步改善土壤养分环境。同时,本研究还发现土壤中担子菌门相对丰度降低,担子菌门中一些微生物可以引起作物黑穗病、锈病以及一些其他森林和植物的病害,该门类真菌相对丰度的降低对减少作物病害也起到了一定积极的作用。本研究还发现,在多年生苜蓿土壤中肉座菌目及粪壳科目菌类相对丰度有显著提高,分别提高了4.00百分点和2.23百分点,这2类真菌的主要作用是降解腐烂有机质及纤维素[19]。
综上所述,本试验通过高通量测序技术分析了长期种植苜蓿土壤中真菌群落结构多样性及结构性,发现多年种植苜蓿后,土壤真菌群落结构发生了改变,腐殖真菌群落相对丰度提高,腐殖化进程加快,可利于提高土壤肥力及有机质。但是由于根际土壤微生物结构复杂,受土壤物理结构、施肥方式等影响较大,不同作物根系分泌物对微生物影响也不尽相同[20-24]。因此,苜蓿种植对土壤微生物真菌影响的主要因素和机制尚未完全明了,還需开展进一步研究。
参考文献:
[1]赵海明,谢 楠,刘贵波,等. 紫花苜蓿品种在河北低平原区的引进筛选试验研究[J]. 中国草地学报,2006,28(3):16-20.
[2]Eynard A,Schumacher T E,Lindstrom M J,et al. Aggregate sizes and stability in cultivated South Dakota Prairie Ustolls and Usterts[J]. Soil Science Society of America Journal,2004,68(4):1360-1365.
[3]Barber S A. The influence of alfalfa,bromegrass,and corn on soil aggregation and crop yield[J]. Soil Science Society of America Journal,1959,23(4):258-259.
[4]罗珠珠,李玲玲,牛伊宁,等. 土壤团聚体稳定性及有机碳组分对苜蓿种植年限的响应[J]. 草业学报,2016,25(10):40-47.
[5]黄祥丰,向地奎,贾黎明,等. 间作苜蓿对毛白杨纸浆林生长和地力的影响[J]. 南京林业大学学报(自然科学版),2013,37(4):39-44.
[6]吴建峰,林先贵. 土壤微生物在促进植物生长方面的作用[J]. 土壤,2003,35(1):18-21.
[7]王继萍,庞碧琳,于亚军. 不同复垦年限煤矸山土壤微生物群落特征及其指示作用[J]. 干旱区资源与环境,2017,31(9):140-144.
[8]牛世全,龙 洋,李海云,等. 应用IlluminaMiSeq高通量测序技术分析河西走廊地区盐碱土壤微生物多样性[J]. 微生物学通报,2017(9):2067-2078.
[9]Caporaso J G,Kuczynski J,Stombaugh J,et al. QIIME allows analysis of high-throughput community sequencing data[J]. Nature Methods,2010,7(5):335-336.
[10]Edgar R C. Search and clustering orders of magnitude faster than BLAST[J]. Bioinformatics,2010,26(19):2460-2461.
[11]van der Heijden M G A,Bardgett R D,van Straalen N M. The unseen majority:soil microbes as drivers of plant diversity and productivity in terrestrial ecosystems[J]. Ecology Letters,2008,11(3):296-310.
[12]Fuhrman J A,Fuhrman J A. Microbial community structure and its functional implications[J]. Nature,2009,459(7244):193-199.
[13]张 晟,张徐洁,赵 远,等. 不同温度制备的水稻秸秆生物炭对稻田土壤固碳减排及微生物群落结构的影响[J]. 江苏农业学报,2019,35(5):1102-1111.
[14]张红娟,陈 丽,赵 芳,等. 山西临汾小麦—玉米轮作田土壤微生物多样性分析[J]. 中国植保导刊,2018,38(11):9-15.
[15]韩世忠,高 人,马红亮,等. 中亚热带森林土壤真菌多样性的案例研究[J]. 热带亚热带植物学报,2015,23(3):343-352.
[16]韩世忠,高 人,马红亮,等. 建瓯万木林自然保护区两种森林类型土壤真菌多样性[J]. 生态学杂志,2015,34(9):2613-2620.
[17]李 岩,何学敏,杨晓东,等. 不同生境黑果枸杞根际与非根际土壤微生物群落多样性[J]. 生态学报,2018,38(17):5983-5995.
[18]王艳云,郭笃发. 黄河三角洲盐碱地土壤真菌多样性[J]. 北方园艺,2016(18):185-189.
[19]张 玥,胡雲飞,王树茂,等. 茶园年限对根际土壤真菌群落结构及多样性的影响[J]. 应用与环境生物学报,2018,24(5):972-977.
[20]Berendsen R L,Pieterse C M,Bakker P A. The rhizosphere microbiome and plant health[J]. Trends in Plant Science,2012,17(8):478-486.
[21]張 翔,宋水山,黄亚丽,等. 基于高通量测序分析河北省中南部地区耕地土壤细菌多样性[J]. 华北农学报,2018,33(4):196-203.
[22]张萌萌,敖 红,张景云,等. 建植年限对紫花苜蓿根际土壤微生物群落功能多样性的影响[J]. 草业科学,2014,31(5):787-796.
[23]张萌萌,敖 红,李 鑫,等. 桑树/苜蓿间作对根际土壤酶活性和微生物群落多样性的影响[J]. 草地学报,2015,23(2):302-309.
[24]张 超,周 旭,张 海,等. 苹果专用肥对旱地果园土壤酶活性以及微生物多样性的影响[J]. 生态学杂志,2017,36(12):3485-3492.
