利用高通量表型平台分析紫叶紫菜薹新组合19-520的表型特征
2021-06-30朱红芳李晓锋奚丹丹高璐张兆辉朱玉英
朱红芳 李晓锋 奚丹丹 高璐 张兆辉 朱玉英

摘要: 以紫叶紫菜薹组合19-520和2个亲本材料为试验材料,于播种后75 d,以普通绿叶紫菜薹为对照,采用高通量表型平台进行表型测定和LemnaTec Scanalyzer 3D成像。研究了紫叶紫菜薹组合19-520及其亲本株高、幅宽、紧密度、投影面积和植株相对含水量等指标的差异。结果表明,紫叶紫菜薹组合19-520的株高、幅宽、植株紧密度、投影面积、相对含水量和花青素相对含量均较高,表型特征表现优良。因此,紫叶紫菜薹组合19-520作为新的紫菜薹组合在综合表型上表现良好,可进一步推广应用。
关键词: 紫菜薹;株高; 投影面积;紧密度;相对含水量
中图分类号: S634.6 文献标识码: A 文章编号: 1000-4440(2021)02-0465-06
Abstract: The combination of 19-520 and its two parent materials were used as the test meterials and the normal green leaf purple-caitai was used as the control to test the phenotype and make the LemnaTec Scanalyzer 3D imaging by using the high-throughput phenotype platform 75 days after sowing. The differences in plant height, width, compactness, projection area and relative water content of the combination 19-520 and its parents were studied. The results showed that the plant height, width, plant compactness, projection area, relative contents of water and anthocyanin of 19-520 were all better than its parents and the normal green leaf purple-caitai, and the phenotypic characteristics were excellent. As a new purple leaf purple-caitai combination,19-520 has significant comprehensive phenotypic characteristics, which can be further applied in popularization and application.
Key words: purple-caitai;plant height;projection area;compactness;relative water content
植物遗传学、育种学和生物信息学的研究离不开植物基因型、表型和环境这3个因素[1],生物学家Freimer等[2]、Houle等[3]和Gjuvsland等[4]先后对表型进行了定义,认为表型是生物某一特定的物理外观或者结构组成,也就是植株个体在特定环境条件下表现出来的性状特征总和。研究生物表型特征的学科被称为表型组学,这一概念由Steven A.Garan在1996年最早提出,他将生物各方面的表型特征作为一个整体来研究,这个研究的整体即为表型组学。将生物群体详细的表型数据信息结合生物群体的基因型特征进行分析,是基因组学研究的基础,并可以应用于复杂生物体生命系统的研究中[5]。利用可见光、超光谱、近红外、远红外以及X光成像技术构建分析平台,并利用该平台进行表型分析的组学称为高通量表型组学,利用高通量表型组学可以在短时间内实现大量植物个体多维表现型的高精度获取和定量分析现代技术体系[6]。
近年来,高通量表型技术得到快速发展[6],各类表型测量仪器和表型平台迅速被开发和建立[7],进一步提升了全自动、高通量表型成像技术,能更加准确、快速、标准地进行表型研究[8],与传统的植物表型性状的调查分析相比,高通量表型技术测量分析更省时省力,受人为因素影响很小,不需要破坏组织进行取样,且能连续监测植物的生长状态和植物的动态变化[9-10]。在水稻[11]、玉米[12]和谷類[13]等作物上逐渐被应用。高通量表型技术的发展为系统地研究植株表型以及加快植物新品种的选育提供了技术支撑。
AgriPhenoTM开放式科研平台由上海泽泉科技股份有限公司在浦东孙桥现代农业园区投资建设,该平台是国内第一家为植物研究和育种提供高通量植物表型分析、植物基因型分析以及植物表型-基因型联合分析服务的平台。引进了目前全球先进的与表型植物育种相关的设施和设备,为植物生长、生理生态变化、基因型和表型结合分析提供全面服务[14]。
紫菜薹(Brassica compestris L. var. purpurea Bailey 2n=2x=20)原产于中国,主栽于湖北、湖南和重庆等长江流域地区,又名红菜薹,是十字花科芸薹属亚种之一。紫菜薹的薹色紫红而鲜亮,薹叶较小,主要食用器官为花薹和薹叶,新鲜的花薹和薹叶看上去肥嫩多汁,尝起来脆爽可口,且富含多种矿质元素。近几年,紫菜薹因其紫色的花薹富含丰富的营养物质尤其是具有保健功能的花青素,已经作为优质高档的蔬菜在全国范围内引种栽培[15-16]。花青素分为天竺葵色素、矢车菊色素、飞燕草色素、芍药色素、牵牛花色素和锦葵色素等6大类,它不仅使蔬菜、水果和花卉看起来五彩缤纷,而且具有抗氧化能力,对心脏病、动脉硬化、静脉炎、关节炎、过敏、老年性痴呆、冠心病及癌症等有防治作用。随着人们生活水平的提高,花青素的保健作用逐步引起人们的重视,对紫菜薹新品种的要求也越来越高,为此本课题组经过多年的育种工作,创制了叶片、叶柄和菜薹均富含花青素的新种质,并选育出具有发展潜力的紫叶紫菜薹新组合19-520。
本试验借助上海泽泉科技股份有限公司的AgriPhenoTM开放式科研平台对已育成的紫叶紫菜薹新组合19-520进行表型数据收集,分析该组合在生长中的表型特征。为紫叶紫菜薹的推广和应用,提供更多表型数据和理论依据。
1 材料与方法
1.1 试验地概况
该试验于2019年12月至2020年1月在上海泽泉科技股份有限公司的玻璃温室内进行,该公司位于上海自由贸易试验区,属北亚热带季风气候。
1.2 试验材料
供试紫菜薹是由上海市农业科学院园艺研究所经过多年的培育获得的紫叶紫菜薹新组合19-520及19-520的亲本P1、P2。该组合属于晚熟类型,叶片、叶柄、叶脉以及花薹均为紫色,花薹略带蜡粉;亲本P1属于中晚熟类型,叶片、叶柄、叶脉以及花薹也均为紫色,花薹无蜡粉;亲本P2属于晚熟类型,叶片、叶柄、叶脉以及花薹也均为紫色,花薹略有蜡粉。对照(CK)为普通绿叶紫菜薹,叶柄、主叶脉和花薹均为紫色,花薹略带蜡粉。
1.3 试验处理
2019年8月10日选取饱满、整齐一致的种子,点播在穴盘中,基质为泥炭和蛭石的混合物,体积比为3∶1。播种后30 d进行大棚定植,45 d后每个材料选择3株大小一致的植株,进行表型成像,每株选取第三片功能叶,分别进行各项指标的测定。花薹长到35 cm左右时取CK、新组合19-520以及新组合19-520的亲本P1和P2的叶片、叶柄和花薹测定花青素的含量,每个品种(组合)选择9株,每3株混合取样,作为1个重复,共3次重复,测定方法参照试剂盒(上海酶联生物科技有限公司产品)说明书,应用双抗体夹心法测定样品中花青素(ANTH)水平。
1.4 测定项目与方法
1.4.1 图像获取 先选择高通量表型平台上的可见光成像系统进行成像,然后利用德国LemnaTec公司的Scanalyzer3D成像软件Lemna Control进行图片获取,拍照时可以选择可见光与近红外双镜头对放入平台的供试材料进行拍照,并对供试材料进行无损成像。可见光镜頭和近红外镜头的成像角度均选择顶部、侧面0°和90°。可见光镜头参数设置为,顶部exposure 20、focus 2 000、zoom 2 000,侧面exposure 20、focus 3 500、zoom 1 500;近红外镜头参数设置为,顶部exposure 30 030、focus 500、zoom 1 500,侧面exposure 30 030、focus 100、zoom 1 500。成像后选择单株顶部、侧面0°和侧面90°的原始图像各1张,并保存至系统的Lemna Base文件中[14]。
1.4.2 数据分析 数据分析根据何红梅等[9]报道的步骤进行,首先,Lemna Mine导出原始数据(以pixel为单位)。然后,利用像素转换系数(pix-el/mm)将原始数据转换为以国家标准为单位的数据在Excel 2010软件上整理。最后,利用LemnaTec Scanalyzer 3D的分析软件Lemna Grid编辑图像,并计算紫菜薹植株生长相关的表型数据。表型数据的计算分析主要包括株高、幅宽、总投影面积、紧密度和植株相对含水量。其中株高和幅宽采用侧面 0°与侧面 90°数据的平均值,总投影面积为侧面0°、90°与顶部数据的总和。所获得的样本数据都用Excel进行整理,并计算平均值和标准差。利用SPSS 20软件对数据进行方差分析和差异显著性检验。
2 结果与分析
2.1 紫菜薹表型及分析图的获得
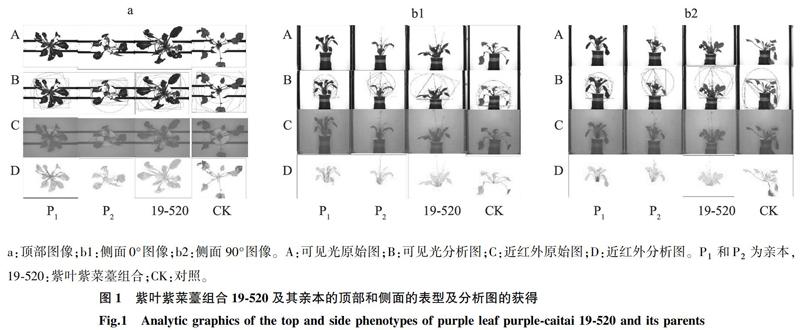
紫菜薹在高通量表型平台上,通过可见光和近红外进行表型成像后,每一个单株都获得3张RGB图像,分别为紫菜薹植株顶部图像、侧面0°和侧面90°图像,如图1所示,a为植株顶部的成像,b1 和b2分别为侧面0°和侧面90°成像,并列出亲本P1和P2,紫叶紫菜薹组合19-520及CK的相关表型图像及其分析图。根据可见光和远红光成像的图片分析可以获得植株的株高、幅宽、紧密度、相对含水量等重要的农艺表型特征。
2.2 紫菜薹的株高与幅宽
植株的株高和幅宽是衡量植株高矮和水平宽窄的重要指标,紫菜薹植株的株高和幅宽是利用可见光侧面成像得到的。植株株高计算的是植株根基部到顶部之间的距离,幅宽计算的是植株水平宽度。由图2可知,紫叶紫菜薹组合19-520的植株幅宽为662.54 mm,与CK差异不显著,与双亲P1和P2差异显著。紫叶紫菜薹组合19-520的植株株高为736.57 mm,与CK及其双亲P1和P2差异显著。说明紫叶紫菜薹组合19-520植株高,水平幅宽宽,在生长势上比其亲本具有一定的杂交优势。
2.3 紫菜薹的紧密度
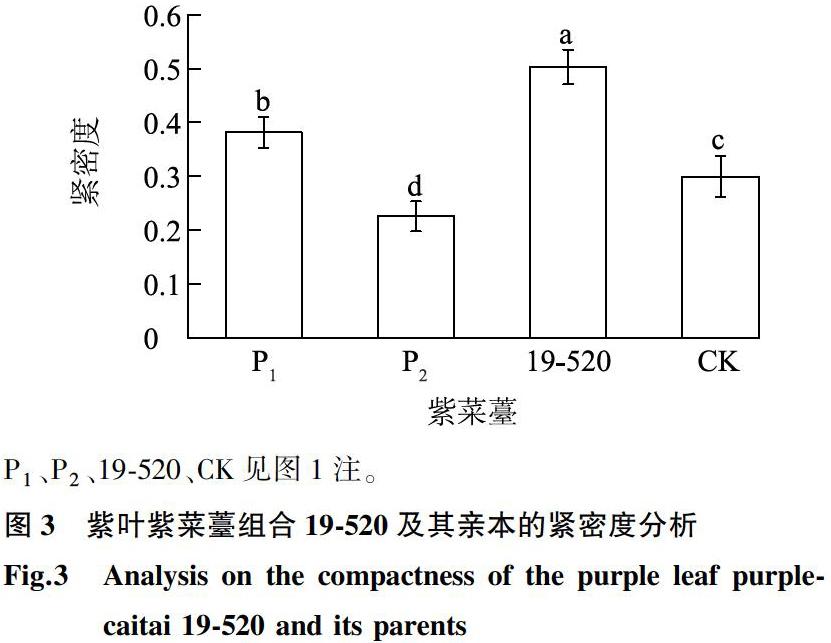
紧密度是衡量植株紧密程度的指标,本试验的紧密度根据顶部获得的表型数据,按照植株的投影面积与最小外接多边形面积的比值分析,比值越大,植株越紧密。由图3可见,紫叶紫菜薹组合19-520的顶部紧密度为0.50,比CK及其亲本P1和P2显著增加。紫叶紫菜薹组合19-520在其亲本和CK中的顶部紧密度表现为最高,说明紫叶紫菜薹组合19-520植株在生长过程中叶片、叶柄最为紧密。
2.4 紫菜薹的投影面积分析
光投射在物体上所留下影子的面积为投影面积,受投影不同角度的影响而产生不同的投影面积,其中总投影面积为紫菜薹植株顶部、侧面0°、侧面90°的投影面积之和[17]。如图4所示,紫叶紫菜薹组合19-520的总投影面积最大,显著高于CK、P1和P2的总投影面积。
2.5 紫菜薹的相对含水量分析
植株相对含水量主要是通过近红外成像获得[18],在近红外分析图中,相对含水量根据成像图片中植物深浅分级,颜色越深,相对含水量越高,灰度分级也就越低[9]。本试验中以顶部和侧面0°的成像进行植株相对含水量分析。顶部近红外成像共分为10级,灰度值介于80~200。从图5可知,4份材料的相对含水量均主要集中在2~5级,其余的等级所占百分比较少。组合19-520及其亲本的2级相对含水量所占百分比均低于CK。4份材料中3级相对含水量所占百分比均最高,其中组合19-520的3级相对含水量所占百分比最大,为58.89%,其次是CK和P1,分别为57.67%和57.13%,P2最小,为33.05%。除亲本P2以外,其他3份材料植株顶部2~5级相对含水量占比均为90%左右。
侧面0°近红外成像分析的灰度值也共分为10级,介于60~200,由图5的侧面成像可知,4份材料的相对含水量主要集中在1~5级,组合19-520的1级相对含水量所占百分比为2.76%,其亲本P1、P2及CK基本没有1级。 2级相对含水量所占百分比最高是组合19-520,为19.19%,其次分别为P2、CK、P1。3级相对含水量是4份材料中相对含水量占比均为最高的,从高到低依次为亲本P2(58.28%)、组合19-520(39.40%)、CK(37.72%)、亲本P1(20.37%)。除亲本P1以外,其他3份材料植株顶部的2~5级相对含水量占比均大于90%。
2.6 紫菜薹的花青素含量
由表1可见,紫菜薹花青素相对含量在叶片、叶柄和花薹中存在着较大的差异。紫叶紫菜薹组合19-520的叶片和叶柄的花青素相对含量介于2个亲本之间,叶片的花青素相对含量比CK高96.53%,叶柄的相对含量则比CK高36.31%。而花薹的花青素相对含量则不仅高于2个亲本,而且高于CK,差异显著。
3 讨论
随着市场需求的增大,紫菜薹种植面积逐渐增加,相关研究也越来越受到关注,目前对紫菜薹的研究主要集中在紫色性状和分蘖性状方面[19],有关表型的研究很少。本试验利用AgriPhenoTM表型平台温室Scanalyzer3D仪器,以普通绿叶紫菜薹为对照,对紫叶紫菜薹新组合及其双亲进行表型分析。从其叶片、叶柄和花薹的颜色和测定的花青素相对含量等指标可知,紫叶紫菜薹组合19-520叶片,叶柄和花薹花青素含量均较高。本试验结果表明,特色紫叶菜薹组合19-520在幅宽、株高和紧密度上较亲本及普通绿叶紫菜薹好,为紫菜薹的表型育种提供了数据支撑。
本试验中紫叶紫菜薹组合19-520总投影面积均高于其双亲和对照,表明了其在生物量和叶面积上比其双亲和对照高,这与Hairmansis等[11]的结论一致,认为不同角度的投影面积可以简单地评估植株的生物量或叶面积的大小。
植株的相对含水量是衡量植株品质的一个指标,其含水量越高,干物质含量就相对减少,则会影响产品品质[9]。本试验结果表明,紫叶紫菜薹组合19-520及其亲本和对照主要以2~5级的相对含水量为主,均占到整个植株相对含水量的90%左右,其干物质含量占比相差不多,品质差异不大。通过使用温室型Scanalyzer3D仪器,获得了大量的表型數据,我们在众多的表型数据中,选择株高、幅宽、紧密度、投影面积和植株相对含水量等几个主要农艺性状指标,对紫叶紫菜薹组合19-520及其双亲和普通绿叶紫菜薹进行表型差异分析,结果表明,高通量表型仪器及其分析软件能快速获取植株的表型数据,并根据育种的需要筛选具有代表性的农艺性状指标进行分析,迅速掌握植株在生长过程中的表型性状,为培育优良新品种以及新品种的表型鉴定和品比试验提供高通量的数据,有助于新品种的选育。表型数据和基因组数据的结合、比对和分析,将大大提高人们对植物数量性状的选择能力,从而促进高通量表型育种的发展。但如何利用表型分析获得的相关参数,以及如何将表型数据与产量和品质更好地进行相关性分析,还需要进一步的研究。后期的工作将对紫叶紫菜薹的产量和品质与其投影面积、叶面积等高通量的表型数据的相关性进行进一步的分析和研究。
参考文献:
[1] FURBANK R T. Plant phenomics: from gene to form and function[J]. Functional Plant Biology, 2009,36(10/11): 5-6.
[2] FREIMER N, SABATTI C. The human phenome project[J]. Nature Genetics, 2003,34(1): 15-21.
[3] HOULE D, GOVINDARAJU D R, OMHOLT S. Phenomics: the next challenge[J]. Nature Reviews Genetics, 2010,11(12): 855-866.
[4] GJUVSLAND A B, VIK J O, BEARD D A, et al. Bridging the genotype-phenotype gap: what does it take?[J]. Journal of Physiology, 2013,591(8): 2055-2066.
[5] MAHNER M, KARY M. What exactly are genomes, genotypes and phenotypes? And what about phenomes?[J]. Journal of Theoretical Biology, 1997,186(1): 55-63.
[6] 丁启朔,李海康,孙克润,等. 基于机器视觉的稻茬麦单茎穗高通量表型分析[J]. 中国农业科学, 2020,53(1): 42-54.
[7] 段凌凤,杨万能. 水稻表型组学研究概况和展望[J]. 生命科学, 2016,28(10):1129-1137.
[8] 杨有新,杨泽茂,吴才君,等. 植物表型组学研究进展[J]. 江西农业大学学报, 2015,37(6): 1105-1112.
[9] 何红梅,申海燕,顾 群. 应用高通量表型平台分析四种铁皮石斛的表型差异[J]. 黑龙江农业科学, 2018(12): 57-61.
[10]BERGER B, REGT B D, TESTER M. High-throughput phenotyping of plant shoots[J]. Methods in Molecular Biology, 2012,918: 9-20.
[11]HAIRMANSIS A, BERGER B, TESTER M, et al. Image-based phenotyping for non-destructive screening of different salinity tolerance traits in rice[J]. Rice, 2014,7(1): 16.
[12]NEILSON E H, EDWARDS A M, BLOMSTEDT C K, et al. Utilization of a high-throughput shoot imaging system to examine the dynamic phenotypic responses of a C4 cereal crop plant to nitrogen and water deficiency over time[J]. Journal of Experimental Botany, 2015,66(7):1817-1832.
[13]RAJENDRAN K, TESTER M, ROY S J. Quantifying the three main components of salinity tolerance in cereals[J]. Plant, Cell and Environment, 2010, 32(3):237-249.
[14]何紅梅,申海燕,夏冬冬,等. 不结球白菜生长发育过程中表型变化[J]. 北方园艺, 2019(20):1-8.
[15]聂启军,邱正明,朱凤娟,等. 红菜薹新品种鄂红5号的选育[J]. 湖北农业科学, 2017,56(24): 4828-4829.
[16]王春梅,辛复林,朱大社,等. 红菜薹新品种佳红1号的选育及应用[J]. 长江蔬菜, 2009(8): 20-21.
[17]HAIRMANSIS A, BERGER B, TESTER M, et al. Image-based phenotyping for non-destructive screening of different salinity tolerance traits in rice[J]. Rice, 2014,7(1): 1-10.
[18]陈路格.紫菜薹紫色相关基因的QTL分析与pur07初定位[D]. 武汉:华中农业大学, 2016.
[19]李艺潇. 红菜薹分蘖性状的遗传分析与QTL定位[D]. 武汉:华中农业大学, 2018.
(责任编辑:陈海霞)
