基于代谢组学的黑龙江省不同产地大豆的代谢产物分析
2021-06-30张丽媛代安娜于润众阮长青李志江张东杰
张丽媛,代安娜,于润众,阮长青,李志江,4,张东杰,3,5
(1.黑龙江八一农垦大学食品学院,黑龙江大庆 163319)
(2.黑龙江八一农垦大学电气与信息学院,黑龙江大庆 163319)
(3.北大荒现代农业产业技术省级培育协同创新中心,黑龙江大庆 163319)
(4.黑龙江省杂粮加工及质量安全工程技术研究中心,黑龙江大庆 163319)
(5.国家杂粮工程技术研究中心,黑龙江大庆 163319)
大豆(Glycine max(Linn.)Merr.)最早源自中国,已有5000多年种植历史,种植区主要分布在东北、华北、陕西、四川及长江中下游地区[1]。大豆含有蛋白质、脂肪、膳食纤维、异黄酮等多种营养物质[2-4]。近年来,国内外对大豆的研究主要包括豆制品、大豆油脂、大豆蛋白质以及生理活性物质等[5-7]。而比较不同地区同种大豆代谢产物的研究较少,主要是不同的品种、育成年份、生长阶段,或加工处理后的代谢物,以及在真菌酸碱胁迫下的次生代谢产物[8-12]。大豆的代谢产物也受不同因素(氮、硅及磷含量等)影响[13-15],其可溶性糖含量与其育成年代也呈显著正相关[16]。
代谢组学是对小分子化合物(分子量1000 u以下),运用色谱、质谱、核磁共振和毛细管电泳等技术进行研究[17,18]。它可被应用在食品造假鉴定、食品产地溯源[19-21]、食品真实属性鉴别、发酵食品有毒代谢产物分析及植物源性食品等方面[22,23]。杨冬爽等基于代谢组学研究野大豆(Glycine soja)的耐盐机理[24],张圳等利用高效液相色谱法测定了体外大鼠肠道菌液中大豆苷及其代谢物[25],张玉梅等进行了菜用大豆籽粒代谢物的相关性分析[26]。而非靶向代谢组学则是在有限的相关研究和背景知识的基础上整个代谢组进行系统全面的分析获取大量代谢物的数据,并对其进行处理从而找出差异代谢物的一种研究方法[27]。近年来许多学者利用非靶向代谢组学研究人参治疗脾气虚症、汉麻籽生理活性物质、转基因奶牛的血清和牛奶的代谢产物等[28-30]。
本研究利用气相色谱-质谱法(GC-MS)非靶向代谢谱技术分析了寒地三个不同产区同一品种的大豆代谢产物和代谢途径,分离和鉴定了差异代谢产物,并对其代谢机制进行了探索。这可为寒地大豆品质分析提供理论基础,也为大豆进行分类加工或分产地提取功能性成分提供依据。
1 材料与方法
1.1 材料与试剂
研究的黑河43号品种大豆来自黑龙江省北安龙门(BALM-soy)、尾山(WS-soy)和引龙河(YLH-soy)三个产地。按照保护范围内具有代表性的抽样原则,采用棋盘抽样法随机抽取来自三个产地的大豆样品。
甲醇、异丙醇和乙腈(色谱级),美国Fisher技术公司;N,O-双(三甲基硅基)三氟乙酰胺(BSTFA),甲氧胺盐酸盐和吡啶,美国Sigma-Aldrich公司;结构鉴定的标准物质,美国Sigma-Aldrich公司,北京国家药品和生物制品控制研究所;色谱级用水,美国米利波尔公司的Milli-q水净化系统;其他分析级试剂均来自北京化工厂。
1.2 仪器与设备
GC-MS-QP 2010(配备EI离子源),四极质量分析仪及AOC-20 i自动采样器,日本岛津技术有限公司;HP-5 ms分离柱(30 m×0.25 mm×0.25 μm),美国Agilent有限公司;KQ2200E型超声波清洗机(40 kHz,100 W),昆山超声仪器有限公司;昆山恒温均衡器,昆山恒温均衡器有限公司;MSC-100恒温均衡器,杭州澳盛仪器有限公司;Alpha1-2Ldplus冷冻干燥机,德国CHRIST公司;TGL-16B高速离心机,安亭仪器有限公司。
1.3 实验方法
1.3.1 大豆代谢物的提取与衍生化
大豆在液氮作用下粉碎,经100目筛网筛分,保存于-80 ℃,将100.0 mg大豆样品,800 μL 80%甲醇水溶液和10 μL内标(2-氯苯丙氨酸)置于EP管中。均质化前充分搅拌30 s。从大豆样品中提取极性代谢物组分。为提高提取效率,将含有该混合物的EP管在35 ℃ 80 W超声9.0 min,并剧烈摇动1 min,4 ℃,12,000 r/min离心10.0 min。取200 μL上清液转移至1.5 mL自动样品瓶,冷冻干燥器中干燥过夜。残余物37 ℃在30 μL(20 mg/mL)甲氧基胺盐酸盐和吡啶中溶解60 min,加入30 μL BSTFA,70 ℃ 60 min衍生化处理后,24 h内分析所得溶液。
1.3.2 GC-MS分析
自动取样器注入1 µL样品液,色谱柱:Agilent J&W Scientific HP-5ms(30 m×0.25 mm×0.25 μm);升温程序:80 ℃,保持2 min,10 ℃/min的速度升至320 ℃,保持6 min;80 ℃下进行温度平衡6 min,然后再注入下一次样品。仪器参数设定为:进样口温度280 ℃,EI离子源温度230 ℃,四极杆温度150 ℃,高纯氦气(纯度大于99.999%)作为载气,进样量1.0 μL,不分流进样。采用全扫描模式进行质谱检测,质谱检测范围:50~550m/z。
1.3.3 代谢物定性分析与定量分析
定性分析:将获得的大豆代谢物数据与NIST 14数据库进行比较以获得结构信息并分类,并研究大豆样品的差异代谢产物。
定量分析:采用峰面积归一化法进行各大豆样品成分相对含量的计算,每个样品重复3次,取平均值。
1.3.4 代谢机制分析
通过KEGG数据库比较代谢物的代谢途径。利用KEGG代谢途径检索中的富集分析来分析不同品种大豆的代谢机制。在KEGG筛选的差异代谢物中发现了相关的代谢途径,推断不同产地的大豆样品代谢过程的变化。
1.3.5 数据处理
采用Excel软件对GC-MS数据进行统计分析。
2 结果与讨论
2.1 GC-MS结果分析

注:“-”表示未检测到代谢产物。
三个产地大豆的GC-MS总离子流图如图1、2和3所示。
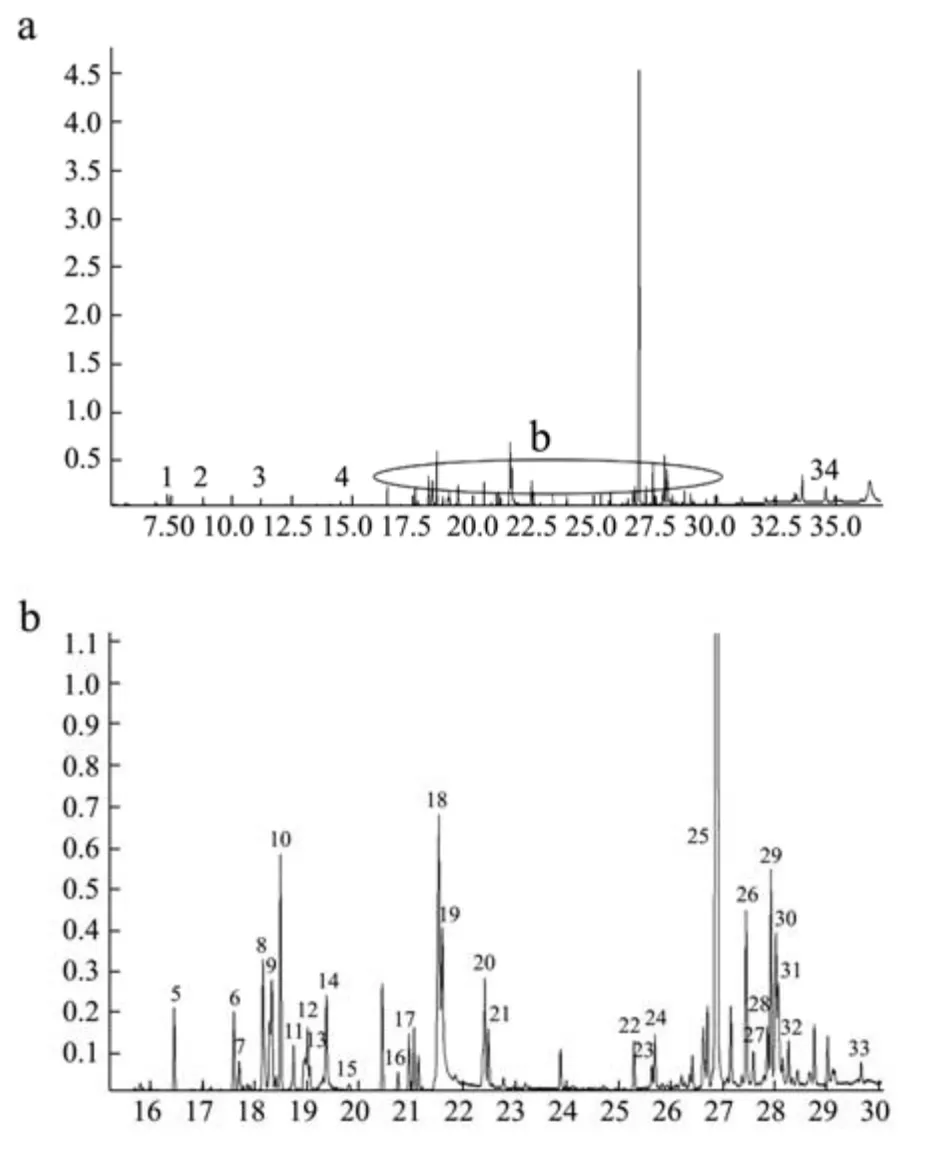
图1 北安龙门大豆总离子流图Fig.1 Totalion flow diagram of BALM-soy samples
从三个总离子流图可以看出产地不同,品种相同的大豆样品的代谢产物明显存在不同。三个产地的大豆样品中共检测到68种代谢产物(表1)。其中62种化合物经NIST数据库精确表征,包括22种糖类及其衍生物,14种脂肪酸及其衍生物,7种醇类,4种酯类,2种氨基酸和13种中间体,6种化合物推断出可能结构。BALM-soy样品中检测到34种代谢物,其中Area>1%的代谢物占总量的65.18%。WS-soy样品中检测到20种代谢物和4种未知化合物,其中Area>1%的代谢物占总量的40.21%。YLH-soy样品中检测到23种代谢物和2种未知化合物,其中Area>1%的代谢物占总量的36.55%。
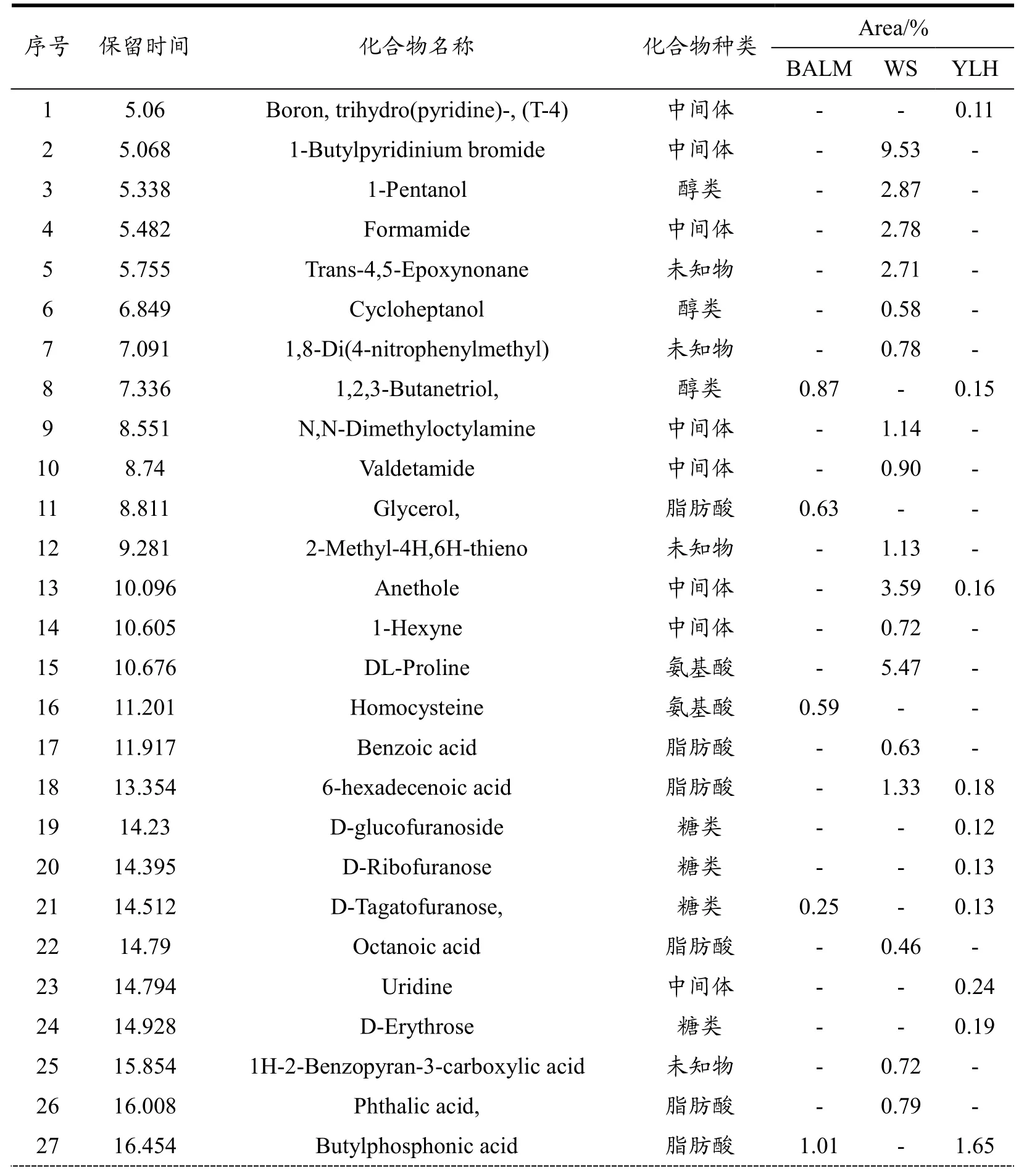
表1 三个产地大豆样品中的代谢产物Table 1 Metabolites form soybean samples from three producing areas
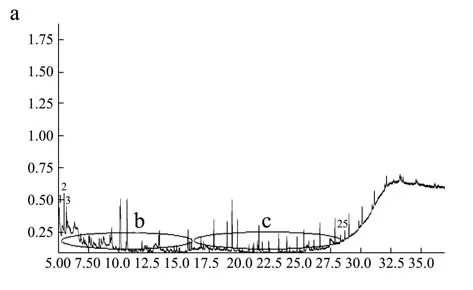
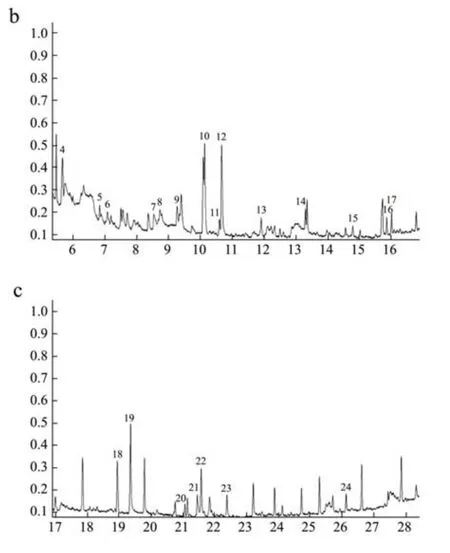
图2 尾山大豆总离子流图Fig.2 Total ion flow diagram of WS-soy samples
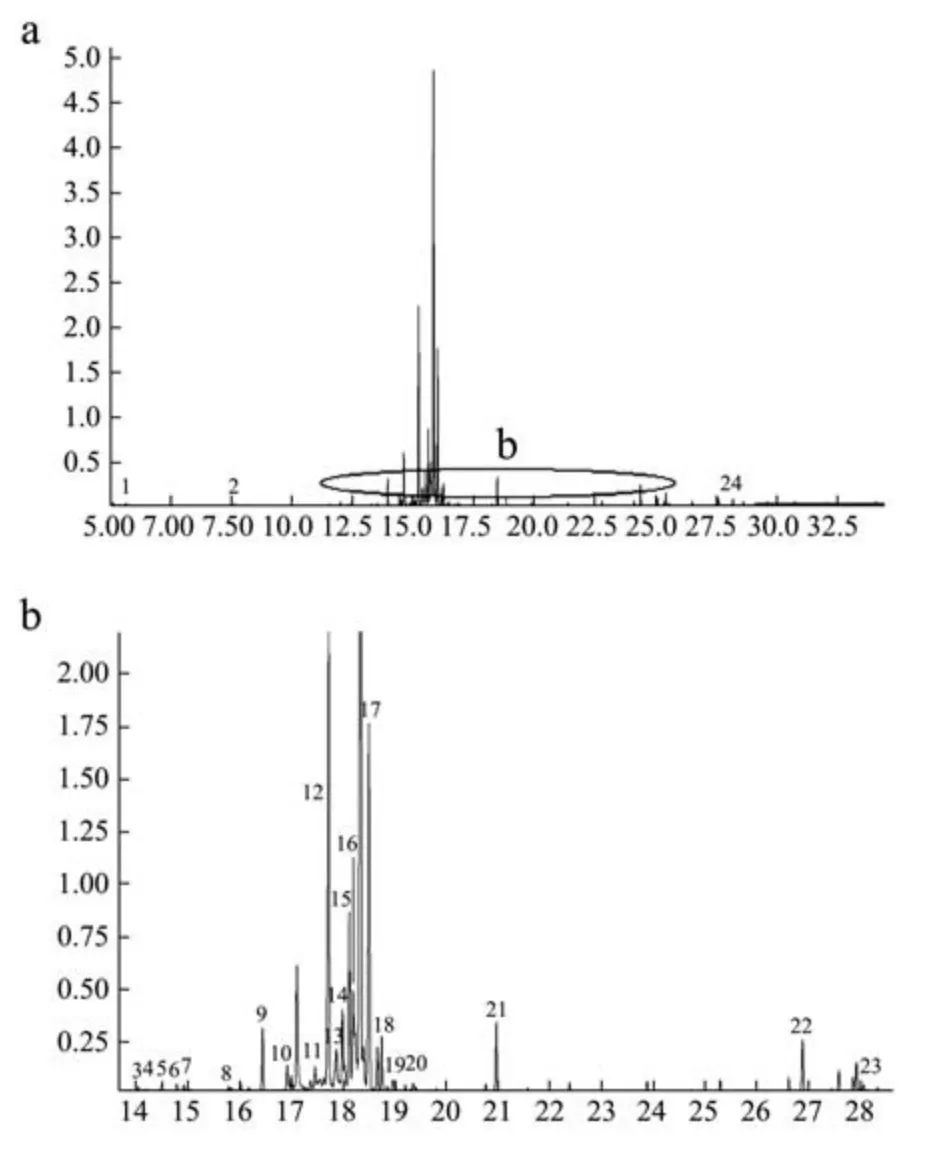
图3 引龙河大豆总离子流图Fig.3 Total ion flow diagram of YLH-soy samples
2.2 BALM-soy样品的差异代谢分析
相比较其他两个产区大豆样品,BALM-soy样品有21种差异代谢物(6种糖类,5种脂肪酸,4种醇类,2种酯类,1种氨基酸和3种中间体)(表2)。差异代谢物主要涉及氨基酸代谢(半胱氨酸和蛋氨酸代谢途径)、糖类代谢(半乳糖代谢途径、蔗糖和淀粉代谢、甲基半乳糖苷转运系统[31]、赤藓糖醇转运系统、果糖和甘露糖代谢)、脂质代谢(甘油脂质代谢、亚油酸代谢、脂肪酸生物合成和不饱和脂肪酸生物合成)及其他代谢途径(甾体生物合成)。糖酵解,脂肪酸的氧化合成和TCA循环之间存在一定的关系,而碳水化合物代谢,脂代谢会产生一些代谢产物参与上述过程,此地大豆样品产生的差异代谢物如D-阿洛酮糖(0.41%),D-塔罗糖(2.91%),蔗糖(0.61%)及甘油(0.63%)与其有关,北安龙门产区属中温带大陆性季风气候,降水较多且集中在夏季,适宜大豆的生长,夏季光照时间长,有利于进行光合作用,积累蔗糖,半乳糖(0.56%)等糖类,并通过半乳糖代谢途径等过程进行转化。该产地土壤为黑土,土壤中含有腐殖质层,肥力水平高,为作物提供养分,雨水与土体内盐基相遇,碳酸盐移出土体,土壤呈中性至微酸性,pH在6.0~8.5之间,有利于D-阿洛酮糖和D-塔罗糖的产生。饱和脂肪酸的碳链延长在线粒体进行,不饱和脂肪酸在微粒体中进行去饱和作用,充足的日照有利于植物进行氧化代谢,生成饱和脂肪酸包括甘油和十五烷酸(0.22%),以及不饱和脂肪酸包括8,11-十八碳二烯酸(0.45%),9,12-十八碳二烯酸(1.83%),9-十八碳二烯酸(0.74%)。

表2 BALM-soy样品的差异代谢物Table 2 Differential metabolites of BALM-soy samples
2.3 WS-soy样品的差异代谢分析
WS-soy样品有16种差异代谢物(5种脂肪酸,2种醇类,2种酯类,1种氨基酸和6种中间体)(表3)。差异代谢物主要涉及氨基酸代谢(精氨酸和脯氨酸代谢途径)、脂质代谢(苯丙氨酸代谢、脂肪酸生物合成、不饱和脂肪酸生物合成)及其他代谢途径(氮代谢途径和氰基氨基酸代谢途径[32])。尾山产地属寒温带大陆季风气候,夏季短促,气温较温带季风气候低,使其脂肪酸类产物不同,碳水化合物较少。其大豆样品的差异代谢物主要是一些酸类,酯类,可能是该大豆在脂肪酸生物合成、脂肪酸降解、花生四烯酸代谢过程中产生了6-十六碳烯酸(1.33%)、辛酸(0.46%)、花生酸(0.79%)和邻苯二甲酸(3.83%)。该产地土壤为黑钙土,其肥力不及黑土,但也有腐殖质层,含有丰富的氮素以及磷和钾,降水也比北安龙门少,有利于脯氨酸(5.47%)的积累,此外渗入土体的重力水流只能对钾、钠等一价盐离子进行充分淋溶,而钙、镁等二价盐离子只能部分淋溶,产生了不同的差异代谢物。

表3 WS-soy样品的差异代谢物Table 3 Differential metabolites of WS-soy samples
2.4 YLH-soy样品的差异代谢分析
YLH-soy样品有9种差异代谢产物(7种糖类和2种中间体)(见表4所示)。差异代谢物主要涉及糖类代谢(半乳糖代谢途径、戊糖磷酸代谢途径)及其他代谢途径(嘧啶代谢途径)。该样品产地与BALM-soy产地同属中温带大陆季风气候,其差异代谢物主要是糖类,而且与BALM-soy代谢产物中一些糖类不同,可能是因为碳水化合物代谢过程中如半乳糖代谢途径产生塔格糖(0.60%),戊糖磷酸途径产生核糖(14.62%),以及嘧啶代谢途径产生尿苷(0.24%)等。糖类的产生是由于播种时期不同,气温的影响导致光合作用程度不同。

表4 YLH-soy样品的差异代谢物Table 4 Differential metabolites of YLH-soy samples
2.5 未知化合物结构分析
根据质谱图中碎片离子峰的质荷比,推测6种未知结构代谢产物(见表5所示),其中C9H18O为(2S,3S)-2-丁基-3-丙基环氧乙烷,C23H24N4为1,8-二(4-硝基苯甲基)-3,6-二氮杂胺-9-酮,推测C6H9N3S为2-甲基-2,6-二氢-4H-噻吩并[3,4-c]吡唑-3-胺,推测C27H20O12为α-玉红霉素,推测为C13H32O4Si2为3,6,10,13-四氧合-2,14-二硅戊烷,2,2,14,14-四甲基硅烷;推测 C17H40O5Si2为3,7,11,15,18-五氧杂-2,19-二硅二十烷,2,2,19,19-四甲基硅烷。
表5 未知化合物结构列表Table 5 Unknown compound structure list
3 结论
对大豆中的代谢产物进行分离和鉴定,共检测到68种代谢产物,其中62种精确鉴定,包括22种糖类及其衍生物,14种脂肪酸及其衍生物,7种醇类,4种酯类,2种氨基酸和13种中间体,并推断出6种未知代谢产物结构,WS-soy样品4种,YLH-soy样品2种。通过对大豆样品的比较发现BALM-soy样品存在21种差异代谢产物,包括6种糖类,5种脂肪酸,4种醇类,2种酯类,1种氨基酸和3种中间体。WS-soy样品有16种差异代谢产物,包括5种脂肪酸,2种醇类,2种酯类,1种氨基酸和6种中间体。YLH-soy样品有9种差异代谢产物,包括7种糖类和2种中间体。通过KEGG数据库确定代谢产物的代谢途径,包括氨基酸代谢,碳水化合物代谢,脂质代谢等,BALM-soy样品不同代谢途径包括半胱氨酸和蛋氨酸代谢途径、蔗糖和淀粉代谢途径、甲基半乳糖苷转运系统、果糖和甘露糖代谢途径、赤藓糖醇运输系统,甘油代谢,亚油酸代谢和甾体生物合成。WS-soy样品的不同代谢途径为精氨酸和脯氨酸代谢途径,苯丙氨酸代谢途径、氰基氨基酸代谢途径和氮代谢途径。YLH-soy样品的不同代谢途径是戊糖磷酸代谢途径和嘧啶代谢途径。BALM-soy和YLH-soy两产地属中温带大陆性季风气候,有利于糖的积累,WS-soy产地属寒温带大陆性季风气候,有利于脂肪酸的积累。大豆样品产地的温度、降水、土壤等会导致代谢途径和代谢机制的差异。
