雨生红球藻高产虾青素的培养条件优化
2021-06-30孙双张婷方琰胡莎莎黄思琦叶其然兰利琼卿人韦
孙双,张婷,方琰,胡莎莎,黄思琦,叶其然,兰利琼,卿人韦
(四川大学生命科学学院,生物资源与生态环境教育部重点实验室,四川成都 610065)
微藻是一类光自养生物,固碳效率高、生长周期短,在适当的条件下,细胞内能够高水平积累具有独特价值的化合物,可供商业开发利用[1-3]。雨生红球藻(Haematococcus pluvialis)隶属于绿藻纲Chlorophyceae、团藻目Volvocales,在高光、缺氮等胁迫条件下可以大量积累虾青素,被认为是理想的天然虾青素生产者[4-8]。虾青素(Astaxanthin)(3,3’-二羟基-β,β’-胡萝卜素-4,4’-二酮)是一种类胡萝卜素[9],呈鲜红色,作为一种新型的生物材料,具有极强的抗氧化活性,在提高免疫力、延缓衰老、预防肿瘤及心血管疾病等方面有积极的作用[10-12]。研究表明,雨生红球藻在胁迫条件下大量积累虾青素,然而胁迫条件并不利于藻的营养生长[13]。这种生物量增加和虾青素积累不同步的矛盾制约着雨生红球藻的规模化生产的经济效益。因此,现今工业上成功的生产模式都采用两步培养法,即先进行雨生红球藻绿色营养细胞生长积累藻生物量,然后进行胁迫培养积累虾青素[14]。
雨生红球藻绿色营养生长时期的生物量影响着虾青素的总产量,培养基成分是影响雨生红球藻生长的重要因子,也是影响雨生红球藻培养及虾青素工业化生产的要素[15]。柳科欢等人,比较研究了不同培养基对雨生红球藻生物量的影响,但并没有针对筛选出的培养基进行进一步的优化,且她在培养过程中用了CO2通气培养以提高生物量,但通气培养需要高浓度CO2,且损耗较大,生产成本较高,在虾青素的批量生产上不占优势[14]。为此本文从5种不同的培养基中筛选出最适于雨生红球藻生长的培养基,在此基础上,选用醋酸钠和碳酸氢钠作为碳源,并对其进行浓度的优化,从而优化出最有利于雨生红球藻绿色细胞增殖的培养基,以提高生物量,旨在为雨生红球藻大规模培养提供基础数据。
由于雨生红球藻中虾青素在胁迫条件下积累明显,不同胁迫条件和胁迫程度对虾青素的积累效果会有较大差别[16]。为此,本文在利用优化培养基的基础上,采用单因素试验,中心点复合设计(CCD)响应面法以光照强度、初始pH和诱导时间为实验因素,以雨生红球藻在胁迫条件下虾青素产量为响应值,根据旋转中心组合设计原理,经Design Expert软件分析数据,采用三因素五水平的响应面法进行培养条件的优化,得到最有利于虾青素积累的胁迫条件,以期获得雨生红球藻的高虾青素产量,为雨生红球藻高效规模化生产提供理论和技术支撑。
1 材料与方法
1.1 材料与仪器
材料:雨生红球藻(Haematococcus pluvialis)HP1是四川大学生命科学学院藻类实验室长期保存的藻株。
仪器:pH测试仪器:成都特思特仪器有限公司;灭菌锅:上海申安立式压力蒸汽灭菌锅;TU-1810PC紫外分光光度计:北京普析通用仪器有限责任公司;光照强度测试仪:德国Testo 540照度计;25×16血球计数板;显微镜:重庆奥特光学仪器有限公司;数显恒温水浴锅:国华电器有限公司;小型台式离心机:Gene Company Limied基因有限公司。
1.2 实验方法
1.2.1 绿色生长阶段基本培养基的筛选与碳源及其浓度的优化
将接种好的培养液用保鲜袋密封,置于室内培养架上培养,初始接种量为2.00×104个/mL,培养温度为21±1 ℃,光照强度为30 µmol/m2·s,光照周期是12 h/12 h(光/暗),培养规模在250 mL三角瓶中盛装100 mL培养基。每天定时充分摇动三角瓶5次,每次摇动时随机调换三角瓶位置,尽可能使处理组的光照一致。每个试验做3瓶平行对照,每瓶每次取2个样测定参数。
1.2.1.1 基本培养基筛选选用五种培养基(BBM、OHM、改良MCM、配方A、BG11)
对本实验室来源的雨生红球藻HP1进行培养,通过比较雨生红球藻HP1在不同培养基中的细胞数,确定不同培养基对雨生红球藻绿色细胞生长的影响,筛选出最适于HP1生长的培养基。用细胞密度血球计数板法对上述所有培养条件下的雨生红球藻进行计数:每隔24 h分别取1mL藻液于显微镜下计数,每个样品计数三次,取平均值。
1.2.1.2 碳源浓度的优化
本研究在筛选出最优基本培养基的基础上,向培养基中补充浓度分别为(0.1 g/L、0.3 g/L、0.5 g/L、1.0 g/L、1.5 g/L、2.0 g/L)的有机碳源(NaAc)或无机碳源(NaHCO3),其他营养元素的用量和配比保持不变,研究碳源浓度对雨生红球藻生长的影响。
1.2.2 虾青素积累阶段胁迫条件研究
1.2.2.1 虾青素诱导单因素实验
(1)藻的处理:当藻细胞在上述正常培养条件下生长到对数生长期,离心(4000 r/min,10 min)收集藻液,用少量OHM培养液重悬藻体,将悬浮液分别转移至胁迫培养条件下进行培养,将胁迫培养体系设置为有机碳源培养基和无机碳源培养基2种形式,每个处理设3个重复。
(2)光照强度:采用(1)项下方法,考察光照强度对雨生红球藻虾青素产量的影响。分别在光照周期12 h/12 h(光/暗)、初始pH=7、诱导时间8 d,设置光照强度为75 µmol/m2·s、110 µmol/m2·s、145µmol/m2·s、180 µmol/m2·s、215 µmol/m2·s共5个梯度,来分析其最适光强。
(3)初始pH:采用a项下方法,考察初始pH对雨生红球藻虾青素产量的影响。分别在光照周期12 h/12 h(光/暗)、光照强度为145 µmol/m2·s、诱导时间8 d,设置初始pH为5、6、7、8、9、10共6个梯度,来分析其最适初始pH。
(4)诱导时间:采用a项下方法,考察诱导时间对雨生红球藻虾青素产量的影响。分别在光照周期12 h/12 h(光/暗)、初始pH=7、光照强度为145 µmol/m2·s,设置诱导时间为6、7、8、9、10、11、12 d,共7个处理,来分析其最适诱导时间。
1.2.2.2 响应面实验设计
在单因素试验的基础上,选取光照强度、初始pH和诱导时间三个因素作为响应变量,以雨生红球藻在胁迫条件下虾青素产量为响应值,考察各因素间的交互作用对雨生红球藻虾青素积累的影响[17-21]。利用Design Expert软件按照旋转中心组合设计(CCD)原理,通过响应面曲面分析进行培养条件的优化,得到最有利于虾青素积累的胁迫条件。试验设计因素与水平如表1所示。共20个实验点,其中14个为析因点,6个为零点。零点实验进行6次,做误差估计。
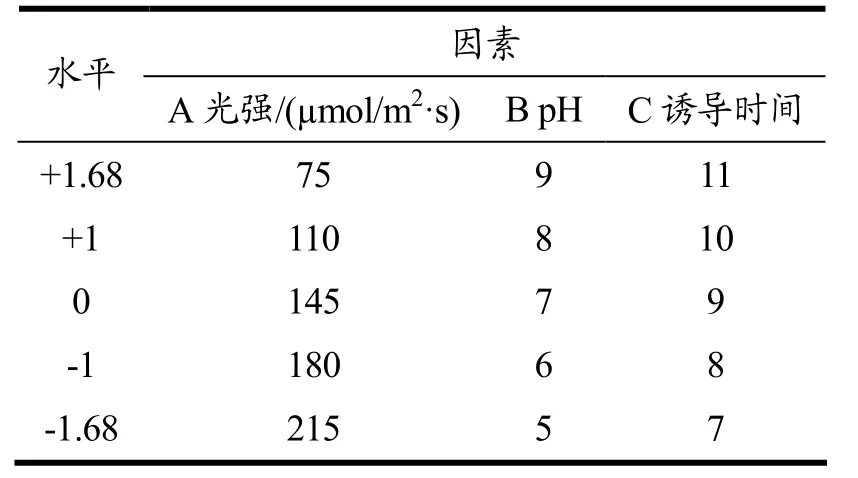
表1 响应面分析因素与水平表Table 1 Factors and levels of response surface analysis
1.2.2.3 虾青素含量测定
配制5%氢氧化钠:准确称取0.25 g NaOH加入双蒸水4.75 mL。取藻液5 mL,经3900 r/min离心15 min,收集沉淀,向沉淀中加入700 µL 5%氢氧化钠和300µL甲醇溶液,混匀,65 ℃水浴加热15 min除去样品中的叶绿素(间或进行摇匀样品),待加热后的样品冷却至室温,经7000 r/min离心3 min收集沉淀,再用双蒸水洗涤沉淀3次,向沉淀中加入1 mL DMSO,65 ℃水浴加热5 min,待冷样品却至室温,7000 r/min离心3 min收集上清液,沉淀用DMSO重复提取至提取液基本无色,合并收集的上清液并定容于5 mL[14]。
用分光光度计检测提取样品,DMSO为空白对照,检测波长是490 nm,虾青素含量由以下公式计算:
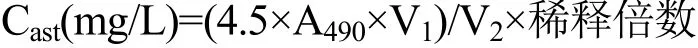
其中:A490:待测样品在波长490nm处吸光值;Cast:虾青素含量;V1:提取所得液体体积mL;V2:提取所用藻液体积mL。
1.3 数据处理
每组试验设置3组平行试验,用平均值±标准方差的形式表示试验结果,并用Excel 2016软件对结果进行统计学分析。采用GraphPad Prism 6软件处理对实验数据绘图,试验设计使用Design Expert软件进行CCD方法的响应面优化试验设计,并对数据进行相关线性拟合,通过拟合后线性关系制作预测结果等高线和响应曲面图。
2 结果与讨论
2.1 基本培养基筛选
王正方等[22]利用BG11培养基培养雨生红球藻,获得最大藻细胞浓度为1.70×105个/mL。Choi等[23]研究数据显示,OHM培养基培养雨生红球藻可获得藻细胞浓度2.10×105个/mL。本试验的培养条件下,HP1株系雨生红球藻在5种试验培养基中的生长情况如图1。藻细胞生物量从第5 d开始迅速增加,在培养结束期即第12 d时,HP1在培养基配方A及OHM中的生物量均能达到较高生物量分别3.14×105个/mL、2.66×105个/mL,其次是MCM,BG11、BBM培养基。对比前人研究可知,本实验培养条件下获得的生物量明显增加。由图1可知,配方A相较于OHM更利于雨红球藻绿色营养细胞的生长,可能与配方A中含有生长素、细胞分裂素等有机物有关,考虑到这些成分价格昂贵,综合考虑,本文在后续实验选择OHM培养基。
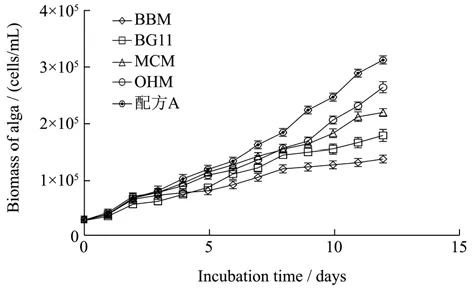
图1 不同培养基对雨生红球藻HP1生长的影响Fig.1 Effect of different media on the growth of Haematococcus pluvialis HP1
2.2 碳源浓度优化
以筛选出的OHM为基础培养基,比较有机碳源与无机碳源对雨生红球藻生长影响,并分别优化出最优浓度如图2。由图2a、2b可见在以不同浓度的有机碳源(NaAC)、无机碳源(NaHCO3)为碳源的培养基中其生物量都是从第5 d开始迅速增加,培养12 d后,在不同浓度的培养体系中的生物量出现明显差异,在有机碳源(NaAC)为碳源的培养基当碳源浓度为0.5 g/L时,藻生物量达到最大值,陈俊琳等[24]发现培养雨生红球藻最佳有机碳源浓度在0.5~1.0 g/L,与本研究结果相似。不同于陆开形等[25]指出适于雨生红球藻生长的NaHCO3浓度为0.2 g/L,此时获得的最大细胞密度为1.40×105个/mL,在本研究中,无机碳源(NaHCO3)为碳源的培养基当碳源浓度为0.5 g/L时,藻生物量达到最大值,获得的最大细胞密度为2.80×105个/mL,比较上述结果,在本研究条件下生物量有所提高。因此可知,在本实验条件下,有机碳源(NaAC)和无机碳源(NaHCO3)的最适浓度都为0.5 g/L,此浓度下,在培养结束时,其生物量分别为2.86×105个/mL、2.80×105个/mL。由图2可知,有机碳源较无机碳源组产量有所提高,这与有机碳源兼养培养条件下,不仅能够进行光合自养,也能利用有机碳源进行异养,同时我们也推测兼养培养改变了雨生红球藻的光合生理状态。
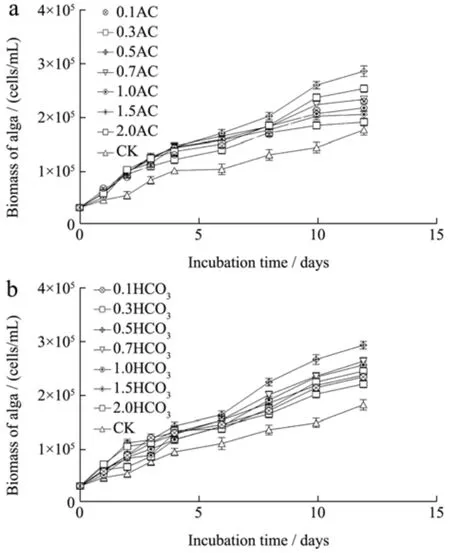
图2 不同碳源及其浓度对雨生红球藻HP1生长的影响Fig.2 The effect of different carbon sources and their concentrations on the growth of Haematococcus pluvialis HP1
2.3 虾青素诱导单因素实验结果
2.3.1 光照强度
由图3可知,光照强度低于145 µmol/m2·s时虾青素产量随光照强度的増高而增加,当光照强度达到145 µmol/m2·s时,虾青素积累含量达到最大,随后虾青素产量随光照强度増加而降低。这是因为高光照胁迫应激下,能使雨生红球藻中虾青素的合成量增高并保护光合色素,但当光照应激程度超过雨生红球藻抵抗范围,细胞就会受到损伤而降低虾青素的产量[26]。可见,提高光照强度有助于雨生红球藻的积累但并非越高越好。Jeon等[27]认为125~180 µmol/m2·s是雨生红球藻积累虾青素的最适光强。与本研究结果一致,在本研究中将光照强度设置在145 µmol/m2·s时,更有利于虾青素的积累,在以有机碳源(NaAC)和无机碳源(NaHCO3)为碳源的培养体系中,虾青素产量最高值分别为5.31 mg/L、4.24 mg/L。所以虾青素诱导最适光照强度为145 µmol/m2·s。
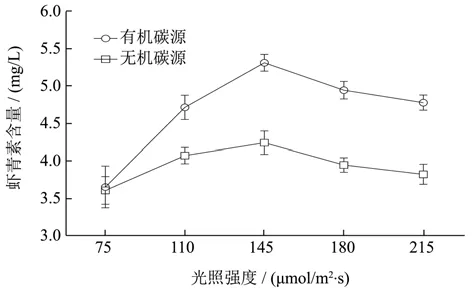
图3 光照强度对虾青素积累量的影响Fig.3 Effect of light intensity on astaxanthin accumulation
2.3.2 初始pH
从图4中可知,初始pH小于7时虾青素产量随pH升高而增加,当初始pH大于7后,虾青素产量随pH值升高下降明显。因此可知,初始pH过低或过高都会严重影响雨生红球藻虾青素的产量。沈渊等[28]认为雨生红球藻适宜初始pH值为中性至弱碱性,与本文结果相似。在本研究中将初始pH设置为7时,更有利于虾青素的积累。以有机碳源(NaAC)和无机碳源(NaHCO3)为碳源的培养体系中,初始pH为7虾青素产量最高,分别为5.30 mg/L、4.22 mg/L。所以虾青素诱导最适初始pH为7。
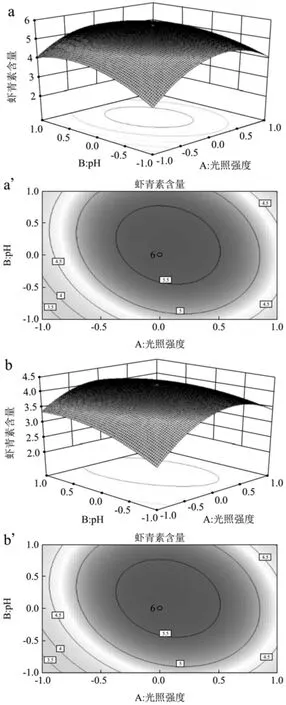
图4 光照强度和初始pH对虾青素含量的影响Fig.4 The influence of light intensity and pH on astaxanthin content
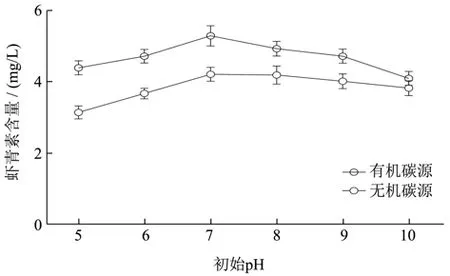
图4 初始pH对虾青素积累量的影响Fig.4 Effect of initial pH on astaxanthin accumulation
2.3.3 诱导时间
由图5可知,胁迫诱导时间低于9 d时虾青素产量随光照强度的增强而增加,在第9 d时,虾青素积累含量达到最大,超过9 d虾青素产量呈下降趋势,这是因为持续光照藻细胞开始死亡[26]。在本研究中将胁迫诱导时间设置在9 d时,更有利于虾青素的积累。在以有机碳源(NaAC)和无机碳源(NaHCO3)为碳源的培养体系中,虾青素产量最高值分别为5.35 mg/L、4.24 mg/L,所以虾青素胁迫诱导最适诱导时间为9 d。
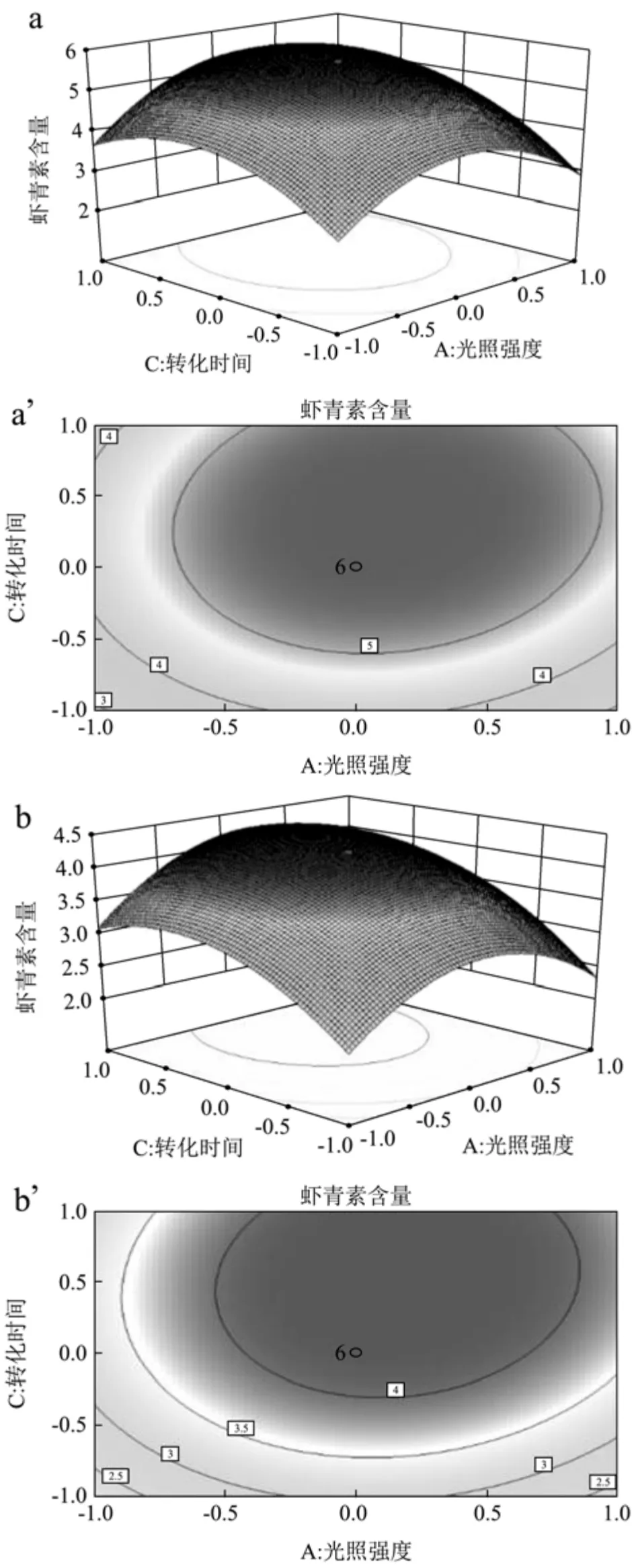
图5 光照强度和诱导时间对虾青素含量的影响Fig.5 The effect of light intensity and conversion time on astaxanthin content
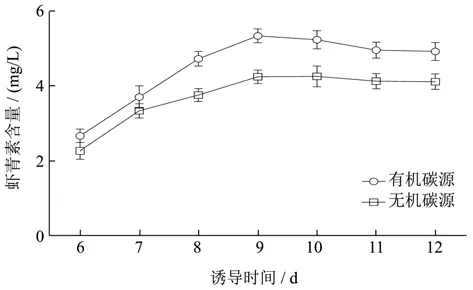
图5 诱导时间对虾青素积累量的影响Fig.5 Effect of induction time on astaxanthin accumulation
2.4 响应曲面分析
不同微藻积累虾青素最适光照强度和诱导时间存在差异[29]。本研究利用响应面分析法确定光照强度、诱导时间和初始pH三个因素的最优水平,每组设置3个重复,以雨生红球藻在胁迫条件下虾青素产量为响应值Y,利用Design Expert数据统计软件按照旋转中心组合设计原理,得到实验方案与结果,如表2用以估计试验误差。
利用Design-Expert软件对对表2数据进行回归分析,得到回归模型:
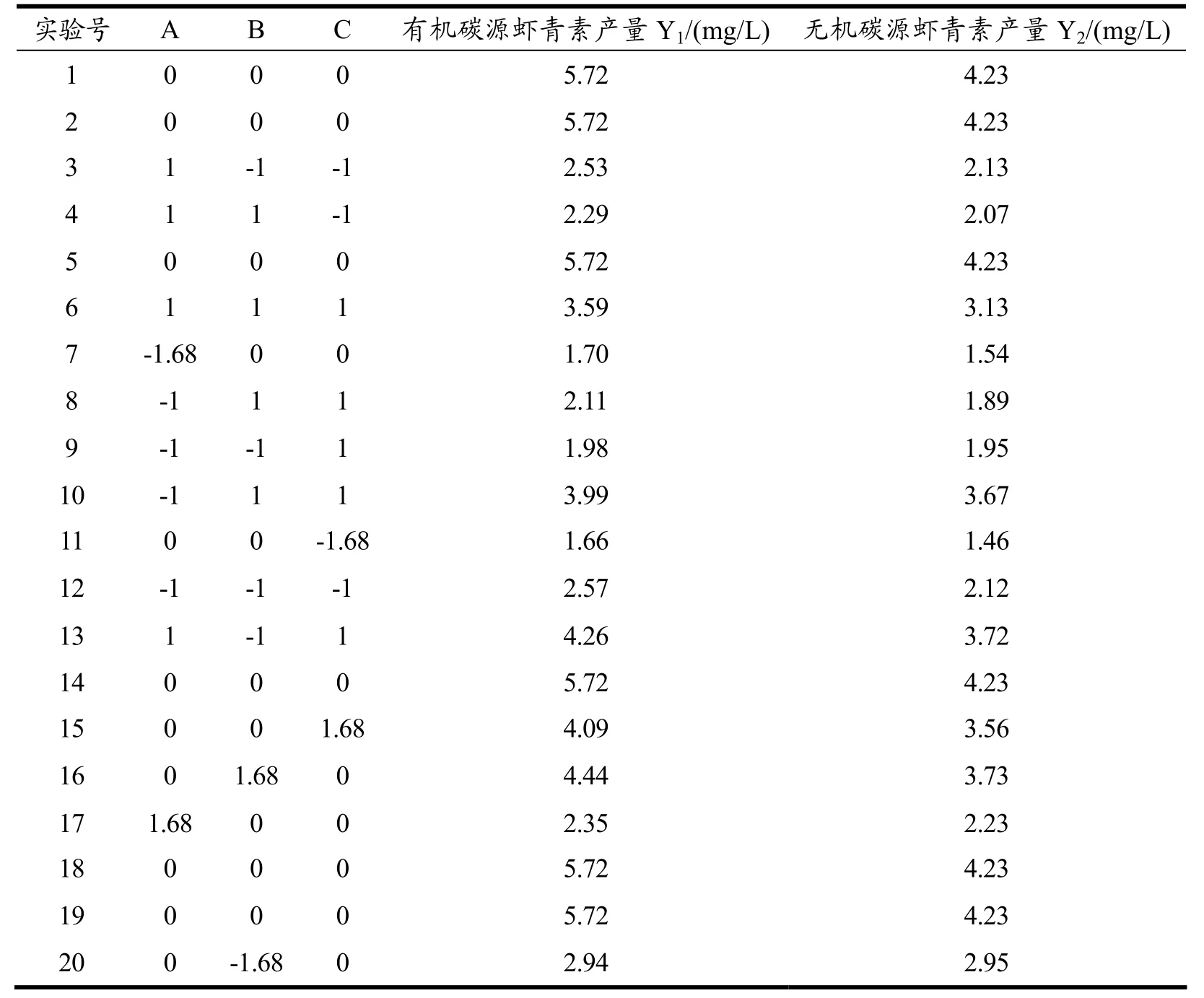
表2 旋转中心组合实验设计方案和响应值结果表Table 2 Rotating center combination experiment design scheme and response value result table
拟合二次回归方程(有机碳源培养基):
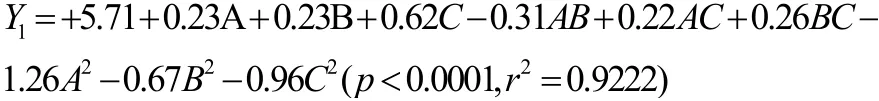
拟合二次回归方程(无机碳源培养基):
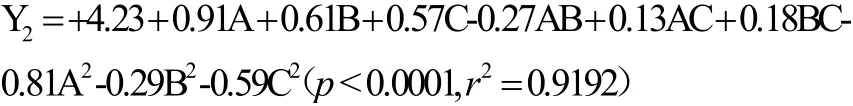
通过对该模型进行方差分析及模型可信度分析,结果见表3、表4。
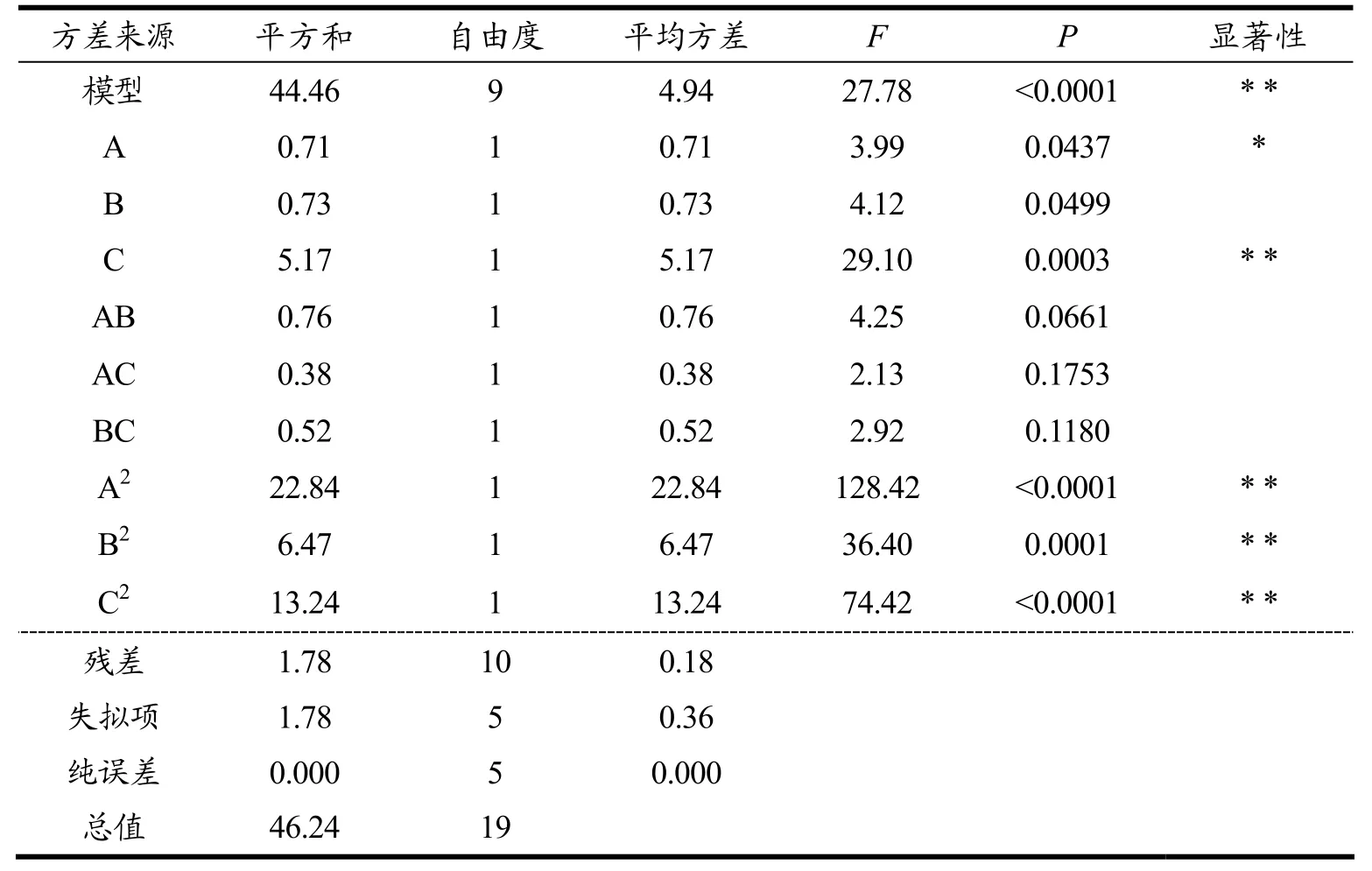
表3 响应面回归模型Y1 的方差分析表(有机碳源培养基)Table 3 ANOVA table of response surface regression model Y1 (organic carbon source medium)
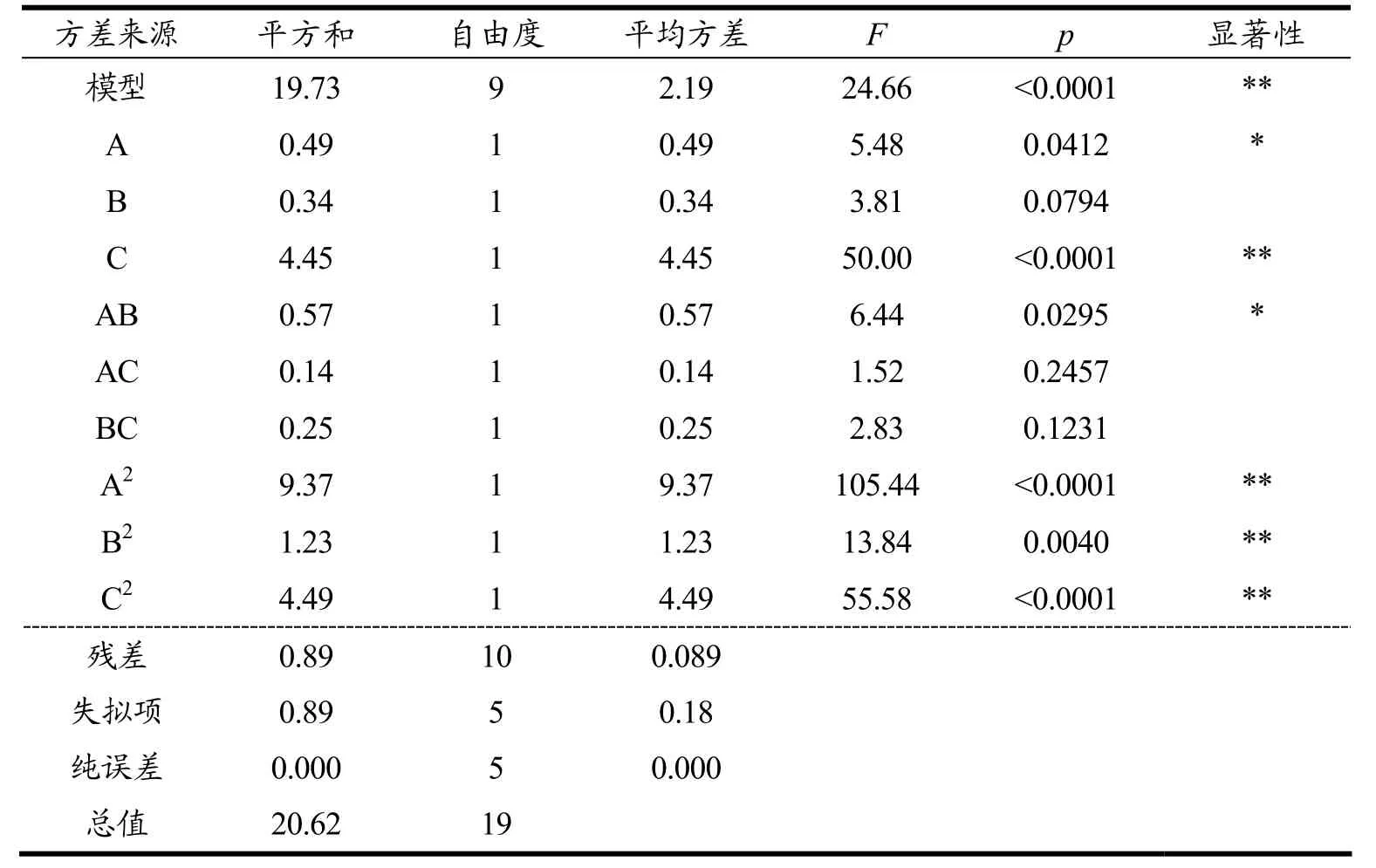
表4 响应面回归模型Y2 的方差分析表(无机碳源培养基)Table 4 ANOVA table of response surface regression model Y2 (inorganic carbon source medium)
由上述分析可知,两个回归模型p值都小于0.001,表明模型均显著。而从其失拟项来看均不显著,说明预测值与实验值之间有较好的相关性,提示回归方程的预测值和实验值误差较小,可以良好地预测虾青素产量。模型可信度分析,其中校正后的R2分别为0.9222、0.9192,说明模型可以解释90%以上的实验所得数据,实验精密度分别为13.226、12.406均大于4,是可取的,残差皆分布在一条直线上,进一步说明模型拟合优度较好,实验误差小,可用此模型来分析和预测结果。
在有机碳源培养基模型中一次项A为显著,B不显著,C为极显著。3种胁迫因素对雨生红球藻积累虾青素含量影响效果为C>A>B。二次项A2、B2、C2均高度显著,而交互项AB、AC、BC均有影响,但不显著,因此,可认为在以有机碳源(NaAC)为碳源的情况下3种胁迫因素对虾青素产生交互式影响较小。在无机碳源培养基的模型中一次项A为显著,B不显著,C为极显著。3种胁迫因素对雨生红球藻积累虾青素含量影响效果为C>A>B。二次项A2、B2、C2均高度显著,而交互项AB显著,AC、BC均有影响,但不显著,因此,可认为在以无机碳源(NaHCO3)为碳源的情况下3种胁迫因素对虾青素产生交互式影响较小。
从上述方差结果及模型可行度分析可知,模型可以较好地拟合3种不同胁迫因素对雨生红球藻高产虾青素的效果,为了更加体现研究具体数值较优胁迫效果,使用Design-Expert.V.8.0.6软件对该模型绘制响应曲面图,考察所拟合的响应曲面的形状,图4~6为回归方程预测的三个因素耦合影响下的响应面三维图及相应等高线图,可以直观表示试验因素的3个水平间与响应值的函数关系,获取试验设计中最优工艺参数。一般的,由等高线的形状可以判断各因素之间的交互作用是否显著:圆形表示不显著,椭圆形或马鞍形表示显著。
光照强度和初始pH对虾青素含量的影响如图4所示,a、a`表示以有机碳源(NaAC)为碳源的培养体系,b、b`表示以无机碳源(NaHCO3)为碳源的培养体系。从图中可知光照强度和初始pH交互作用对虾青素含量的影响,呈抛物线型关系,且均有一个极大值点。当前实验范围内,当初始pH不变,随着光照强度的升高,虾青素含量先升高后降低,当光照强度不变,随着初始pH的升高,虾青素含量先升高后降低。虾青素含量变化速率显示,光照强度的主效应略强于初始pH的效应,当光照强度达到145µmol/m2·s和初始pH为7条件下,相互交互效果最佳。
基于光照强度和诱导时间的响应面和等高线图如图5所示,a、a`表示以有机碳源(NaAC)为碳源的培养体系,b、b`表示以无机碳源(NaHCO3)为碳源的培养体系。光照强度和诱导时间交互作用对虾青素含量的影响,呈抛物线型关系,且均有一个极大值点。当前实验范围内,当诱导时间不变,随着光照强度的升高,虾青素含量先升高后缓慢降低,当光照不变,随着诱导时间的延长,虾青素含量先升高后降低。虾青素含量变化速率显示,诱导时间的主效应略强于光照强度效应,当光照强度达到145 µmol/m2·s和诱导时间为9 d条件下,相互交互效果最佳。
根据初始pH与诱导时间绘制的响应曲面和等高线图如图6所示,a、a`表示以有机碳源(NaAC)为碳源的培养体系,b、b`表示以无机碳源(NaHCO3)为碳源的培养体系。结果表明:初始pH和诱导时间交互作用对虾青素含量的影响,呈抛物线型关系,且均有一个极大值点。当前实验范围内,当初始pH不变,随着诱导时间的延长,虾青素含量先升高后降低,当诱导时间不变,随着初始pH的升高,虾青素含量先升高后降低。虾青素含量变化速率显示,诱导时间的主效应略强于初始pH效应,当诱导时间达到9 d和初始pH为7条件下,相互交互效果最佳。在三个测试独立变量,诱导时间是影响虾青素含量最重要因素,其次是光照强度和初始pH。
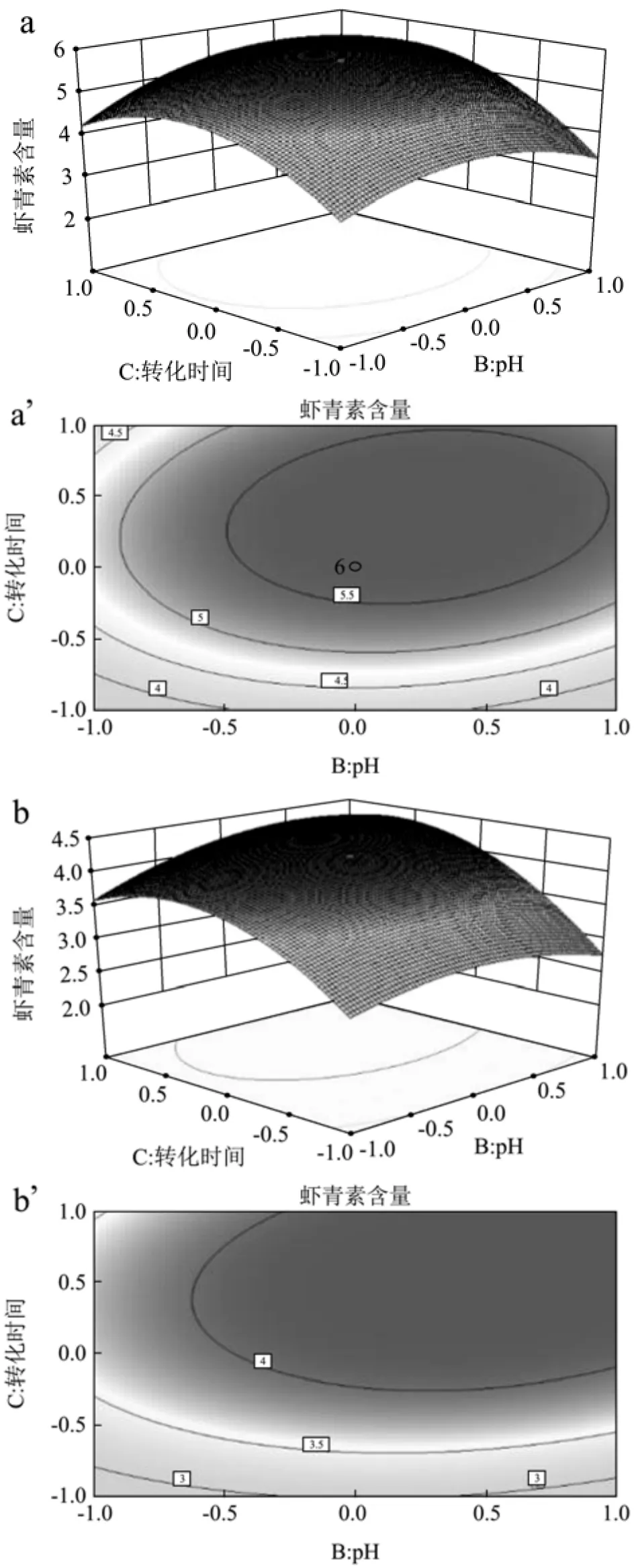
图6 初始pH和诱导时间对虾青素含量的影响Fig.6 Effect of pH and conversion time on astaxanthin content
三组图直观地反映了各个因素对响应值的影响,在三个测试独立变量,诱导时间是影响虾青素含量最重要的因素,其次是光照强度和初始pH。利用Design Expert软件进行实验结果优化,本实验主要目的在于优化雨生红球藻最适胁迫条件,通过分析回归方程存在稳定点,稳定点是极大值点,即光照强度为145µmol/m2·s、初始pH为7、诱导时间为9 d时,在以有机碳源(NaAC)和无机碳源(NaHCO3)为碳源的培养体系中,虾青素产量最大分别为5.74 mg/L、4.25 mg/L。
实验结果验证,为了检验模型预测的准确性,再次进行实验,采用上述中心组合试验得出的最优点进行3次平行实验,在以有机碳源(NaAC)和无机碳源(NaHCO3)为碳源的培养体系中,实际测得的平均实验虾青素含量值分别为5.81 mg/L、4.34 mg/L。与软件预测值无显著差别,但比优化前的最佳条件略有提高,证明应用响应曲面法能有效优化有利于雨生红球藻虾青素积累的培养条件。
3 结论
3.1 绿色生长阶段基本培养基的筛选与碳源及其浓度的优化
雨生红球藻绿色营养生长时期的生物量决定了虾青素的总产量,培养基成分是影响雨生红球藻生长的重要因子。从5种不同的培养基(BBM、OHM、改良MCM、配方A、BG11)中筛选出最适于雨生红球藻HP1生长的培养基为OHM培养基。针对筛选出的OHM培养基进行碳源浓度的优化,最适碳源浓度为0.5 g/L。在本实验条件下,有机碳源(NaAC)和无机碳源(NaHCO3)的最适浓度都为此浓度下,在培养结束时,其生物量分别为2.86×105个/mL、2.80×105个/mL,生物量得到较大提高,旨在为雨生红球藻大规模培养提供基础数据。
3.2 虾青素积累阶段胁迫条件研究
胁迫条件显著影响积累虾青素的含量。本文通过单因素实验研究影响虾青素积累的胁迫条件的主要因素,即光照强度、初始pH和诱导时间。利用Design Expert设计软件,采用旋转中心组合实验设计法考察了不同因素间的相互关系,建立优化雨生红球藻产虾青素最适胁迫条件的数学模型,根据回归分析可知其最适胁迫条件是:光照强度为145 µmol/m2·s、初始pH为7、诱导时间为9 d。在该条件下,以有机碳源(NaAC)和无机碳源(NaHCO3)为碳源的培养体系中,虾青素产量最大分别为5.74 mg/L、4.25 mg/L,与理论预测值基本吻合。本研究结果将为进一步提高雨生红球藻虾青素产量提供科学依据。
