茉莉酸甲酯对广藿香JA信号转导途径及倍半萜合成途径关键基因表达的影响
2021-06-29邓文静张宏意欧晓华卢昌华黄伟展严寒静
邓文静 张宏意 欧晓华 卢昌华 黄伟展 严寒静

摘 要: 分析外源性茉莉酸甲酯对广藿香JA信号转导途径关键基因JAZ2、MYC2、COI1及倍半萜合成途径关键基因PTS、FPPS、SQLE表达的影响,为深入研究茉莉酸甲酯调控广藿香JA信号转导途径及倍半萜合成途径的分子机制奠定基础。该文分别用0.10和0.25 mmol·L-1的MeJA喷施广藿香叶片,于处理后的0、2、6、12、24、48、72 h摘取叶片,运用实时荧光定量PCR对JAZ2、MYC2、COI1、PTS、FPPS、SQLE基因的表达量进行检测。 结果表明:0.10和0.25 mmol·L-1的MeJA对广藿香JA信号转导途径JAZ2、MYC2、COI1及倍半萜合成途径PTS、FPPS、SQLE基因表达均有不同程度的促进作用,其中对JAZ2基因表达影响最显著。0.10 mmol·L-1 MeJA溶液处理2 h时,JAZ2表达量上调13.52倍;0.25 mmol·L-1 MeJA溶液处理48 h时,JAZ2表达量上调19.09倍。JA信号转导途径关键基因JAZ2与倍半萜合成途径关键基因FPPS存在极显著正相关关系。综上结果表明MeJA溶液可诱导广藿香JAZ2、MYC2、COI1、PTS、FPPS、SQLE基因的表达,且不同浓度MeJA对基因表达有着不一样的影响;JAZ2是JA信号转导途径里响应MeJA诱导的主要基因,其可激活倍半萜合成途径FPPS基因的协同表达,进而影響广藿香醇等倍半萜合成。
关键词: 广藿香, 茉莉酸甲酯, JA信号转导途径, 倍半萜合成途径,基因表达
中图分类号: Q943
文献标识码: A
文章编号: 1000-3142(2021)04-0559-08
Abstract: The effects of exogenous methyl jasmonate (MeJA) on the key genes (PTS, FPPS, SQLE) expressions of Pogostemon cablin for the JA signal transduction and sesquiterpene synthesis pathways were studies. This would establish a foundation of the molecular mechanisms of MeJA in these two pathways. We treated the leaves of patchouli with 0.10 and 0.25 mmol·L-1 MeJA respectively and picked them at 0, 2, 6, 12, 24, 48, 72 h after treatments. We used qRT-PCR to detect the key genes expression of JAZ2, MYC2, COI1, PTS, FPPS, SQLE. The results were as follows: 0.10 and 0.25 mmol·L-1 MeJA promoted the expression of these genes in different degrees, with the most significant effect on JAZ2. The expression levels of JAZ2 increased 13.52-fold after 2 h at 0.10 mmol·L-1 MeJA treatment and 19.09-fold after 48 h at 0.25 mmol·L-1 MeJA treatment. There was a significant positive correlation between the key gene JAZ2 in JA signal transduction pathway and FPPS in sesquiterpene synthesis pathway. The above results demonstrated that MeJA promoted the expression of JAZ2, MYC2, COI1, PTS, FPPS, SQLE, and different concentrations of MeJA had different effects on gene expression. JAZ2 was the main gene induced by MeJA in JA signal transduction pathway, which can activate the co-expression of FPPS gene in sesquiterpene synthesis pathway, so as to affect the synthesis of sesquiterpene such as patchouli alcohol.
Key words: Pogostemon cablin, methyl jasmonate, JA signal transduction pathways, sesquiterpene synthesis pathways, gene expression
广藿香(Pogostemon cablin)为唇形科(Lamiaceae)刺蕊草属(Pogostemon)植物,以干燥地上部分入药,是我国传统中药之一,具有芳香化湿、开胃止呕、发表解暑的功效(国家药典委员会,2015)。广藿香中的挥发油主要为倍半萜类化合物,数量超过24种,其中以广藿香醇为主要成分(Deguerry et al., 2006)。广藿香醇具有保护胃肠道、抗病原微生物、抗氧化、抗肿瘤和调节免疫系统等作用(Ito et al., 2016; 徐雯,2017)。近年来,广藿香被用作药用提取物、食品添加剂和香料,广泛应用于药品、食品及日用化妆品行业。因此,研究广藿香醇合成的分子机制,从分子水平上调控广藿香倍半萜的代谢以提高广藿香醇含量,具有重要的实际意义。
茉莉酸甲酯(methyl jasmonate, MeJA)是一种新型植物激素,参与植物生长发育调节和防御反应,可有效调控药用植物中次生代谢产物的生物合成(Avanci et al., 2010)。茉莉酸(jasmonicacid, JA)信号转导途径是调控植物次生代谢产物合成的主要途径之一(Ryan, 1990),由多個基因或蛋白的协同作用完成。其中茉莉酸ZIM结构域蛋白(jasmonate ZIM domain-containing protein, JAZ)、冠菌素不敏感蛋白1(coronatine insensitive 1, COI1)、转录因子MYC2等是JA信号转导的核心模块,常通过彼此之间的相互作用来调控植物次生代谢产物的合成(Katsir et al., 2008; Browse, 2009; Chini et al., 2009)。
倍半萜是药用植物中常见的有效成分。研究倍半萜合成途径中关键酶基因的调控网络,对调控挥发性萜类合成具有重要价值。其中倍半萜合酶基因角鲨烯单加氧酶(squalene monooxygenase, SQLE)位于倍半萜类化合物骨架合成的上游途径,能促进倍半萜物质的合成(王焕,2015)。法尼基焦磷酸合酶(farnesyl diphosphate synthase, FPPS)是合成倍半萜的前体法尼基焦磷酸(FPP)的关键酶。倍半萜合酶(terpene synthase, TPS)如广藿香醇合酶(patchoulol synthase, PTS)能进一步催化FPP生成广藿香醇等倍半萜类化合物(Frister et al., 2015)。
前人研究表明,MeJA可通过JA信号转导开启一系列萜类合成途径相关基因的协同表达,从而在转录水平上影响植物的萜类代谢,增加萜类化合物的积累(Xu et al., 2004; Suttipanta et al., 2011;何雪莹,2016)。目前,对MeJA处理广藿香后JA信号转导途径及倍半萜合成途径相关性的研究尚未见报道,而进一步研究其分子机制对提高广藿香倍半萜类化合物的合成与积累具有重要价值。因此,本实验用不同浓度MeJA处理广藿香,运用实时荧光定量PCR(qRT-PCR)检测JAZ2、MYC2、COI1、PTS、FPPS、SQLE基因的表达量,旨在了解MeJA对广藿香JA信号转导途径和倍半萜合成途径关键基因表达的影响,挖掘受MeJA调控的基因,为深入研究广藿香JA信号转导途径及倍半萜合成途径的分子机制奠定基础。
1 材料与方法
1.1 材料
选择广东省四会市广藿香植株,将扦插苗移栽至广东药科大学中药学院种植10个月,株高约90 cm。经广东药科大学中药学院严寒静教授鉴定为唇形科刺蕊草属植物广藿香(Pogostemon cablin)。
1.2 用MeJA处理广藿香植株
选取长势相近且良好的广藿香16株,随机分为两组,分别是实验组和对照组,设3个生物学重复。以1 mL无水乙醇为溶剂,配制0.10 mmol·L-1 MeJA溶液,用小喷瓶均匀喷施在广藿香叶片表面,直至水滴滴落,立即用透明塑料膜将植株覆盖,1.5 h后移除塑料膜。分别于处理后的0、2、6、12、24、48、72 h摘取叶片,用锡纸包裹放入液氮中速冻0.5 h后,放入-80 ℃冰箱保存,用于总RNA提取。以1 mL无水乙醇按照同倍数稀释后喷施于广藿香为对照组。
0.25 mmol·L-1 MeJA溶液处理方法同上。
1.3 广藿香总RNA提取及cDNA第一链合成
使用TRI pure Reagent和RNA prep Pure Plant试剂盒,按照说明书提取广藿香总RNA,用1%琼脂糖凝胶电泳检测其完整性,超微量紫外分光光度计UV2450测定其浓度和纯度,将RNA放入-80 ℃冰箱保存。从冰箱取出RNA,测定其浓度和纯度,计算用于反转录的RNA量,使用Evo M-MLV RT For PCR试剂盒按说明书进行反转录,获得cDNA第一链。
1.4 基因表达量的测定
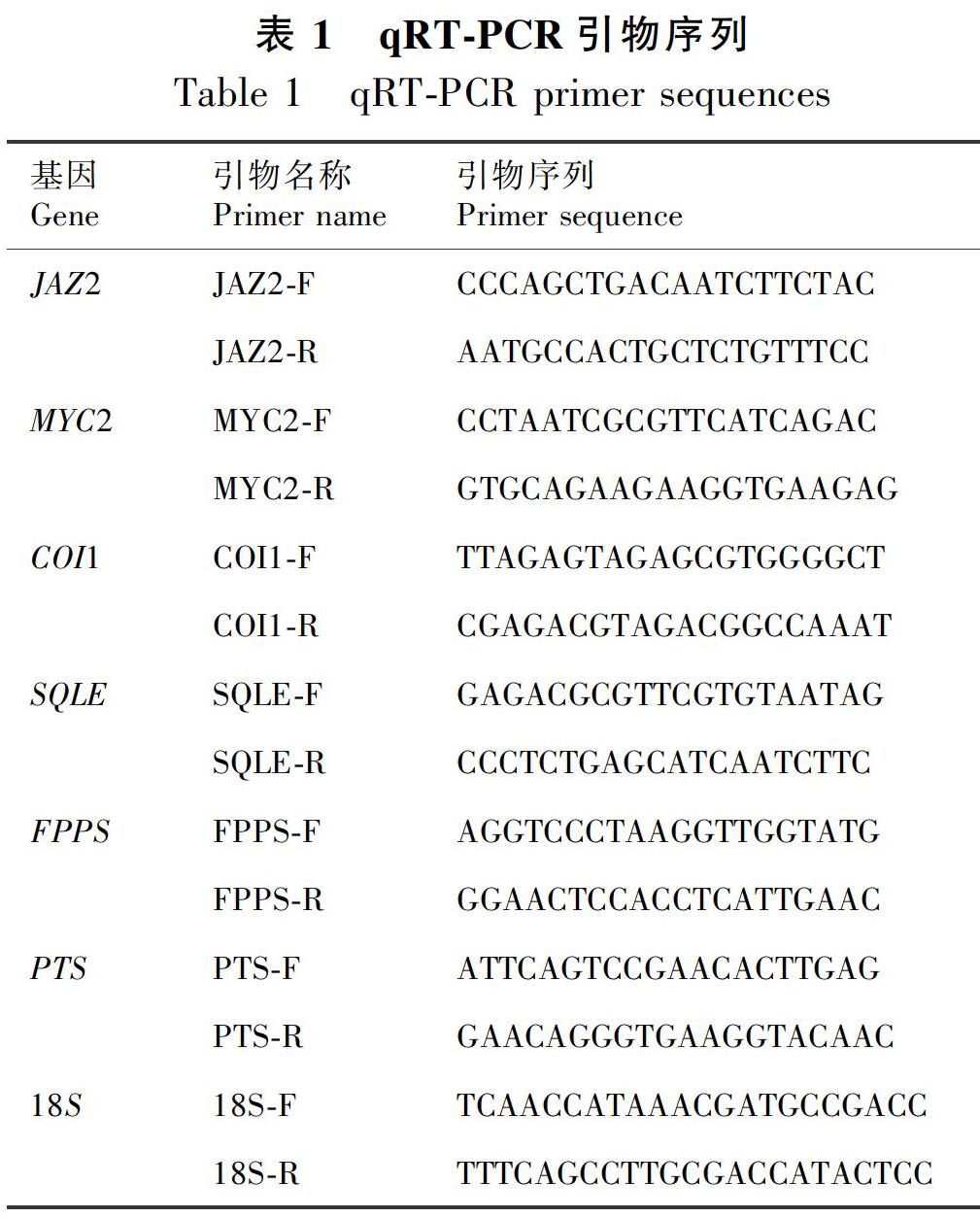
根据本课题组广藿香转录组测序得到的JAZ2、MYC2、COI1、SQLE、FPPS基因序列及NCBI公布的PTS基因序列,用CmSuite8软件设计qRT-PCR引物(表1)。以18S rRNA为内参基因,18S引物同见表1(刘璐等,2016)。
使用SYBR Green Premix Pro Taq HS qPCR试剂盒,按照说明书配制20 μL反应体系:SYBR Green Premix Pro Taq HS Premix 10 μL,cDNA 1.5 μL,Primer F 0.4 μL,Primer R 0.4μL,RNase free water 7.7 μL。qRT-PCR(Bio-Rad Laboratories,Inc)反应程序:预变性95 ℃、30 s,1个循环;变性95 ℃、5 s,退火及延伸60 ℃、30 s,40个循环。空白对照用水代替cDNA模板,每个样品设三个技术重复,复孔间Ct值的STD<0.2。
1.5 数据分析
采用2-ΔΔCt法计算基因相对表达量(Livak & Schmittgen, 2001)。ΔCt处理= Ct处理-Ct内参(处理);ΔCt对照 = Ct对照-Ct内参(对照);ΔΔCt=ΔCt处理-ΔCt对照;2-ΔΔCt即基因的相对表达量。运用SPSS分析软件,用独立样本T检验对数据进行差异显著性分析;用Pearson法对JA信号转导途径和倍半萜合成途径中的关键基因进行相关性分析。
2 结果与分析
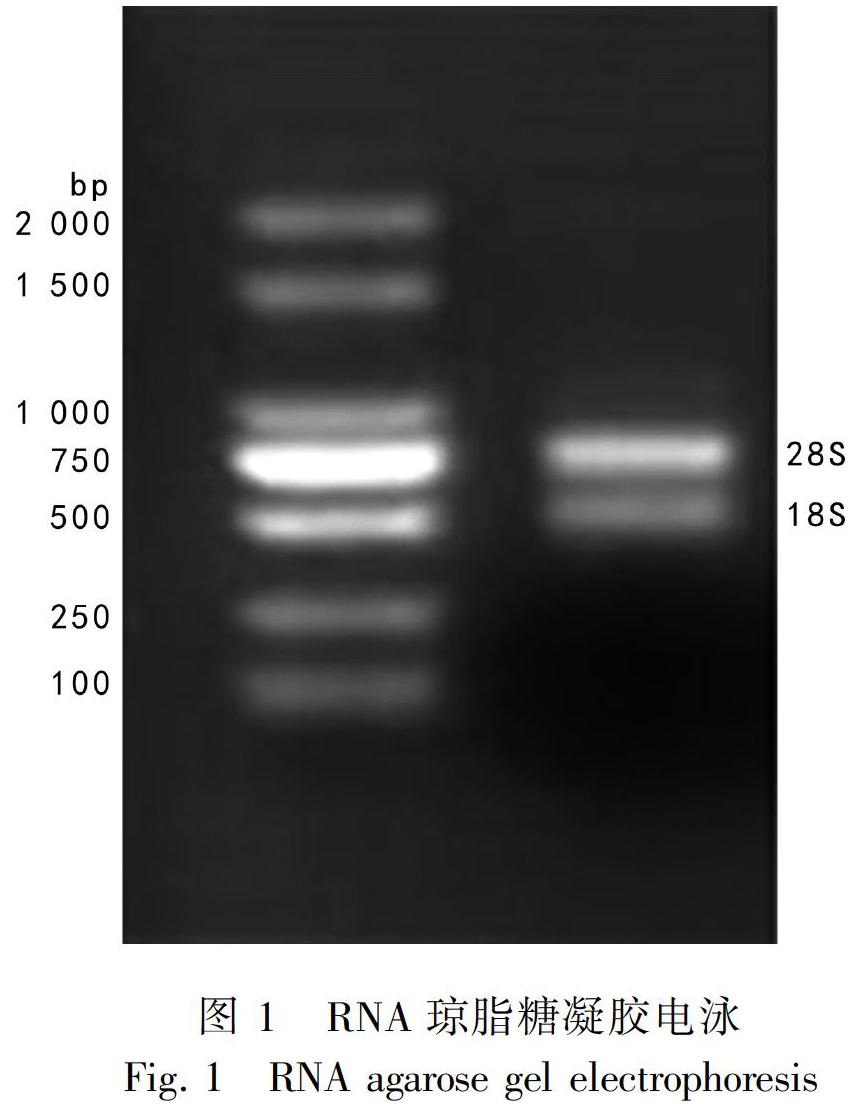
2.1 广藿香总RNA的质量检测
提取的广藿香总RNA,用1%琼脂糖凝胶电泳和紫外分光光度计检测其质量。电泳图显示18S、28S条带清晰分明且28S条带的亮度大致为18S条带的两倍(图1),表明RNA完整性良好;紫外分光光度计检测结果显示,OD260/OD280在1.8~2.1之间,表明RNA纯度较高。RNA质量较好,满足后续实验需要。
2.2 MeJA處理对广藿香基因表达量的影响
2.2.1 MeJA对广藿香JA信号转导途径关键基因JAZ2、MYC2、COI1表达的影响
JAZ2在0.10 mmol·L-1 MeJA溶液处理后2、6、12、24、48、72 h表达变化显著,其表达量与对照组相比分别上调13.52、4.54、4.15、9.27、9.10、3.23倍,差异达极显著和显著水平;JAZ2在0.25 mmol·L-1 MeJA溶液处理后24、48、72 h,其表达量分别上调9.69、19.09、3.37倍,差异达极显著和显著水平(图2:A)。MYC2在0.10 mmol·L-1 MeJA溶液处理后2、6、48、72 h,其表达量与对照组相比分别上调3.49、2.47、3.23、2.69倍,差异达极显著水平;MYC2在0.25 mmol·L-1 MeJA溶液处理后24、48、72 h,其表达量分别上调2.18、2.19、2.55倍,差异达显著水平(图2:B)。两种不同浓度MeJA溶液处理后,COI1的表达量变化不大(图2:C)。由此可知,0.10 mmol·L-1 MeJA溶液可在处理初期促进广藿香JAZ2和MYC2的表达,而用0.25 mmol·L-1 MeJA溶液诱导后基因响应较慢,直到24 h表达量才开始上调。其中JAZ2表达量上调最显著,而对COI1的表达影响不大。
2.2.2 MeJA对广藿香倍半萜合成途径关键基因PTS、FPPS、SQLE表达的影响 SQLE在0.10 mmol·L-1 MeJA溶液处理后2、48、72 h表达变化明显,其表达量与对照组相比分别上调1.64、2.53、1.76倍,差异达显著水平;SQLE在0.25 mmol·L-1 MeJA溶液处理后2、6 h表达量分别下调73%、63%,48 h表达量上调2.37倍,差异达显著水平(图2:D)。PTS在0.10 mmol·L-1 MeJA溶液处理后6、48、72 h表达变化明显,其表达量与对照组相比分别上调2.65、4.81、2.55倍,差异达极显著和显著水平;PTS在0.25 mmol·L-1 MeJA溶液处理后12、48、72 h,其表达量与对照组相比分别上调2.67、4.88、2.23倍,差异达极显著和显著水平(图2:E)。FPPS在0.10 mmol·L-1 MeJA溶液处理后48、72 h,表达量与对照组相比分别上调2.53、1.86倍,差异达显著水平;FPPS在0.25 mmol·L-1 MeJA溶液处理后48 h,表达量与对照组相比上调2.20倍,差异达显著水平(图2:F)。由此可知,在0.10 mmol·L-1 MeJA溶液处理初期,SQLE表达量上调,而在0.25 mmol·L-1 MeJA溶液处理初期,SQLE表达量则下降。PTS和FPPS均在MeJA溶液处理后的48 h上调表达明显。
2.3 相关性分析
2.3.1 0.10 mmol·L-1 MeJA处理后广藿香JA信号转导途径及倍半萜合成途径关键基因表达的相关性分析 从表2可以看出,0.10 mmol·L-1 MeJA诱导后,PTS与SQLE、FPPS与SQLE、PTS与FPPS均存在极显著正相关关系。
2.3.2 0.25 mmol·L-1 MeJA处理后广藿香JA信号转导途径及倍半萜合成途径关键基因表达的相关性分析 从表3可以看出,0.25 mmol·L-1 MeJA诱导后,PTS与SQLE、FPPS与SQLE、PTS与FPPS均存在显著正相关关系;JA信号转导途径关键基因JAZ2与倍半萜合成途径关键基因FPPS存在极显著正相关关系,相关系数r达到0.914。
3 讨论与结论
在植物中,茉莉酸甲酯的作用与植物激素发挥的作用相似,可通过信号转导途径有效调节植物的生长发育、应激反应以及代谢产物 (Devoto &Turner, 2003; 蒋科技等,2010)。通过研究植物JA信号转导途径和倍半萜合成途径,挖掘受MeJA调控的基因是进一步研究两个途径分子机制的关键。本研究结果发现,0.10和0.25 mmol·L-1的MeJA喷施广藿香,JA信号转导途径的JAZ2、MYC2、COI1及倍半萜合成途径的PTS、FPPS、SQLE基因表达量均有不同程度的上调,其中JAZ2表达量上调极显著。这与已报道的丹参JAZs基因(裴天林,2019)、丹参SmMYC2基因(周阳云,2015)、青蒿JAZ和COI1基因(陈俞裴,2017)、广藿香FPPS基因(Tang et al., 2019)、菊花TPS基因(王威姣,2020)经MeJA处理后上调表达的结果类似。本研究结果表明广藿香JAZ2、MYC2、COI1、PTS、FPPS、SQLE基因在转录水平上响应了MeJA的诱导,关于进一步的响应调节机制仍需深入研究。
不同浓度MeJA的应用对基因表达量和表达趋势的影响是不一样。本研究中,0.10 mmol·L-1MeJA溶液可在处理初期促进广藿香JAZ2、MYC2和SQLE的表达,而在0.25 mmol·L-1 MeJA溶液诱导初期,基因表达量没有明显上调,甚至出现抑制基因表达的现象。梁晓薇等(2017)研究发现,0.02和0.05 mmol·L-1的低浓度MeJA在处理初期能促进甘草酸相关合成途径酶基因表达,但较高浓度的MeJA(0.10 mmol·L-1)在处理初期没有诱导相关基因表达。笔者推测MeJA浓度过高会抑制基因的表达,随着处理时间的延长,植物体内MeJA降解到合适的浓度,进而促进基因的表达。MeJA浓度的高低是一个相对值,不同植物不同品种或者是同种植物的不同基因都有着不同的适宜诱导浓度。
用Pearson法分析广藿香JA信号转导途径与倍半萜合成途径关键基因的相关性,可知0.25 mmol·L-1 MeJA溶液诱导后,广藿香JA信号转导途径JAZ2与倍半萜合成途径FPPS基因存在极显著正相关关系,相关系数r高达0.914,推测外源性茉莉酸甲酯可通过广藿香JA信号转导途径JAZ2基因激活倍半萜合成途径FPPS基因的协同表达,进而调控广藿香倍半萜类合成,这与前人研究发现MeJA可通过JA信号转导开启一系列萜类合成途径相关基因的协同表达,从而在转录水平上影响植物的萜类合成的结果相符(Xu et al., 2004; Suttipanta et al., 2011; 何雪莹,2016);而低浓度MeJA溶液诱导后,两个途径关键基因间不存在极显著正相关关系。由于植物基因调控网络具有复杂性,推测只有当MeJA溶液达到一定浓度时,广藿香JA信号转导途径关键基因才能开启倍半萜合成途径相关基因的协同表达。此外,0.10 mmol·L-1 MeJA诱导后,倍半萜类合成骨架的上游基因SQLE与广藿香醇合成途径的下游基因PTS、FPPS存在极显著性正相关关系,且0.25 mmol·L-1 MeJA诱导也具有类似的正向调节效果,推测MeJA诱导后倍半萜类合成骨架的上游基因能够影响广藿香醇合成途径下游基因的表达。下游基因PTS和FPPS在两种浓度MeJA诱导下分别存在极显著和显著正相关关系,表达量均在48 h达到最大值,FPPS能够催化异戊烯基焦磷酸(IPP)和二甲基烯丙基焦磷酸(DMAPP)生成法尼基焦磷酸(FPP)等前体物质,而PTS则可以催化FPP生成广藿香醇等倍半萜类化合物(Frister et al., 2015),推测MeJA诱导48 h后广藿香醇含量会有一定程度的增加。
经外源MeJA处理后,基因表达量在一定时间内上调,随着时间的延长会逐渐下调至处理前水平(魏洁书等,2013;梁晓薇等,2017)。本研究中,用两种浓度MeJA溶液处理广藿香,JAZ2、SQLE、PTS、FPPS基因表达量均在48 h达到最大值,MYC2和COI1基因表达量分别在2 h和12 h达到最大值,但72 h时各个基因的表达均呈现逐渐回落的趋势,说明基因表达受MeJA的调控是激发式的,随着时间的延长最终会恢复至正常水平。综上所述,MeJA溶液可诱导广藿香JAZ2、MYC2、COI1、PTS、FPPS、SQLE基因的表达,且不同浓度MeJA对基因表达有着不一样的影响;JAZ2是JA信号转导途径里响应MeJA诱导的主要基因,其可激活倍半萜合成途径FPPS基因的协同表达,进而影响广藿香醇等倍半萜合成。
參考文献:
AVANCI NC, LUCHE DD, GOLDMAN GH, et al., 2010.Jasmonates are phytohormones with multiple functions, including plant defense and reproduction[J]. Genet Mol Res, 9(1): 484-505.
BROWSE J, 2009. Jasmonate passes muster: A receptor and targets for the defense hormone[J]. Ann Rev Plant Biol, 60: 183-205.
CHEN YP, 2017. Functional verification of the jasmonic acid receptor gene AaCOI1 in Artemisia annua L.[D]. Chongqing: Southwest University.[陈俞裴, 2017. 青蒿茉莉酸受体AaCOI1的功能研究[D]. 重庆: 西南大学.]
CHINI A, BOTER M, SOLANO R, 2009. Plant oxylipins: COI1/JAZs/MYC2 as the core jasmonic acid-signalling module[J]. Febs J, 276(17): 4682-4692.
DEGUERRY F, PASTORE L, WU S, et al., 2006. The diverse sesquiterpene profile of patchouli, Pogostemon cablin, is correlated with a limited number of sesquiterpene synthases[J]. Arch Biochem Biophys, 454(2): 123-136.
DEVOTO A, TURNER JG, 2003. Regulation of jasmonate-mediated plant responses in Arabidopsis[J]. Ann Bot, 92(3): 329-337.
FRISTER T, HARTWIG S, ALEMDAR S, et al., 2015. Characterisation of a recombinant patchoulol synthase variant for biocatalytic production of terpenes[J]. Appl Biochem Biotechnol, 176(8): 2185-2201.
HE XY, 2016. RNA sequencing on Amomum villosum Lour.-induced by MeJA identifies the genes of JA signal transduction and transcription factors involved in terpene biosynthesis[D]. Guangzhou: Guangzhou University of Chinese Medicine.[何雪莹, 2016. 基于RNA-Seq的阳春砂JA信号转导及萜类合成相关转录因子的研究[D]. 广州: 广州中医药大学.]
ITO K, AKAHOSHI Y, ITO M, et al., 2016. Sedative effects of inhaled essential oil components of traditional fragrance Pogostemon cablin leaves and their structure-activity relationships[J]. J Tradit Complement Med, 6(2): 140-145.
JIANG KJ, PI Y, HOU R, et al., 2010. Jasmonate biosynthetic pathway: Its physiological role and potential application in plant secondary metabolic engineering[J]. Chin Bull Bot, 45(2): 137-148.[蒋科技, 皮妍, 侯嵘, 等, 2010. 植物内源茉莉酸类物质的生物合成途径及其生物学意义[J]. 植物学报, 45(2): 137-148.]
KATSIR L, CHUNG HS, KOO AJ, et al., 2008. Jasmonate signaling: A conserved mechanism of hormone sensing[J]. Curr Opin Plant Biol, 11(4): 428-435.
LIANG XW, YANG Q, LI D, et al., 2017. Regulation of methyl jasmonate on secondary metabolism of Glycyrrhiza uralensis root[J]. Guangdong Agric Sci, 44(6): 57-62.[梁晓薇, 杨全, 李丹, 等, 2017. 茉莉酸甲酯对甘草根次生代谢的调控[J]. 广东农业科学, 44(6): 57-62.]
LIU L, WU YG, YU J, et al., 2016. Expression analysis of PTS gene of Pogostemon cablin at different time points[J]. J Trop Biol, 7(1): 89-91.[刘璐, 吴友根, 于靖, 等, 2016. 广藿香中PTS基因不同时间点的表达分析[J]. 热带生物学报, 7(1): 89-91.]
LIVAK KJ, SCHMITTGEN TD, 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method[J]. Methods, 25(4): 402-408.
National Pharmacopoeia Commission, 2015. Pharmacopoeia of the Peoples Republic of China (Part 1)[S]. Beijing: China Medical Science and Technology Press: 66.[国家药典委员会, 2015. 中华人民共和国药典(第一部)[S]. 北京: 中国医药科技出版社: 66.]
PEI TL, 2019. The function of SmJAZ in regulating the biosynthesis of salvianolic acids and tanshinones in Salvia miltiorrhiza[D]. Yangling: Northwest A & F University.[裴天林, 2019. SmJAZ基因在调控丹参酮类和酚酸类物质合成中的功能研究[D]. 杨凌: 西北农林科技大学.]
RYAN CA, 1990. Protease inhibitors in plants: genes for improving defenses against insects and pathogens[J]. Ann Rev Phytopathol, 28(1): 425-449.
SUTTIPANTA N, PATTANAIK S, KULSHRESTHA M, et al., 2011. The transcription factor CrWRKY1 positively regulates the terpenoid indole alkaloid biosynthesis in Catharanthus roseus[J]. Plant Physiol, 157(4): 2081-2093.
TANG Y, ZHONG L, WANG X, et al., 2019. Molecular identification and expression of sesquiterpene pathway genes responsible for patchoulol biosynthesis and regulation in Pogostemon cablin[J]. Bot Stud, 60(1): 11.
WANG H, 2015. Research on volatile terpenoids and transcriptome changes of MeJA-induced Amomum villosum lour[D]. Guangzhou: Guangzhou University of Chinese Medicine.[王煥, 2015. MeJA影响阳春砂挥发性萜类和转录组变化的研究[D]. 广州: 广州中医药大学.]
WANG WJ, LI F, ZHANG WW, et al., 2020. Cloning and expression characteristics of CmTPS1like gene in Chrysanthemum morifolium[J]. J Nanjing Agric Univ, 43(1): 58-64.[王威姣, 李菲, 张皖皖, 等, 2020. 菊花CmTPS1like基因的克隆及表达特性[J]. 南京农业大学学报, 43(1): 58-64.]
WEI JS, YANG JF, LING M, et al., 2013. Regulatory effect of methyl jasmonate on HMGR, DXR and DXS genes expression in Amomum villosum Lour.[J]. J Guangzhou Univ Tradit Chin Med, 30(1): 88-92.[魏洁书, 杨锦芬, 凌敏, 等, 2013. 茉莉酸甲酯调控阳春砂HMGR、DXR和DXS基因表达[J]. 广州中医药大学学报, 30(1): 88-92.]
XU W, WU YQ, DING HR, et al., 2017. Research progress on pharmacological effects and mechanism of herba pogostemonis[J]. Shanghai J Tradit Chin Med, 51(10): 103-106.[徐雯, 吴艳清, 丁浩然, 等, 2017. 广藿香的药理作用及机制研究进展[J]. 上海中医药杂志, 51(10): 103-106.]
XU YH, WANG JW, WANG S, et al., 2004. Characterization of GaWRKY1, a cotton transcription factor that regulates the sesquiterpene synthase gene (+)-δ-cadinene synthase-A[J]. Plant Physiol, 135(1): 507-515.
ZHOU YY, 2015. Functional characterization of SmMYC2a and SmMYC2b which regulate multiple jasmonate-inducible steps in the biosynthesis of active compounds in Salvia miltiorrhiza[D]. Fuzhou: Fujian University of Traditional Chinese Medicine.[周陽云, 2015. 茉莉酸信号途径关键转录因子SmMYC2调控丹参有效成分生物合成的功能解析[D]. 福州: 福建中医药大学.]
(责任编辑 何永艳)
