天然多糖基可注射水凝胶在组织工程中的研究进展
2021-06-29张润婧陈玉洁刘河洲
张润婧,陈玉洁,蔡 超,陈 震,刘河洲
(上海交通大学材料科学与工程学院 金属基复合材料国家重点实验室,上海 200240)
1 前 言
组织损伤或缺失严重影响着人类的健康状况。人体许多重要组织的自我修复能力有限,如软骨组织作为一种无血管组织,由于缺乏血液供应,从而很难进行自身修复[1, 2]。组织工程技术能有效帮助人类组织和器官进行修复,其基本原理为:将细胞接种至可降解吸收的生物支架上,细胞可进行大量增殖及代谢,同时产生细胞外基质,从而形成新的生物组织,之后将细胞-支架复合物移植到组织缺失处进行体内重构,最终达到修复或者替代组织的目的[3, 4]。传统的组织工程支架材料需经手术植入,带来了操作风险与术后感染等问题[5]。针对此问题,微创手术快速发展,可注射性水凝胶材料是目前微创组织移植的优选细胞载体[6]。水凝胶材料由于具备与人体组织相似的三维网状结构、高溶胀性以及较好的生物相容性,在细胞培养、组织修复等领域展现出巨大潜力[7, 8]。可注射水凝胶可通过注射器注入体内特定位置,其微创性可有效减轻患者的痛苦,提高临床安全性,还可以利用注射器深入人体组织,填充缺损处的不规则形状[6, 9, 10],是当前组织工程支架材料的研究热点。为满足组织修复功能及应用需求,理想的可注射水凝胶材料应满足以下要求:
(1) 生物安全性。可注射水凝胶材料作为生物体植入物,其生物安全性是最基本的应用前提条件之一。支架材料应具有优异的生物相容性,植入体内后可在合适的速率下完成降解[11, 12]。
(2) 操作便捷性。可注射水凝胶材料应在体外或体内的温和环境条件下,以合适的凝胶化速率发生凝胶化转变,以便医疗人员进行注射操作[9, 13]。
(3) 机械强度。为满足组织工程应用的需求,可注射水凝胶在形成凝胶后应该有足够的机械强度和韧性,以实现对细胞的支撑及负载[14]。
根据水凝胶中聚合物原料的来源,可将其分为天然高分子水凝胶和化学合成高分子水凝胶两大类。多糖材料作为自然界中广泛存在的重要天然聚合物,可以在酶催化或特定生物体条件下实现高度降解,其降解产物一般是单糖或者双糖,不仅具有生物相容性,易被吸收,甚至还可为生命体提供能量[15-17]。因此,多糖类聚合物非常适用于体内植入水凝胶材料的制备。目前,天然多糖基可注射水凝胶材料已经成为组织工程领域的重要研究主题之一[18-21]。
2 可注射水凝胶的多糖基聚合物原料
天然多糖聚合物原料来源广泛、安全无毒、化学结构易修饰,基于天然多糖的水凝胶材料具有高保水性、可再生性、生物降解性、生物相容性、无毒性等特点,适合作为体内植入的医用材料[22]。多糖种类繁多,由于官能团及聚合物链长的差异,不同种类多糖材料的性质差别很大。近年来,科研人员利用海藻酸钠、壳聚糖、纤维素和透明质酸制备了多种多糖基医用可注射水凝胶,取得了大量研究成果[12, 19, 21, 23, 24],上述4种常见天然多糖可注射水凝胶原料的结构与性质总结于表1。
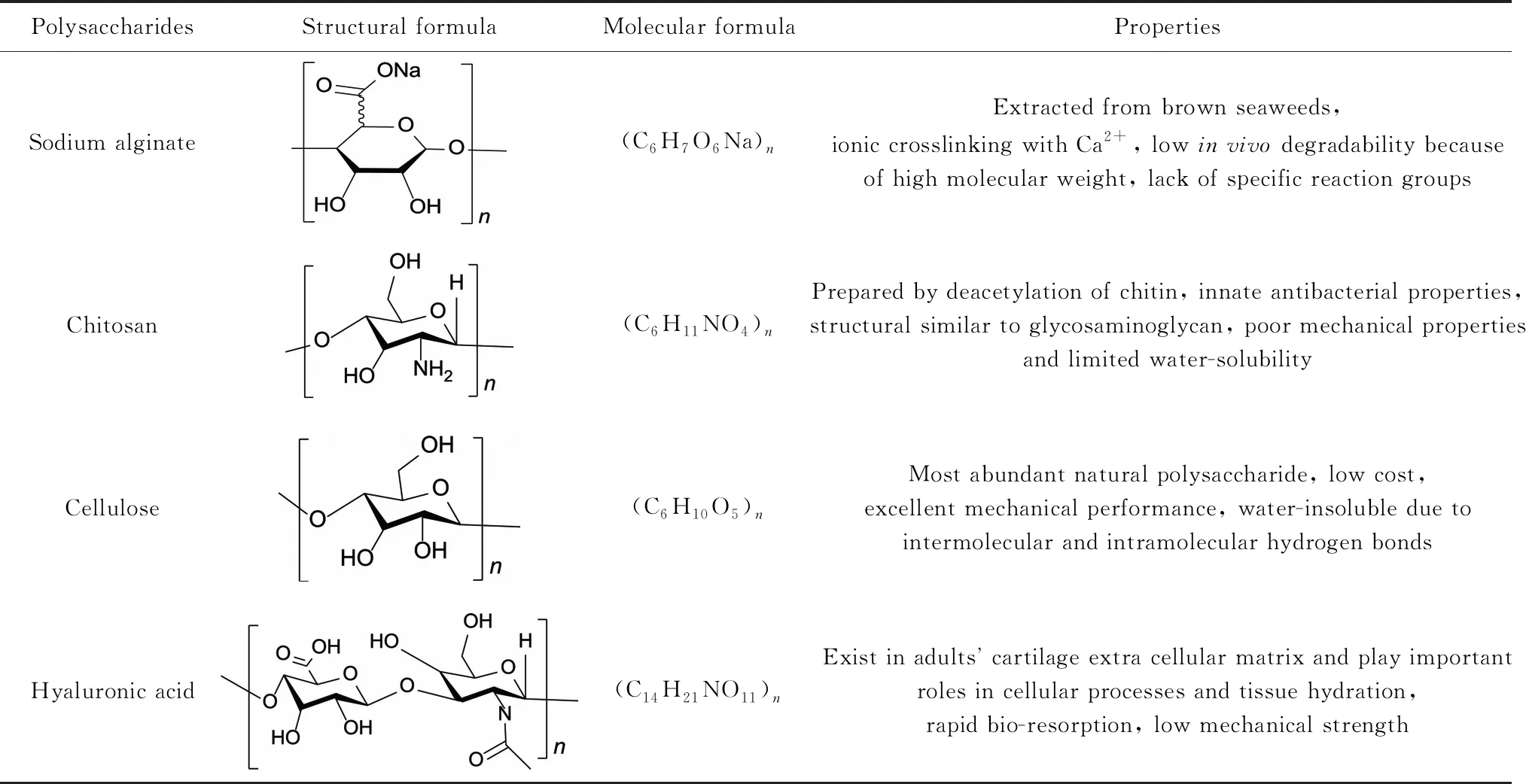
表1 常见天然多糖可注射水凝胶原料的结构与性质
2.1 海藻酸盐
海藻酸盐是从植物褐藻中提取出的亲水多糖聚合物,是由含有β-1,4-D-甘露糖醛酸的M单元和含有α-1,4-L-古洛糖醛酸的G单元经过糖苷键连接而成的天然高分子材料。由于海藻酸盐具有良好的生物相容性、较高的吸水和保水能力及非免疫原性等优势,在组织工程中具有广阔的应用前景[23, 25]。
Yan等[26]以海藻酸盐为基体,通过钙离子的原位释放,并结合羟基磷灰石(HAP)和明胶微球(GMs)的双重交联,得到可注射及可生物降解的复合可注射水凝胶。通过成分控制以及体系pH调节,制备出的水凝胶支架表现出优异的力学性能与稳定性。此外,成骨细胞包覆培养测试证实了该凝胶支架在骨组织工程中的潜在应用。通过与抗生素结合使用,凝胶支架展现出对于成骨细胞活性的促进作用。
然而,由于海藻酸盐的分子量太大,难以降解,且缺乏与氨基酸、蛋白质等反应的结合位点,这些问题在一定程度上限制了海藻酸盐作为体内移植物的应用范围[27]。为了进一步增强海藻酸盐的实用性,研究人员对海藻酸盐的结构进行修饰,引入更多的活性基团或侧链分子[28],成功拓展了海藻酸盐在组织工程领域的应用。例如,利用高碘酸钠对海藻酸盐进行氧化,可生成具有高化学活性的醛基结构。基于此原理,Wei等[29]利用N-羧乙基壳聚糖(CEC)和己二酸的动态反应以及氧化海藻酸钠的醛基结构,开发出一种基于生物相容性多糖的新型自修复可注射水凝胶。体系中多种动态共价键共存的特性赋予该水凝胶优异的力学性能和自修复能力。此外,该水凝胶还具有良好的细胞相容性及细胞释放能力,在生物工程领域具有广阔的应用前景。Balakrishnan等[30]在硼砂存在的条件下完成氧化海藻酸盐与明胶的自交联,制备出一种快速凝胶的氧化海藻酸盐基可注射水凝胶。该水凝胶可以与软骨组织进行良好结合且几乎没有炎症或应激反应的出现。包裹在水凝胶中的软骨细胞表现出良好的增殖活性和迁移能力,表明该水凝胶有潜力应用于软骨组织工程的可注射细胞支架材料。Xu等[20]利用金刚烷修饰硫酸酯化海藻酸钠(S-Alg-Ad)并完成与3,4-乙二氧基噻吩(EDOT)的氧化聚合,生成生物导电聚合物PEDOT∶S-Alg-Ad,通过聚-β-环糊精(Pβ-CD)与金刚烷的主客体作用,形成PEDOT∶S-Alg-Ad/Pβ-CD导电可注射水凝胶。高度动态的主客体作用可促进PEDOT纳米颗粒在水凝胶中的重排和堆积,PEDOT之间的π-π堆积及PEDOT与硫酸化聚合物的阴离子-π相互作用可以进一步稳定非共价网络。包覆在此种水凝胶中的C2C12成肌细胞展现出良好的增殖速率,且利用水凝胶主客体作用的可逆性能实现细胞的有效释放;更重要的是,此种导电水凝胶还能显著促进肌管状结构的形成,有潜力作为可注射生物电极应用于基础细胞研究及表型药物筛选等众多领域。
2.2 壳聚糖
壳聚糖是一种天然碱性多糖,由自然界广泛存在的甲壳素经过脱乙酰作用获得[31]。壳聚糖具有良好的生物相容性,能被酶解为低分子壳寡糖、葡萄糖胺等无害产物,不会引发人体组织免疫排斥作用,因此在医用注射植入与组织工程领域具有巨大潜力[32]。
Kamoun[33]在不使用传统化学交联剂的条件下,将两种多糖衍生物材料——N-琥珀酰壳聚糖与水溶性二醛淀粉进行混合,通过席夫碱反应制备出了一种新型无毒且可生物降解的多糖基可注射水凝胶材料,且提高N-琥珀酰壳聚糖含量有助于获得更加致密的水凝胶交联结构、更短的胶凝化时间及更少的水解质量损失。经体外细胞黏附性测试可知,N-琥珀酰壳聚糖除能够提高水凝胶的生物相容性外,还改善了凝胶表面的亲水性,从而增强了水凝胶的细胞黏附性及生物活性。
此外,壳聚糖还具有一定的抑菌作用[34]。Zhao等[35]利用壳聚糖独特的抗菌性能,制备出一种具备抗菌、抗氧化能力及电活性的可注射水凝胶。该研究将聚苯胺接枝季胺化壳聚糖(QCSP)与聚乙二醇-聚(甘油-葵二酸)共聚物进行混合,在室温条件下即可发生动态化学键交联,制备出同时具备自修复能力与高伤口黏合力的可注射抗菌水凝胶材料。QCSP中的壳聚糖成分本身具备抗菌能力,并与聚苯胺片段的电活性和抗氧化性产生协同作用,共同促进伤口处的快速愈合。另外,在季铵化壳聚糖聚合物链上引入聚苯胺,可降低季铵化壳聚糖的细胞毒性并提高其抗菌活性[36]。通过调整聚合物上的活性氨基含量,水凝胶体系可获得最优性能。利用水凝胶的原位成胶方法和组织黏附性能,可以快速填充任意形状的伤口,并与伤口轮廓进行黏合。
壳聚糖与软骨基质中的糖胺聚糖具有非常相似的化学结构。相关研究表明,壳聚糖基支架可帮助软骨细胞进行增殖[37]。拥有足够的力学强度有利于壳聚糖基水凝胶材料在组织工程中获得更强的实用性。基于此目的,Latifi等[11]模仿人体软组织中的胶原纤维结构,制备出具有胶原纤维半互穿网络的壳聚糖基仿生可注射水凝胶。I型胶原蛋白与III型胶原蛋白共同存在于人体的许多软组织中,研究人员受此启发,按照人体组织中两种胶原蛋白的特定比例,将二者共同引入乙二醇-壳聚糖基质。经生物及力学测试可知,此种仿生壳聚糖基水凝胶可使细胞保持良好的存活能力、代谢活性及迁移能力,同时还具备突出的力学性能,其综合性能可以满足组织工程的基本实用要求,具有重要的应用价值。
2.3 纤维素
纤维素是由葡萄糖连接而形成的线性天然聚合物,广泛存在于植物、细菌等生物中,是自然界分布最为广泛的天然多糖高分子材料[38],具有天然低毒、易于加工、生物可降解、可再生等优良特性[39, 40]。近年来,围绕纤维素材料作为组织工程领域植入物的研究与应用受到广泛关注[24, 41]。
由于纤维素分子链上存在大量羟基,易生成分子间氢键,从而使纤维素具备出色的化学稳定性及力学性能,可满足人体组织的生物力学要求,因此非常适合作为组织工程中的支架材料[42]。Yang等[43]利用可溶性纤维素衍生物制备出具有高效自修复能力与双重环境响应能力的纤维素基可注射水凝胶。他们首先合成了纤维素衍生物羧乙基纤维素接枝二硫代二丙酰肼(CEC-TPH)和二苯甲醛封端聚乙二醇(PEG-DA),在无毒催化剂4-氨基-DL-苯丙氨酸(4a-Phe)的活化作用下,体系中的酰肼键和醛基可形成动态酰腙键。动态共价键在生理条件下的可逆断裂重建能力,赋予了水凝胶优异的可注射性能及力学强度。基于纤维素衍生物等原料的低毒性及生物相容性,研究者将成纤维细胞L929包覆于水凝胶内部进行三维培养,细胞可以保持高的细胞活性和增殖能力,表明该纤维素基可注射水凝胶有望成为组织工程中三维细胞培养的有效支架材料。为制备同时具备力学强度与韧性的纤维素基可注射水凝胶,Zhao等[44]利用羟乙基纤维素、木质素磺酸盐等原料,制备出具有半互穿网络结构的水凝胶。研究者首先利用化学交联使丙烯酸与木质素磺酸盐发生自由基聚合,再利用羟乙基纤维素含有的大量羟基进行分子间氢键交联,最终形成水凝胶的半互穿网络。此种水凝胶具备突出的力学性能,可满足生物体承重组织的力学性能要求。
为进一步拓展纤维素基可注射水凝胶的医用功能,Park等[45]利用羧甲基纤维素与壳聚糖之间的静电作用,制备出可负载姜黄素微胶囊(Cur-M)的可注射载药水凝胶(图1)。阳离子壳聚糖溶液和阴离子羧甲基纤维素通过简单机械混合即可发生静电交联作用,从而形成可在肿瘤内注射的载药水凝胶材料。利用双注射器将混合溶液注入小鼠体内后,由体内实时成像结果可知,经皮下注射的水凝胶可在生物体内快速成型,并在体内留存20 d左右。相比于直接注射的药物,利用多糖基可注射水凝胶包裹的Cur-M可在病变区域表现出更大的分布范围,从而印证了该水凝胶体系具备的药物缓释效果。
2.4 透明质酸
透明质酸(HA)是一种非硫酸化的阴离子亲水糖胺聚糖,存在于人体关节软骨中,可提供润滑作用并在细胞增殖、分化等过程中发挥重要作用。基于透明质酸的可注射水凝胶由于其独特的生物学特性而具有作为组织工程支架的巨大实用潜力[46, 47]。
基于透明质酸在软骨组织中的分布及重要功能,Palumbo等[48]利用氨基官能化的透明质酸衍生物(HA-EDA-C18)与二乙烯基砜官能化的菊粉(INU-DV)制备适合软骨细胞增殖的可注射水凝胶支架,在生理环境下发生偶氮-迈克尔加成反应,制备出对酶水解具有较高抵抗力且具有弹性的可注射水凝胶,细胞培养结果表明,软骨细胞在HA-EDA-C18/INU-DV水凝胶中培养1 d后便可进行有效增殖。为提高视网膜祖细胞(RPC)的增殖和分化能力,Tang等[21]利用迈克尔加成反应制备出明胶-透明质酸凝胶(Gel-HA),并进一步模仿贻贝结构,引入聚多巴胺(PDA),制备出Gel-HA-PDA凝胶。该工作研究了透明质酸基水凝胶对RPC生物学行为的影响。结果表明,Gel-HA水凝胶可利用RPC细胞簇,促进细胞增殖,而Gel-HA-PDA水凝胶可显著增强RPC的黏附和迁移能力,并诱导RPC优先分化为视网膜神经元,从而为视网膜生物医学材料的研究提供了新思路。
考虑到注射型植入材料的实用性,Feng等[49]针对水凝胶在注入人体后凝胶化速率有待提升的问题,提出了一种载有干细胞的新型微凝胶的概念。此种微凝胶可以通过微创方式注射到软骨缺损部位并实现自组装,有望应用于体内的软骨组织工程修复领域。该工作首先合成了巯基化的明胶(Gel-SH)和乙烯基磺化的透明质酸(HA-VS),然后基于液滴微流控方法,将Gel-SH、HA-VS和骨间充质干细胞(BMSC)混合,利用快速有效的硫醇-迈克尔加成反应,在20 s内即可完成快速凝胶,生成富含干细胞的明胶-透明质酸微凝胶(Gel-HA)。Gel-HA微凝胶提供的优异微环境促进了细胞的迅速增殖,还能通过细胞间的相互连接,诱导微凝胶自组装成类似于软骨组织的大孔支架,促进了物质运输及软骨修复。Gel-HA可注射微凝胶的概念及其简单有效的合成方法,为组织工程和再生医学材料提供了全新的设计思路。
3 可注射水凝胶的设计方法
根据可注射水凝胶的设计及制备机理,可将可注射水凝胶主要分为基于物理交联的可注射水凝胶与基于化学交联的可注射水凝胶。各类可注射水凝胶的设计方法总结如图2所示。
3.1 基于物理交联的可注射水凝胶
利用物理交联方法形成的可注射水凝胶主要依靠聚合物的分子间弱相互作用力形成聚合物交联网络,如氢键、静电相互作用、主客体相互作用等[45, 50, 51]。此类材料在注射前呈流动性液体状态,一旦注入人体,即可利用温度、pH等物理条件的变化,在生理条件下迅速完成溶胶-凝胶转变,无需任何化学引发剂。
温度敏感性可注射水凝胶是指,环境温度的变化可以影响水凝胶网络中聚合物链之间的亲疏水性及氢键的相互作用,从而实现凝胶化转变。温度敏感性可注射水凝胶存在一个最低临界溶胶-凝胶转变温度,当环境温度低于这一温度时,聚合物分子链上的亲水基与水分子通过氢键作用进行连接,体系呈溶胶状态;当注入人体后,温度升至最低临界溶胶-凝胶转变温度以上,疏水作用成为主要作用力,高分子链通过疏水作用互相聚集,聚合物从优先聚合物-水的相互作用状态转变为优先聚合物-聚合物的相互作用状态,从而发生凝胶化相变(图3)[9, 52]。利用天然多糖制备的温敏性材料具有良好的生物相容性及简便的凝胶条件,适用于医用可注射水凝胶领域[50, 53]。

图3 温度敏感性可注射水凝胶示意图,Tgel代表最低临界溶胶-凝胶转变温度[9]Fig.3 Schematic presentation of a thermo-gelling injectable hydrogel system, Tgel is the sol-gel transition temperature[9]
Tan等[54]通过将具有单个羧基的聚异丙基丙烯酰胺(PNIPAM-COOH)利用酰胺键,接枝到胺化后的海藻酸酯(AAlg)上,合成了一种温敏梳状共聚物可注射水凝胶,在人体温度下可发生溶胶-凝胶转变。聚异丙基丙烯酰胺(PNIPAM)是一种具有最低临界溶胶-凝胶转变温度的典型温敏材料。在低温条件下,水凝胶中的亲水基团帮助聚合物分子与水分子产生强相互作用,从而具有良好的溶解性;当温度上升时,分子链上的正电荷静电作用及化学反应活性增强,分子间氢键作用增强,从而脱去水分子而交联形成三维凝胶网络。此外,通过体外降解研究表明,基于海藻酸衍生物等对PNIPAM的修饰,该水凝胶表现出可降解性能。同时,体外细胞培养实验也进一步表明该热敏梳状可注射水凝胶具有一定的生物相容性并能刺激细胞增殖。
利用pH变化实现凝胶化也是制备可注射水凝胶的重要方法。pH敏感性可注射水凝胶体系中通常含有高分子聚电解质,即聚合物链上有大量可以接受或释放质子的可电离基团。当pH变化时,聚电解质中原本不带电荷的酸碱度响应基团会发生电离而带电,相同电荷产生的静电排斥力将影响聚合物链间及其与水分子间的氢键作用,导致聚合物链的亲疏水能力发生变化,从而发生溶胶-凝胶转变[55]。
Zhao等[56]制备出一种以壳聚糖衍生物为基体的pH响应可注射纳米复合水凝胶,有望用于骨组织再生的理想支架材料。他们将羧甲基壳聚糖(CMCh)和无定形磷酸钙(ACP)进行复合,利用材料表面的可电离基团,通过调节体系的pH值,实现纳米颗粒的静电自组装,从而完成凝胶化反应。在人体生理条件(pH=7.4)下,可形成稳定的固态水凝胶(图4)。该研究制备出的CMCh-ACP水凝胶具有出色的生物相容性,有助于间充质干细胞的增殖和细胞黏附。成骨分化实验证明,CMCh-ACP水凝胶还具有骨诱导作用,能提升体内骨组织形成的效率。因此,此种pH响应的CMCh-ACP可注射水凝胶有望被进一步开发为骨组织再生生物支架。

图4 采用羧甲基壳聚糖(CMCh)和无定形磷酸钙(ACP)制备的具有pH敏感性的CMCh-ACP可注射水凝胶:(a)在pH=7.0和pH=7.5条件下的样品瓶倾倒实验; (b)pH为7.5时,水凝胶在样品瓶底部形成稳定凝胶;(c)CMCh-ACP水凝胶制备完成4和36 h后,通过注射器针头的可注射能力[56]Fig.4 pH sensitive carboxymethyl chitosan-amorphous calcium phosphate(CMCh-ACP)hybrid gels:(a) Vial-inversion tests of CMCh-ACP hybrid gels at pH 7.0 and pH 7.5; (b) At pH 7.5, the gel remains at the bottom of the vial; (c) Injectability of CMCh-ACP gel (at pH 7.5) through medical syringes with needle after 4 and 36 h preparation[56]
3.2 基于化学交联的可注射水凝胶
利用化学交联方法形成可注射水凝胶,其交联机理为利用化学聚合反应产生化学共价键,因而可形成更加稳定的共价交联网络。此类水凝胶中的聚合物分子链一般含有多种活性官能团,常见的交联反应包括:席夫碱反应、迈克尔加成反应、点击化学及光热引发的交联反应等[29, 48, 49]。
光聚合方法是制备化学交联可注射水凝胶的重要方法。水凝胶的前驱体溶液在注射完成后,经可见光或紫外光的照射即可发生聚合[12],从而在体内形成水凝胶,因此可以较好地控制凝胶化时间和位置。
Babo等[46]制备出一种基于透明质酸的可注射水凝胶,用于牙周缺损组织的修复。此种可注射体系基于甲基丙烯酸化的透明质酸(me-HA),加入具有抗菌能力的血小板裂解液(PL),在紫外照射条件下,利用光引发剂Irgacure 2959中的活性羟基即可完成光聚合反应,形成可注射水凝胶。经降解实验可知,加入PL的透明质酸可注射水凝胶能够增强水凝胶的结构稳定性,促进生长因子等活性物质的有效传递,从而有望增强牙周组织的修复和再生能力。
然而,需要光照条件的凝胶化方法会对实际操作造成一定的不便。因此,无需外界刺激的化学交联方法引发了研究者的关注。席夫碱反应是利用羰基化合物与氨基化合物生成可逆亚胺键的化学缩合反应[57]。由于席夫碱反应条件温和,且无需添加引发剂或交联剂,因此被广泛用于组织工程生物材料的研究。Qu等[58]利用动态席夫碱反应,制备出基于水溶性壳聚糖的自修复可注射水凝胶。研究者将CEC及苯甲醛修饰的聚乙二醇(PEGDA)溶液进行混合,CEC分子链上的氨基与PEGDA的苯甲醛基团可发生席夫碱反应,交联形成水凝胶。当水凝胶受到巨大剪切力时,水凝胶中的可逆共价键因外力破坏而发生断裂;当外力撤除后,动态席夫碱亚胺键可以再次形成,从而实现动态断裂-重建的过程。因此,此种水凝胶可以顺利通过注射器针头。研究者利用大鼠体内注射实验验证了水凝胶的体内可注射性。随后,还使用成纤维细胞L929细胞进行细胞毒性测试,结果表明此种可注射水凝胶具有良好的细胞相容性。
同席夫碱反应一样,迈克尔加成反应也能够在人体生理环境中进行,且反应时间可控[59],因而成为另一种制备医用可注射水凝胶的重要方法。Fiorica等[60]利用两种透明质酸衍生物的原位聚合制备可注射水凝胶,该水凝胶有望用于关节软骨损伤的治疗。在这项工作中,研究者利用透明质酸的氨基衍生物(HA-EDA)及其α-弹性蛋白的接枝共聚物(HA-EDA-g-α-elastin)与二乙烯基砜衍生化的α,β-聚(N-2-羟乙基)-DL-天冬酰胺进行反应,原料中的氨基与乙烯基可在生理条件下发生迈克尔加成反应,制备出基于透明质酸的可注射水凝胶。该水凝胶展现出良好的溶胀性及可降解能力,同时与关节软骨细胞具有良好的相容性,满足了其作为可注射水凝胶支架以治疗关节软骨损伤的基本要求。
由于有效的化学键合与温和的生物反应条件,酶促交联和Diels-Alder(DA)点击化学在水凝胶形成中的应用受到广泛关注。Yu等[61]同时利用上述两个交联过程,成功地制备出可注射的透明质酸/PEG水凝胶。酶促交联使HA/PEG在5 min内快速凝胶化,形成可注射的凝胶。DA反应交联使得水凝胶具有优异的形状记忆和抗疲劳性能。此外,包裹在水凝胶中的小鼠胚胎瘤细胞ATDC-5细胞表现出良好的代谢活力和增殖能力。综合结果表明,结合两个化学交联过程形成的HA/PEG可注射水凝胶在软骨组织工程中具有巨大的潜力。
4 可注射水凝胶的组织工程功能化发展
4.1 力学性能可媲美天然组织的可注射水凝胶
相比于合成高分子水凝胶,天然多糖基水凝胶具备更好的生物相容性,增强了组织工程应用中的安全性。然而,多数天然聚合物的力学强度较低,无法满足软骨组织等承力部位的使用要求,因而其使用范围受到限制[12, 62]。针对水凝胶材料的增韧策略,Fu等[63]利用钙离子交联的海藻酸盐网络以及乙烯基改性荧光粉(YAG∶Ce-VTES)交联的聚丙烯酰胺(PAAm)网络,成功构建出分子链缠结、互穿的差异性双网络结构(double network,DN),显著提升了水凝胶的力学性能,此种海藻酸盐/聚丙烯酰胺双网络水凝胶显示出良好的延伸性和韧性,断裂伸长率高达600%,压缩强度高达3.6 MPa。针对组织工程生物材料,Fu等[64]提出,组织工程材料需具备足够的强度及韧性,以匹配所修复组织的力学性能,从而获得更加广泛的应用。因此,制备力学性能可与天然组织相媲美的可注射水凝胶材料是组织工程移植物的重要挑战。为制备多糖基高强度可注射水凝胶,You等[65]将季铵化纤维素与阳离子纤维素纳米晶体相结合,制备出纳米复合水凝胶材料,成功将水凝胶的力学性能提升了两个数量级。体外毒性及动物体内测试表明该水凝胶具备良好的生物相容性。Pérez-Madrigal等[66]选用了两种天然多糖基聚合物——透明质酸与海藻酸,制备出具有出色力学性能的可注射水凝胶。研究者首先将透明质酸进行巯基化修饰,并与炔基封端的聚乙二醇发生简单高效的硫醇-炔点击化学反应,形成水凝胶的第一层刚性网络,之后继续引入由物理交联形成的钙离子-海藻酸盐,作为第二层柔性疏松网络。该工作利用双网络结构的互穿及能量耗散机理[67],成功制备出具有优异力学强度及足够刚度的可注射水凝胶。由于存在双重多糖基网络,此种水凝胶具有良好的生物相容性,且机械强度具有长期稳定性,有较大潜力成为组织工程三维支架,以支持和促进骨组织的再生。Rodell等[68]将透明质酸进行功能化修饰,利用串联超分子作用与化学共价键两种交联策略,制备了一种双网络水凝胶。他们以β-环糊精作为主体,金刚烷作为客体,利用酯化及酰胺化反应将主客体偶联至透明质酸分子链,之后利用甲基丙烯酸盐和二硫苏糖醇的共价交联形成双层凝胶网络。双网络结构大大提升了水凝胶的力学强度,主客体作用赋予水凝胶自修复及可注射性。经生物学实验可知,细胞可在水凝胶内部维持两周以上的代谢活性。此种天然多糖基双网络可注射水凝胶由于具有独特的力学性能与生物相容性,在组织工程支架领域具有良好前景。
4.2 利用3D打印实现形状定制
为克服传统组织工程材料形状与组织损伤处不匹配、立体结构内部区域难以调整等问题[69],生物3D打印技术吸引了研究人员的关注。用于组织工程领域的3D打印技术以仿生为标准,根据预先设计的组织或器官结构数字化模型,将生物墨水材料经小口径打印喷头挤出,通过精准堆叠,制备出具有特定形状的三维实体[70]。理想的生物打印墨水材料应满足安全低毒、力学稳定等要求,且应具备合适的粘度,在打印过程中不会堵塞喷头。另外,能够负载细胞的生物墨水可帮助构建3D细胞培养环境,实现细胞培养所需材料的快速批量化生产,为细胞生长提供支撑作用,以促进组织形成,同时还可与缺损处结构相匹配(图5)[71]。水凝胶材料具有大量亲水基团及类似于细胞外基质的三维结构,其内部水合通道及交联网络可为细胞提供适宜的包覆条件。因此,具备剪切挤出能力的可注射水凝胶成为优选的生物3D打印墨水材料[72, 73]。相比于合成水凝胶,天然多糖基可注射水凝胶在力学强度与可控性方面尚有不足,然而具备了合成水凝胶难以比肩的生物相容性及生物可降解性,非常适合用作生物3D打印的墨水材料[74]。近年来,研究人员围绕天然多糖基可注射水凝胶在生物打印中的应用展开了一系列研究[75, 76]。

图5 3D打印仿生人耳[71]Fig.5 Image of the 3D printed bionic ear[71]
Müller等[77]以能够促进有丝分裂的海藻酸盐硫酸盐水凝胶体系为基础,引入具有良好打印能力的纳米纤维素,通过两种多糖材料的结合,成功制备出可进行3D打印的生物墨水。研究人员发现,细胞的生物性能与打印喷嘴的形状密切相关,以最低的挤出压力与剪切应力打印此种多糖基生物墨水时,可保持良好的细胞铺展性。Heo等[78]利用海藻酸钠与成骨多肽制备出一种可促进骨组织再生的新型3D打印生物墨水,体内和体外测试表明,这种生物墨水可为细胞增殖提供理想的稳定环境。为模拟生物组织的电生理环境,Shin等[75]利用微流体技术制备了透明质酸微凝胶,通过原位金属还原提高了材料的电导率,并进一步将微凝胶组装为含金属-酚配位网络的可注射粒状水凝胶。此种粒状水凝胶具备出色的可注射性及导电性,有望用于可穿戴电活性器件的3D打印及生物组织间电生理环境的构建。
组织工程植入物进入人体后,经常面临新生血管数量不足而导致组织坏死的问题[22]。曾有研究者成功制备出可以控制生成因子传递的可注射水凝胶材料,以诱导血管的形成[79]。然而,新血管的生长仍需较长时间,因而限制了大型组织工程移植体的发展[80]。3D生物打印不仅可以制备组织工程支架材料,还可用于血管网络结构的构建,以维持组织活性并促进组织功能的完善[81]。Kuss等[82]利用3D打印技术,在体外条件下实现了透明质酸基水凝胶中血管网络的构建。研究者首先将脂肪间充质干细胞和脐静脉内皮细胞植入经化学修饰的透明质酸-明胶复合水凝胶中,之后,通过3D打印制备出水凝胶/羟基磷灰石复合多孔支架。通过裸鼠皮下注射实验可知,水凝胶系统促进了与裸鼠血管系统相匹配的心血管网络的形成,证明了透明质酸基水凝胶在血管化生物打印中的巨大潜力。
5 结 语
随着社会老龄化程度的加深及医疗技术的发展,组织工程技术愈发成为人体组织修复的重要手段。可注射性水凝胶可通过微创方式植入人体,能有效帮助病患减轻痛苦、减少手术风险,还能深入特定受损位置,填充不规则形状,因而在组织修复及体内植入领域展现出巨大潜力。由于具备良好的生物相容性、生物降解性及结构可修饰性,多糖基可注射水凝胶在组织工程中的应用受到广泛关注,并取得大量研究成果。
与此同时,多糖基可注射水凝胶在组织工程应用领域仍存在一些问题亟待解决:
(1) 实现天然组织的众多功能是组织工程材料的重要目标。目前,单一组分的多糖类可注射水凝胶仍无法兼备天然组织在生物响应、生物力学、物质传输等众多方面的完整功能,因而在实际应用中受到一定局限。近期,研究者尝试利用蚕丝[83]等生物活性材料制备可注射水凝胶,为此领域拓展了新思路。新型生物活性材料的开发与利用,将有望推动可注射水凝胶的医用功能性发展。
(2) 天然组织的功能机理研究尚有不足,从而难以确定并模仿功能实现的核心要素,这在根本上限制了医用植入材料生物功能的发展。今后,多糖基可注射水凝胶的制备工作可与人体组织学研究相结合,从生物学原理出发,设计仿生材料结构与物化性质,以拓展其在组织工程中的临床应用。
