石蒜碱诱导人肝癌HepG-2细胞凋亡机制研究
2021-06-25李吉业辛国松
李吉业,张 晶,于 淼,2,刘 斌,辛国松,2*
(1.哈尔滨商业大学 药物工程技术研究中心,哈尔滨 150076;2.国家教育部抗肿瘤天然药物工程研究中心,哈尔滨 150076)
恶性肿瘤已经严重威胁中国人群健康,根据最新的统计数据显示,近十几年来恶性肿瘤的发病死亡均呈持续上升态势,防控形势严峻.目前在临床上癌症治疗主要有阿霉素等药物,治疗后复发几率很高,其中重要的原因就是由于化疗过程中肿瘤细胞多药耐药的产生.阿霉素属于广谱抗癌药物,主要通过破坏DNA从而发挥药效.目前在治疗肿瘤方面,阿霉素与其他抗肿瘤药物联用被认为高效的化疗药物.化疗药物发生药效的同时,对肝脏、肾脏、心脏以及神经系统都会产生一定的毒害作用,加大药物剂量的同时并不能更好的达到效果,从而很大程度的降低了生物利用度.研究表明石蒜碱具有抗肿瘤作用.石蒜碱是存在于石蒜科植物石蒜鳞茎内的生物碱[1-2].石蒜碱具有右旋光性,不溶于水,难溶于乙醇和乙醚[3].石蒜碱经口给药或皮下注射有流涎、抑制心率及增加气管分泌的作用,故在一些时候曾用其制剂作祛痰剂[4].石蒜碱还有较显著的催吐作用.石蒜碱是生物学活性较强的生物碱,在临床上石蒜碱具有广泛的药理作用,主要有抗肿瘤、抗炎、对神经系统的作用等[5-6].有研究认为,石蒜碱对肝癌具有抗肿瘤作用[7],而且对多种肿瘤细胞株具有敏感性,是目前肿瘤化疗研究的热点药物之一,具有广泛的应用前景[8].本文主要是对石蒜碱抗肿瘤作用机制研究进展进行研究[9-10],为今后石蒜碱的深入研究开发与临床应用提供参考.
1 材料与仪器
1.1 细胞株
人肝癌HepG-2细胞株由哈尔滨商业大学药物工程技术研究中心提供.
1.2 药物与实验试剂
羟基喜树碱(哈尔滨圣泰药业有限公司,质量分数98%);青藤碱(阿拉丁试剂有限公司,质量分数98%);总胆固醇测定试剂盒(浙江东瓯诊断产品有限公司);唾液酸测定试剂盒(南京建成生物工程研究所);细胞膜流动性DPH荧光偏振检测试剂盒(贝博生物技术有限公司);ATP酶测定试剂盒(南京建成生物工程研究所);胎牛血清(浙江杭天生物科技公司);RPMI 1640细胞培养基、CCK-8试剂(美国 GIBCO 公司);医用酒精(山东利尔康消毒试剂股份有限公司);氯化钾、氯化钠(北京化学试剂公司);磷酸二氢钾(莱阳化工实验厂);磷酸二氢钠(汕头金纱化工厂);甲醇(天津天利化学试剂有限公司);BCA蛋白浓度测定试剂盒、荧光探针钙黄绿素/AM-氯化钴、罗丹明123荧光探针、兔抗Cytchrome C多克隆抗体、兔抗Bax多克隆抗体、兔抗Bcl-2多克隆抗体、辣根酶标记山羊抗鼠IgG(H+L)、Caspase-3试剂盒、核糖核酸酶A、PMSF、Western及IP细胞裂解夜、30%Acr-Bis、TEMED(碧云天生物技术研究所);Tween-20(美国Amresco公司);乙醇(95%)(山东银舟化工有限公司);Triton-X-100(Farco公司);枸橼酸钠(北京化学试剂公司);碳酸氢钠(天津巴斯夫化工有限公司);生理盐水(哈尔滨三联药业有限公司);SDS(美国Sigma公司);封闭用脱脂奶粉(LEAGENE公司).
1.3 实验仪器
医用型超净工作台(DL-CJ-1N)(北京东联哈尔仪器制造有限公司);ECO-170P-230型二氧化碳培养箱、Model 680型酶标仪(美国NBS公司);荧光显微镜(德国Leica公司);流式细胞仪(EPICS-XL)(美国Beckman-Coulter公司);CKX-41-32型倒置显微镜、C-4040ZOOM 型数码相机(日本OLYMPUS公司);紫外分光光度计(UV-5800)(美国METASH公司);低速离心机(Anke TDL80-2C)(上海安亭科学仪器厂);低温高速离心机(美国Beckman-Coulter公司);TS-1000震荡仪(海门市其林贝尔仪器制造有限公司);DK-8D型电热恒温水槽(上海一恒科学有限公司);Adventurer万分之一电子天平(美国Ohous公司);P型微量移液器(法国Gilson公司);电泳仪、垂直电泳转印槽(北京六一仪器厂);Tannon凝胶成像系统GIS-2019(天能科技有限公司);紫外分光光度计(美国METASH公司).
2 石蒜碱对人肝癌HepG-2细胞抗肿瘤作用的研究
2.1 细胞培养
将HepG-2细胞接种于RPMI 1640培养液中,将培养瓶放入培养箱中,在5% CO2、37 ℃条件下,继续培养,每3 d换液1次,用0.25%胰酶消化液消化,然后将细胞进行传代培养,如用于实验可以收集细胞.
2.2 MTT法检测石蒜碱的生长抑制作用
将处于对数期的HepG-2细胞,利用胰蛋白酶快速消化后,用RPMI 1640培养液(含10%胎牛血清),将HepG-2细胞稀释调节浓度为5×104个/mL细胞混悬液,取出事先灭菌的96孔板,每孔100 μL接种,放入培养箱中,温度设定37 ℃、5% CO2条件下继续培养,培养24 h后,向96孔板中加入药液,每孔100 μL,并且每个给药组设置6个平行样,石蒜碱给药组设置5个给药量,阳性给药组给予3个剂量的羟基喜树碱,阴性对照组给予RPMI 1640培养液,继续培养72 h后,去除96孔板中上层清液,然后向每孔加入质量浓度为0.5 mg/mL 100 μL MTT溶液,放入培养箱中,温度37 ℃、5% CO2条件下继续培养,培养4 h后,去除上清液,向96孔板中加入DMSO溶液,每孔200 μL,使用微型振荡器振荡,时间5 min,然后采用酶标仪检测,检测波长设定为570 nm,计算IC50.
细胞抑制率% =
2.3 倒置显微镜观察肿瘤细胞形态
将处于对数期的HepG-2细胞,利用胰蛋白酶快速消化后,用RPMI 1640培养液(含10%胎牛血清),将HepG-2细胞稀释调节浓度为5×104个/mL细胞混悬液,取出事先灭菌的6孔板,每孔1 mL接种,放入培养箱中,温度设定37 ℃、5% CO2条件下继续培养,培养24 h后,给药,每孔1 mL,石蒜碱给药浓度分为低中高三个剂量组,剂量分别为3、6、12 μmol/L,阳性对照组为浓度4 μmol/L羟基喜树碱1 mL,阴性对照组给予RPMI 1640培养液1 mL,继续培养48 h后,倒置显微镜下拍照观察.
2.4 荧光显微镜下观察细胞凋亡形态
将处于对数期的HepG-2细胞,利用胰蛋白酶快速消化后,用RPMI 1640培养液(含10%胎牛血清),将HepG-2细胞稀释调节浓度为5×104个/mL细胞混悬液,取出事先灭菌的6孔板,每孔1 mL接种,放入培养箱中,温度设定37 ℃、5% CO2条件下继续培养,培养24 h后,给药,每孔1 mL,石蒜碱给药浓度分为低中高三个剂量组,剂量分别为3、6、12 μmol/L,阳性对照组为浓度4 μmol/L羟基喜树碱1 mL,阴性对照组给予RPMI 1640培养液1 mL,继续培养48 h后,倒掉培养液,加入多聚甲醛溶液1 mL,4 ℃条件下固定1 h,PBS清洗液清洗细胞,避光使用Hoechst33258染色液染色30 min,荧光显微镜下拍照观察.
2.5 石蒜碱对HepG-2细胞凋亡率变化的影响
取出正处于对数生长期的人肝癌HepG-2细胞,利用胰蛋白酶快速消化后,用RPMI 1640培养液(含10%胎牛血清),将HepG-2细胞稀释调节浓度为5×104个/mL细胞混悬液,取出事先灭菌的6孔板,每孔1 mL接种,放入培养箱中,温度设定37 ℃、5% CO2条件下继续培养,培养24 h后,给药,每孔加入1 mL药液,石蒜碱分为低中高三个剂量组,给药剂量为3、6、12 μmol/L,阳性对照组为浓度4 μmol/L羟基喜树碱1 mL,阴性对照组给予RPMI 1640培养液1 mL,继续培养48 h后,使用胰蛋白酶消化收集细胞,将收集细胞用事先在-20 ℃条件下预冷的70%乙醇溶液固定,固定条件为4 ℃,固定时间为24 h,然后利用离心机离心,去除上层固定液,再使用PBS溶液反复离心洗涤3次,最后向收集的细胞中加入800 μL PI 染液染色,在室温条件下避光孵育,时间为30 min,然后用300目网过滤染色细胞悬液,利用流式细胞仪检测.
3 石蒜碱对人肝癌HepG-2细胞膜结构功能影响的研究
3.1 检测人肝癌HepG-2细胞膜含总蛋白量变化情况
取对数生长期的HepG-2细胞,利用胰蛋白酶快速消化后,用RPMI 1640培养液(含10%胎牛血清),将HepG-2细胞稀释调节浓度为5×104个/mL细胞混悬液,取出事先灭菌的6孔板,每孔1 mL接种,放入培养箱中,温度37 ℃、5% CO2条件下继续培养,培养24 h后,给药,每孔加入1 mL药液,石蒜碱分为低、中、高三个剂量组,给药剂量为3、6、12 μmol/L,阳性对照组为浓度4 μmol/L羟基喜树碱1 mL,阴性对照组给予RPMI 1640培养液1 mL,继续培养48 h后,使用胰蛋白酶消化收集细胞,将肿瘤细胞用蒸馏水混匀并且低渗条件进行破膜处理,时间为1 h,最后向溶液中再加入10 mL蒸馏水后,离心机离心2次,去除上层清液,最终获得沉淀的肿瘤细胞膜,将其收集用生理盐水悬浮待用.检测按试剂盒说明操作.
3.2 石蒜碱对肿瘤细胞膜含胆固醇量的影响
取对数生长期的HepG-2细胞,利用胰蛋白酶快速消化后,用RPMI 1640培养液(含10%胎牛血清),将HepG-2细胞稀释调节浓度为5×104个/mL细胞混悬液,取出事先灭菌的6孔板,每孔1 mL接种,放入培养箱中,温度37 ℃、5% CO2条件下继续培养,培养24 h后,给药,每孔加入1 mL药液,石蒜碱分为低、中、高三个剂量组,给药剂量为3、6、12 μmol/L,阳性对照组为浓度4 μmol/L羟基喜树碱1 mL,阴性对照组给予RPMI 1640培养液1 mL,继续培养48 h后,使用胰蛋白酶消化收集细胞,将肿瘤细胞用蒸馏水混匀并且低渗条件进行破膜处理,时间为1 h,最后向溶液中再加入10 mL蒸馏水后,离心机离心2次,去除上层清液,最终获得沉淀的肿瘤细胞,将其收集用生理盐水悬浮待用.检测按含胆固醇量检测试剂盒说明操作.
3.3 石蒜碱对肿瘤细胞膜含唾液酸量的影响
取对数生长期的HepG-2细胞,利用胰蛋白酶快速消化后,用RPMI 1640培养液(含10%胎牛血清),将HepG-2细胞稀释调节浓度为5×104个/mL细胞混悬液,取出事先灭菌的6孔板,每孔1 mL接种,放入培养箱中,温度设定37 ℃、5% CO2条件下继续培养,培养24 h后,给药,每孔加入1 mL药液,石蒜碱分为低、中、高三个剂量组,给药剂量为3、6、12 μmol/L,阳性对照组为浓度4 μmol/L羟基喜树碱1 mL,阴性对照组给予RPMI 1640培养液1 mL,继续培养48 h后,使用胰蛋白酶消化收集细胞,将肿瘤细胞用蒸馏水混匀并且低渗条件进行破膜处理,时间为1 h,最后向溶液中再加入10 mL蒸馏水后,离心机离心2次,去除上层清液,最终获得沉淀的肿瘤细胞,将其收集用生理盐水悬浮待用.检测按含唾液酸量检测试剂盒说明操作.
3.4 石蒜碱对肿瘤细胞膜流动性的影响
取对数生长期的HepG-2细胞,利用胰蛋白酶快速消化后,用RPMI 1640培养液(含10%胎牛血清),将HepG-2细胞稀释调节浓度为5×104个/mL细胞混悬液,取出事先灭菌的6孔板,每孔1 mL接种,放入培养箱中,温度37 ℃、5% CO2条件下继续培养,培养24 h后,给药,每孔加入1 mL药液,石蒜碱分为低、中、高三个剂量组,给药剂量为3、6、12 μmol/L,阳性对照组为浓度4 μmol/L羟基喜树碱1 mL,阴性对照组给予RPMI 1640培养液1mL,继续培养48 h后,使用胰蛋白酶消化收集细胞,将肿瘤细胞用蒸馏水混匀并且低渗条件进行破膜处理,时间为1 h,最后向溶液中再加入10 mL蒸馏水后,离心机离心2次,去除上层清液,最终获得沉淀的肿瘤细胞,将其收集用生理盐水悬浮待用.荧光分光光度计检测.
3.5 石蒜碱对肿瘤细胞膜封闭度的影响研究
取对数生长期的HepG-2细胞,利用胰蛋白酶快速消化后,用RPMI 1640培养液(含10%胎牛血清),将HepG-2细胞稀释调节浓度为5×104个/mL细胞混悬液,取出事先灭菌的6孔板,每孔1 mL接种,放入培养箱中,温度设定37 ℃、5% CO2条件下继续培养,培养24 h后,给药,每孔加入1 mL药液,石蒜碱分为低、中、高三个剂量组,给药剂量为3、6、12 μmol/L,阳性对照组为浓度4 μmol/L羟基喜树碱1 mL,阴性对照组给予RPMI 1640培养液1 mL,继续培养48 h后,使用胰蛋白酶消化收集细胞,将肿瘤细胞用蒸馏水混匀并且低渗条件进行破膜处理,时间为1 h,制成不封闭影泡.采用Zamudio法,测定细胞膜的封闭度.
3.6 石蒜碱对肿瘤细胞膜阳离子通道活性的影响的研究
取对数生长期的HepG-2细胞,利用胰蛋白酶快速消化后,用RPMI 1640培养液(含10%胎牛血清),将HepG-2细胞稀释调节浓度为5×104个/mL细胞混悬液,取出事先灭菌的6孔板,每孔1 mL接种,放入培养箱中,温度37 ℃、5% CO2条件下继续培养,培养24 h后,给药,每孔加入1 mL药液,石蒜碱分为低、中、高三个剂量组,给药剂量为3、6、12 μmol/L,阳性对照组为浓度4 μmol/L羟基喜树碱1 mL,阴性对照组给予RPMI 1640培养液1 mL,继续培养48 h后,使用胰蛋白酶消化收集细胞,将肿瘤细胞用蒸馏水混匀并且低渗条件进行破膜处理,时间为1 h,离心取上清肿瘤细胞膜,ATP酶活性试剂盒进行检测.
4 实验结果与数据分析
4.1 利用MTT实验考察石蒜碱对人肝癌细胞HepG-2的增殖抑制作用
实验结果发现,人肝癌HepG-2细胞经不同浓度的石蒜碱作用后,均表现出一定的增殖抑制作用,说明石蒜碱对HepG-2具有增殖抑制作用,经数据处理分析发现,石蒜碱的增殖抑制作用在一定范围内,与石蒜碱给药剂量正相关性.并计算得出IC50为5.73 μmol/L.后续实验参考IC50,设定低、中、高三个给药剂量组,剂量分别为3、6、12 μmol/L,阳性对照羟基喜树碱剂量设定为4 μmol/L.见表1.

表1 石蒜碱对HepG-2细胞增殖抑制作用
4.2 观察石蒜碱作用人肝癌HepG-2细胞后形态学变化情况
在实验过程中,将HepG-2细胞接种于6孔板内,给药48 h后发现,利用倒置显微镜观察细胞形态学变化情况,阴性对照组细胞状态良好,贴壁生长,外形轮廓清晰;阳性对照羟基喜树碱组细胞生长稀疏,可见大多数细胞悬浮于培养基中,石蒜碱给药组,随着石蒜碱给药剂量的加大,细胞贴壁生长数量逐渐减少,细胞生长稀疏,且越发呈现不规则形状,高剂量这种作用最为明显,部分细胞出现破裂现象.见图1.

图1 倒置显微镜观察HepG-2细胞形态(10×40倍)
4.3 利用荧光显微镜观察石蒜碱作用人肝癌细胞HepG-2后形态学变化情况
药物作用HepG-2细胞48 h后,结果发现阴性对照组肿瘤细胞排列紧密,整体轮廓清晰完整,细胞核呈现均匀荧光,阳性对照羟基喜树碱组细胞,外膜明显破裂,细胞核缩小,细胞整体轮廓模糊,石蒜碱给药组,三个剂量均能发现凋亡小体,且细胞生长稀疏,细胞核呈现较强荧光,且随石蒜碱给药浓度增加,现象越明显.见图2.
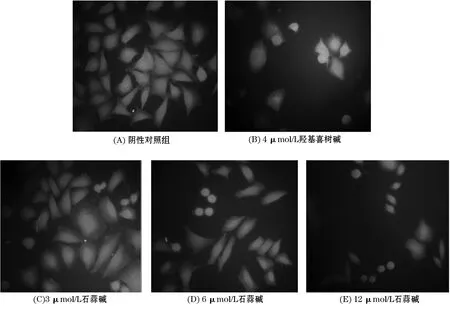
图2 石蒜碱作用HepG-2细胞后细胞凋亡形态(10×40倍)
4.4 石蒜碱诱导人肝癌HepG-2细胞凋亡率变化情况
石蒜碱作用人肝癌HepG-2细胞72 h后,经流式细胞仪检测细胞凋亡率,结果发现阳性对照羟基喜树碱组凋亡率为(18.53±0.07)%,石蒜碱低、中、高剂量组,凋亡率分别为(7.77±0.13)%、(10.59±0.26)%、(12.95±0.14)%,细胞凋亡率随着石蒜碱给药浓度的增加而增加,且呈剂量依赖性关系,各给药组细胞凋亡率与阴性对照组比较具有显著性差异,有统计学意义(P<0.01).见图3,表2.

图3 石蒜碱对HepG-2细胞的凋亡率影响

表2 石蒜碱对HepG-2细胞的凋亡率影响
4.5 石蒜碱对HepG-2肿瘤细胞膜蛋白含量的影响
石蒜碱作用人肝癌HepG-2细胞48 h后,检测肿瘤细胞膜含蛋白量变化情况,结果发现阳性对照羟基喜树碱组肿瘤细胞膜含总蛋白量为(1.039±0.032)g/L,阴性对照组肿瘤细胞膜含总蛋白量为(1.368±0.027)g/L,石蒜碱低、中、高剂量组,肿瘤细胞膜含总蛋白量分别为(1.129±0.025)g/L,(0.971±0.006)g/L,(0.334±0.026)g/L,肿瘤细胞膜含总蛋白量随着石蒜碱给药浓度的增加而减少,且与剂量呈负相关性,各给药组肿瘤细胞膜含总蛋白量与阴性对照组比较具有显著性差异,有统计学意义(P<0.01).见表3,图4、5.

图4 石蒜碱对HepG-2细胞的凋亡率影响

表3 石蒜碱作用人肝癌HepG-2细胞膜含总蛋白量变化情况

图5 石蒜碱作用人肝癌HepG-2细胞膜总蛋白含量变化情况
4.6 石蒜碱作用HepG-2肿瘤细胞膜唾液酸浓度变化情况
石蒜碱作用人肝癌HepG-2细胞48 h后,检测肿瘤细胞膜唾液酸浓度变化情况,结果发现阳性对照羟基喜树碱组肿瘤细胞膜唾液酸浓度为(1.575±0.047)mmol/L,阴性对照组肿瘤细胞膜唾液酸浓度为(3.600±0.036)mmol/L,石蒜碱低、中、高剂量组,肿瘤细胞膜唾液酸浓度分别为(2.438±0.059)mmol/L,(1.851±0.073)mmol/L,(1.219±0.061)mmol/L,肿瘤细胞膜唾液酸浓度随着石蒜碱给药的增加而减少,且与剂量呈负相关性,各给药组肿瘤细胞膜唾液酸浓度与阴性对照组比较具有显著性差异,有统计学意义(P<0.01).见表4,图6.
表4 石蒜碱对人肿瘤细胞膜唾液酸的影响
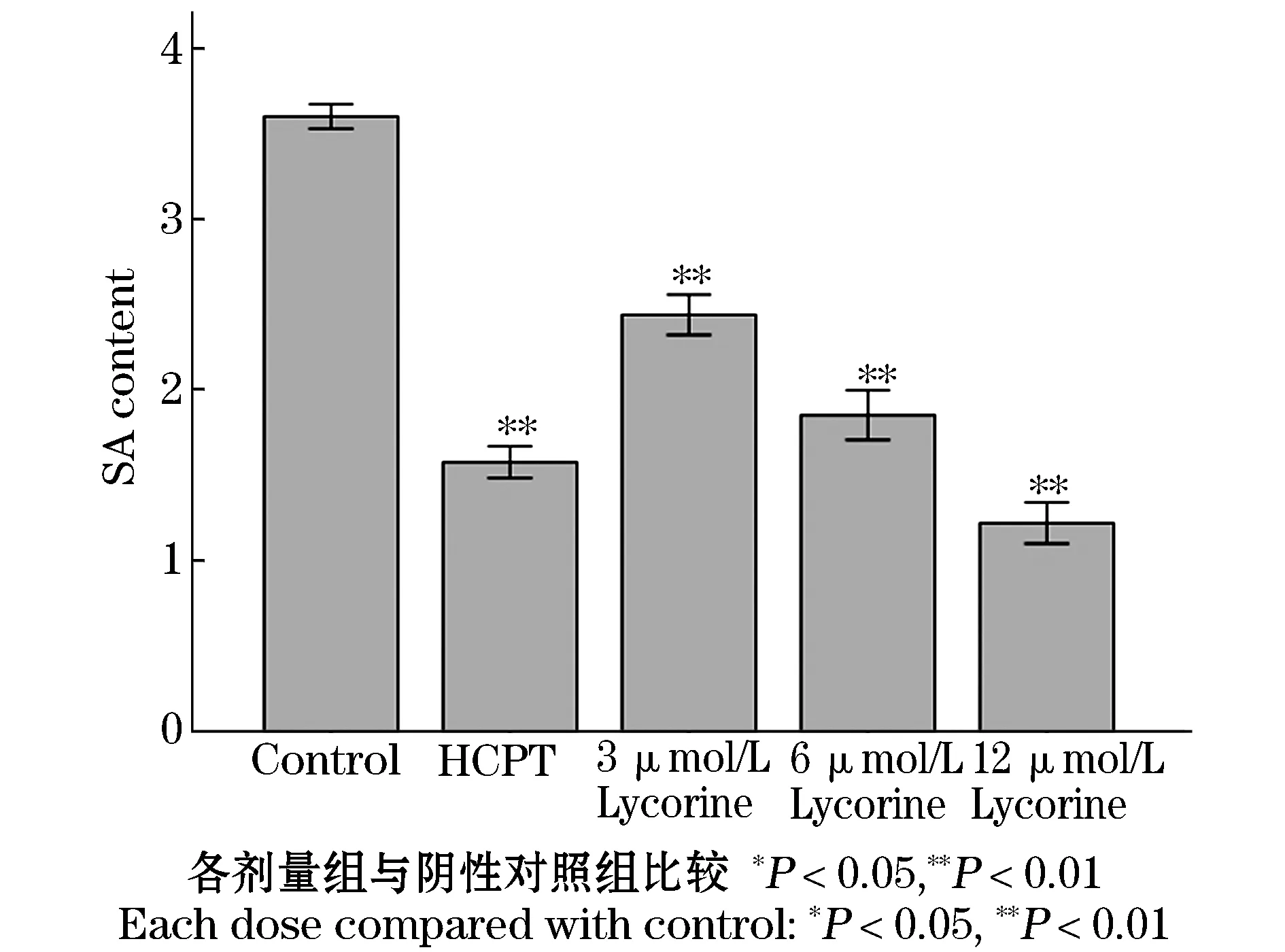
图6 石蒜碱对人肿瘤细胞膜唾液酸的影响
4.7 石蒜碱作用HepG-2肿瘤细胞膜胆固醇含量变化情况
石蒜碱作用人肝癌HepG-2细胞48 h后,检测肿瘤细胞膜含胆固醇量变化情况,结果发现阳性对照羟基喜树碱组肿瘤细胞膜含胆固醇量为(3.119±0.080)mol/L,阴性对照组肿瘤细胞膜含胆固醇量为(5.903±0.082)mol/L,石蒜碱低、中、高剂量组,肿瘤细胞膜含胆固醇量分别为(5.459±0.053)mol/L,(4.230±0.048)mol/L,(3.084±0.055)mol/L,肿瘤细胞膜含胆固醇量随着石蒜碱给药浓度的增加而减少,且与剂量呈负相关性,各给药组肿瘤细胞膜含胆固醇量与阴性对照组比较具有显著性差异,有统计学意义(P<0.01).见表5,图7.
表5 石蒜碱对肿瘤细胞膜含胆固醇量的影响

图7 石蒜碱对肿瘤细胞膜胆固醇含量的影响
4.8 石蒜碱作用HepG-2肿瘤细胞膜流动性的变化情况
石蒜碱作用人肝癌HepG-2细胞48 h后,检测肿瘤细胞膜流动性变化情况,结果发现阳性对照羟基喜树碱组肿瘤细胞膜流动性为4.087±0.352,阴性对照组肿瘤细胞膜流动性为5.533±0.462,石蒜碱低、中、高剂量组,肿瘤细胞膜流动性分别为4.738±0.243,4.110±0.193,3.464±0.142,肿瘤细胞膜流动性随着石蒜碱给药浓度的增加而降低,且与剂量呈负相关性,各给药组肿瘤细胞膜流动性与阴性对照组比较具有显著性差异,有统计学意义(P<0.01).见表6,图8.
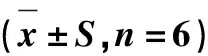
表6 石蒜碱对人肿瘤细胞膜的流动性的影响

图8 石蒜碱对细胞膜流动性的影响
4.9 石蒜碱作用HepG-2肿瘤细胞膜封闭度的变化情况
石蒜碱作用人肝癌HepG-2细胞48 h后,检测肿瘤细胞膜封闭度变化情况,结果发现阳性对照羟基喜树碱组肿瘤细胞膜封闭度为(14.18±0.56)%,阴性对照组肿瘤细胞膜封闭度为(20.09±0.11)%,石蒜碱低、中、高剂量组,肿瘤细胞膜封闭度分别为(17.59±0.24)%,(14.29±0.33)%,(6.28±0.28)%,肿瘤细胞膜封闭度随着石蒜碱给药浓度的增加而降低,且与剂量呈负相关性,各给药组肿瘤细胞膜封闭度与阴性对照组比较具有显著性差异,有统计学意义(P<0.01).见表7,图9.
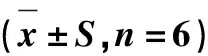
表7 石蒜碱对肿瘤细胞膜封闭度的影响
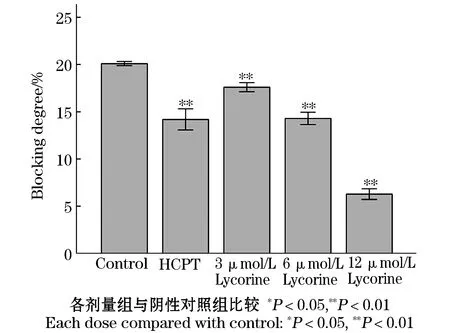
图9 石蒜碱对人肝癌HepG-2细胞膜封闭度的影响
4.10 石蒜碱对HepG-2肿瘤细胞膜Na+,K+-ATPase活性的影响
实验结果表明,阴性对照组肿瘤细胞膜Na+,K+-ATPase活性为(9.635±0.080)μmol/mg/h,石蒜碱低、中、高给药组Na+,K+-ATPase活性分别为(6.494±0.041)μmol/mg/h,(3.913±0.048)μmol/mg/h,(1.632±0.030)μmol/mg/h;阳性对照组Na+,K+-ATPase活性为(3.521±0.073)μmol/mg/h.石蒜碱各给药组与阴性对照组比较,差异显著(P<0.01).结果说明,石蒜碱可以降低肿瘤HepG-2细胞膜Na+,K+-ATPase活性,肿瘤细胞阳离子通道活性降低使细胞内外物质交换受阻,肿瘤细胞代谢发生紊乱.见表8,图10.
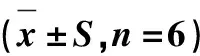
表8 石蒜碱对肿瘤细胞膜ATP酶活性的影响

图10 石蒜碱对肿瘤细胞膜ATP酶活性的影响
4.11 石蒜碱对肿瘤细胞膜阳离子通道Ca2+,Mg2+-ATPase活性的影响
结果显示,阴性对照组肿瘤细胞膜Ca2+,Mg2+-ATPase活性为(2.816±0.024)μmol/mg/h,石蒜碱低、中、高给药组Ca2+,Mg2+-ATPase活性分别为(2.271±0.055)μmol/mg/h,(1.277±0.033)μmol/mg/h,(0.341±0.035)μmol/mg/h.阳性对照组Ca2+,Mg2+-ATPase活性为(0.764±0.030)μmol/mg/h.石蒜碱各给药组与阴性对照组比较,差异显著有统计学意义(P<0.01).见表9,图11.

表9 石蒜碱对肿瘤细胞膜ATP酶活性的影响

图11 石蒜碱对肿瘤细胞膜ATP酶活性的影响
5 讨 论
我国有丰富的石蒜属野生品种,在石蒜碱的开发利用上占据一定优势[11].目前,针对石蒜碱的药理活性及作用机制的研究取得了长足的进展.近年来有研究表明,石蒜碱对多种肿瘤有抑制作用[12-13].多细胞生物的细胞增殖和死亡平衡使机体处于稳态[14].而细胞的死亡形式有多种,包括坏死、凋亡、自噬等等.凋亡是生理条件下机体维持稳态的重要机制[15].肿瘤细胞的无限增殖与凋亡异常密切相关[16].上述实验说明,石蒜碱对人肝癌HepG-2细胞具有抗肿瘤作用[17],并且石蒜碱可通过降低肿瘤细胞膜表面的含总蛋白量、唾液酸浓度以及含总胆固醇量,导致肿瘤细胞膜的组成结构发生改变,破坏细胞膜完整性[18],主要表现为肿瘤细胞膜流动性、膜封闭度显著降低,由于肿瘤细胞膜的主要组成成分含量的下降及基本膜结构功能的改变,导致肿瘤细胞膜表面离子通道 Na+,K+-ATP酶活性、Ca2+,Mg2+-ATP酶活性降低[19],从而改变了肿瘤细胞膜与细胞外环境间进行的物质交换,肿瘤细胞内外信号转导受阻,胞内离子环境失衡,这些变化进一步会干扰肿瘤细胞膜内外能量传递,导致肿瘤细胞膜功能障碍而引起肿瘤发生凋亡[20].
