多酶催化制备海藻糖及分离提取工艺优化
2021-06-23宋龙祥张欣宜刘洪玲王腾飞
宋龙祥,张欣宜,王 冲,刘洪玲,王腾飞
齐鲁工业大学(山东省科学院) 生物基材料与绿色造纸国家重点实验室,济南 250353
海藻糖是由两个α-D-葡萄糖通过α,α-1,1-葡萄糖苷键形成的非还原性双糖[1]。海藻糖广泛存在于动物、植物、微生物体内[2]。海藻糖具有理化性能稳定、无色无臭、口感略甜、热值低、不易焦糖化、保护生物大分子活性等特性,在疫苗、药品、食品、生物大分子的保护剂等方面具有广泛的应用价值[3-5]。
双酶转化法是以淀粉或麦芽糊精为底物,利用麦芽寡糖基海藻糖合成酶(maltooligosyl trehalose synthase,MTSase)和麦芽寡糖基水解酶(maltooligosyl trehalose trehalohydrolase,MTHase)转化为海藻糖[6-8]。双酶法具有转化率高、操作简单等特点。但酶转化液中含有大量的中间转化产物,如葡萄糖、麦芽糖、麦芽寡糖等[9]。制备高纯度食品级或医药级海藻糖必须去除酶转化液中的中间产物。膜分离技术是利用具选择透过特性的过滤介质对物质进行分离纯化的技术,具有高效、低耗、环保、操作条件温和、可连续操作等特点,广泛应用在食品多糖生产中,如魔芋寡糖[10]、山梨醇[11]、赤藓糖醇[12]、猴头菇多糖[13]等产品的分离提纯和浓缩中。
利用MTSase和MTHase双酶法转化制备海藻糖粗糖液,将获得的海藻糖粗糖液经糖化酶糖化后,再通过陶瓷膜组件、超滤膜组件、活性炭脱色等预处理,最后用MWCO 250纳滤膜组件将海藻糖和葡萄糖进行分离获得海藻糖糖液。通过探究海藻糖转化优化、纳滤分离的工艺条件,为海藻糖的制备与分离纯化奠定基础。
1 材料与方法
1.1 材料与试剂
糖化酶、普鲁兰酶:诺维信(中国)生物技术有限公司;MTSase和MTHase酶液:本实验室所有;乙腈:上海星可高纯溶剂有限公司;麦芽糊精(DE 8.0):本实验室制备。
1.2 仪器与设备
卷式膜多功能小设试备:厦门福美科技有限公司;复合卷式纳滤膜MWCO 250.00:美国GE公司;安捷伦液相色谱仪:安捷伦(中国)公司。
1.3 检测方法
海藻糖的检测:葡萄糖和海藻糖的浓度由HPLC检测[14]。色谱柱:NH2键合相柱(5 μm,250 mm×4.6 mm);流动相:V(乙腈)∶V(水)=3∶1;流速:1 mL/min;柱温:40 ℃;检测器:示差折光检测器(RID-10A),检测池温:40 ℃。
1.4 实验方法
1.4.1 海藻糖转化优化
以20%的麦芽糊精(DE 8.0)为底物,探究普鲁兰酶添加量(0~20 U/g)、温度(50~70 ℃)、pH(4.5~7.5)、MTSase(65~115 U/g)和MTHase(25~65 U/g)添加量、转化时间以及糖化酶处理对海藻糖转化率的影响。
1.4.2 纳滤膜过滤工艺
糖化结束后升温终止酶解反应;经过0.2 μm孔径的陶瓷膜组件和超滤膜组件进行过滤,去除大分子蛋白、可溶性蛋白和大分子多聚糖,获得海藻糖粗糖液;海藻糖粗糖液经过离子交换、活性炭进行脱色,去除色素。经预处理后的海藻糖粗糖液在料液泵的动力下,将料液罐中的海藻糖粗糖液连续的送入纳滤膜,以膜内和膜外压力差为推动力,葡萄糖不断从透过液中排出,海藻糖经循环进入料液罐中。纳滤膜分离海藻糖工艺流程如图1所示。
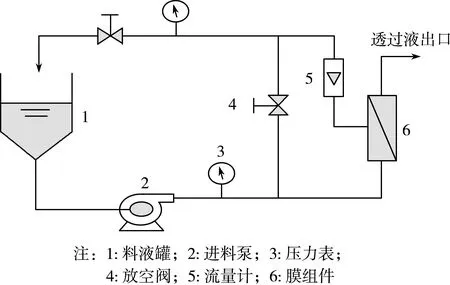
图1 纳滤膜分离海藻糖工艺流程图
1.4.2.1 浓缩体积和加水体积对海藻糖分离影响
利用复合卷式纳滤膜MWCO 250.00在卷式膜多功能过滤设备中进行过滤,控制过滤压力为20 bar,流速为5.5 L/min,过滤液温度为30 ℃,分别探究浓缩倍数(1~3倍)和加水体积(1~5倍)对平均膜通量、海藻糖回收率和海藻糖纯度的影响。
1.4.2.2 操作方式对膜分离性质影响
由于间歇式过滤存在操作困难、控制精确度低、操作可重复性和连续性差等问题。因此,在上述优化浓缩体积和加水量的基础上,利用连续式过滤代替间歇式过滤方式,探究连续式过滤的操作方式对海藻糖分离过程中的操作时间、海藻糖回收率、海藻糖纯度的影响。
2 结果与分析
2.1 双酶法转化制备海藻糖
2.1.1 普鲁兰酶添加量对海藻糖转化影响
MTSase和MTHase只能作用于直链麦芽糊精,然而淀粉中含有较多的支链淀粉,由于支链淀粉不能被利用,导致麦芽糊精的利用率降低。因此,在转化过程中添加普鲁兰酶,通过水麦芽糊精中的α-1,6-糖苷键,将含有支链的麦芽糊精水解,转化成为只含有 α-1,4-糖苷键的直链糊精,从而提高底物利用效率。如图2所示,不添加普鲁兰酶时海藻糖转化率为47.8%,添加普鲁兰酶后海藻糖转化率提高到55.6%。因此,普鲁兰酶的添加有效提高了底物的利用效率;但随着普鲁兰酶量的增加,转化率趋于稳定,这是由于较多的支链糊精被水解,普鲁兰酶的去支链的能力达到饱和。因此普鲁兰酶最佳添加量为5 U/g麦芽糊精。
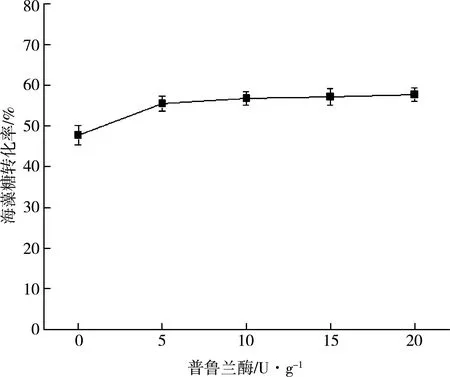
图2 普鲁兰酶添加对海藻糖转化的影响
2.1.2 温度对海藻糖转化的影响
温度不仅影响麦芽糊精的物理状态和分子运动,也会影响酶学性质[15]。在上述优化结果基础上,探究不同温度对海藻糖转化的影响。如图3所示,当温度低于60 ℃时,海藻糖转化率随温度升高而逐渐增加;60 ℃时,海藻糖转化率最大为60.2%;当温度继续升高时,海藻糖转化率逐渐下降,这是由于随着温度的升高,酶的稳定性降低导致酶活损失,使转化率下降。因此海藻糖最适转化温度为60 ℃。

图3 温度对海藻糖转化的影响
2.1.3 pH对海藻糖转化的影响
pH影响酶的酶活和底物的解离状态,进而影响催化效率[16]。因此在上述研究结果的基础上,探究不同pH对海藻糖转化的影响。如图4所示,当pH低于6.0时,海藻糖转化率随pH增加而升高,pH为6.0时转化率最大为62.7%;当pH继续增加时转化率逐渐下降。因此海藻糖最佳转化pH为6.0。

图4 pH对海藻糖转化的影响
2.1.4 MTSase和MTHase添加量对海藻糖转化的影响
酶量添加是影响转化效率的重要因素之一,特别是在协同催化的多酶反应中具有重要的影响。酶的添加比例不仅影响转化产物的成分,同时加酶量也决定生产成本。在上述研究的基础上,探究MTSase和MTHase不同添加比例对海藻糖转化率的影响。如图5所示,随着MTHase添加量逐渐增加,海藻糖转化率逐渐提高;当MTHase添加量为95 U/g时,海藻糖转化率相对较高;当MTHase添加量高于35 U/g时,由于MTSase水解麦芽糊精底物能力逐渐增加,造成海藻糖转化率降低;当MTSase和MTHase添加量分别为95 U/g麦芽糊精和35 U/g麦芽糊精时达到最大转化率为72.4%。
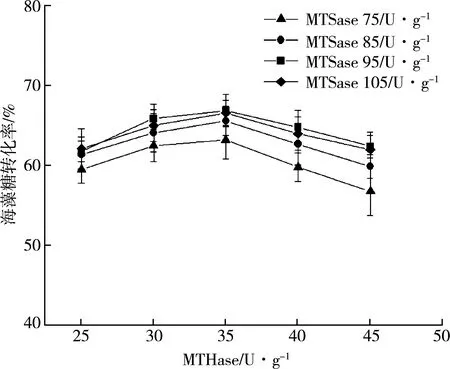
图5 MTSase和MTHase添加量对海藻糖转化影响
2.1.5 转化时间对海藻糖转化率影响
转化时间决定转化周期,影响设备的利用率,因此需要控制最佳转化时间。在上述研究的基础上,探究转化时间对海藻糖转化的影响。如图6所示,在16 h之前,海藻糖转化率迅速增加。16~48 h时转化率缓慢增加;48 h后转化率趋于平稳。因此,在保证最大转化率的基础上,确定转化时间为48 h。

图6 转化时间对海藻糖转化率影响
2.1.6 糖化酶的添加对海藻糖粗糖液成分影响
在海藻糖转化结束后,海藻糖转化液中除了含有大量海藻糖外,还含有少量的麦芽糖和麦芽寡糖等。为了制备获得高纯度的海藻糖,在海藻糖转化结束后,向海藻糖转化液中添加糖化酶,将海藻糖粗糖液中的麦芽糖、麦芽寡糖等水解为葡萄糖,便于后续的分离纯化。在上述研究的基础上,探究糖化酶的添加对海藻糖粗糖液成分的影响。如图7所示,经糖化处理后,海藻糖糖液中的麦芽糖和麦芽寡糖分别由7.7%和3.1%降低到0.5%和0.3%,并且研究发现海藻糖的浓度增加了2.3%,海藻糖最终转化率为74.7%。
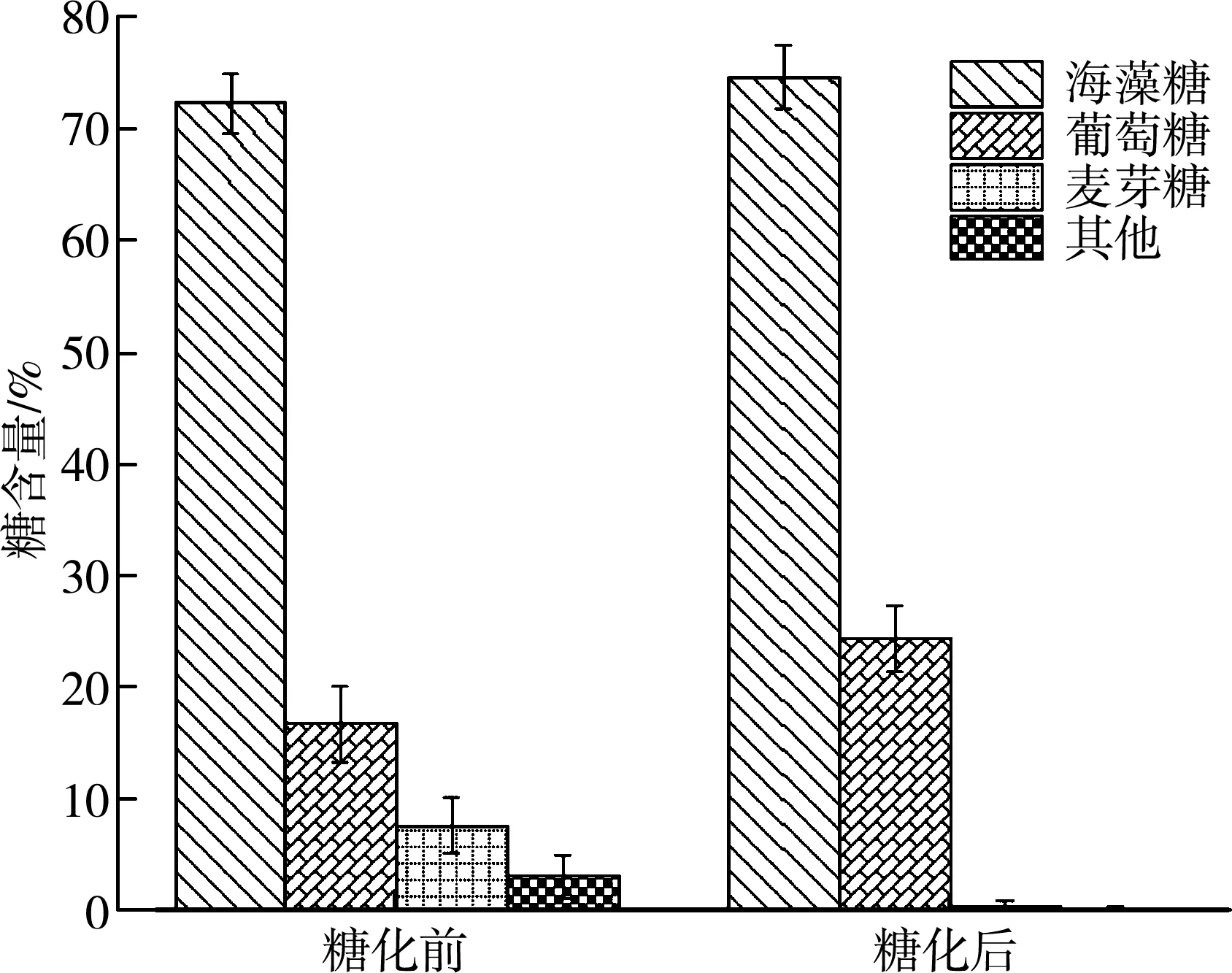
图7 糖化酶的添加对海藻糖粗糖液成分影响
2.2 浓缩体积和加水倍数对海藻糖分离的影响
将转化、糖化、微滤、超滤、脱色后的海藻糖粗糖液进行纳滤分离,控制纳滤压力为20 bar,流速为5.5 L/min,过滤液温度为30 ℃,探究复合卷式纳滤膜对海藻糖分离的影响。其中图8为不同浓缩倍数和加水倍数对膜通量的影响;图9为不同浓缩倍数和加水倍数对海藻糖回收率的影响;图10为不同浓缩倍数和加水倍数对海藻糖纯度的影响。

图8 浓缩倍数和加水倍数对膜通量影响

图9 浓缩倍数和加水倍数对海藻糖回收率影响
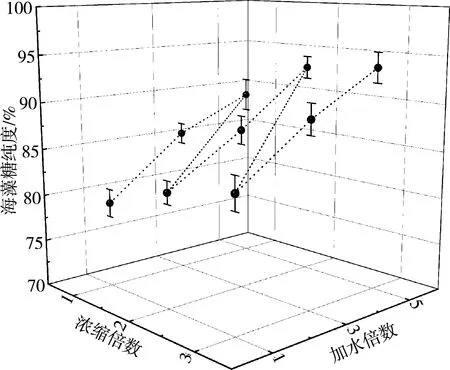
图10 浓缩倍数和加水倍数对海藻糖纯度影响
当浓缩倍数相同时,加入水倍数越多,膜的平均通量越大,海藻糖的纯度越高,但回收率逐渐减少,这是由于加水倍数的增加使得纳滤时间变长,造成海藻糖损失增加;当加水倍数一定时,随着浓缩倍数的增加,平均通量和海藻糖的回收率逐渐降低,海藻糖的纯度缓慢增加,随着浓缩倍数的增加料液变得粘稠,膜通量急剧降低,这种状态不利于海藻糖的分离。综合考虑平均膜通量、海藻糖回收率、海藻糖纯度等因素,当海藻糖浓缩倍数为2,加水倍数为原倍数的5倍时,平均膜通量为9.64 L·(m2·h),海藻糖回收率为87.8%,海藻糖糖液纯度为93.1%,该条件下的平均膜通量、海藻糖回收率、海藻糖纯度以及用水量最佳。
2.3 操作方式对膜分离性质的影响
间歇过滤操作工艺繁琐,过滤过程容易造成膜通量的波动。因此,为简化操作工艺,选择操作便捷的连续式过滤进行海藻糖的分离。在海藻糖浓缩倍数为2,加水量为原倍数的5倍时,探究间歇式和连续式过滤的效率。如图11所示,当浓缩倍数相同时,连续式过滤操作的时间、海藻糖回收率、海藻糖纯度均优于间歇式过滤;但随着浓度倍数增加,过滤时间增加,海藻糖的回收率降低,因此综合考虑操作时间、加水倍数、海藻糖回收率和海藻糖纯度等因素,选用连续式操作方式更为经济有效。
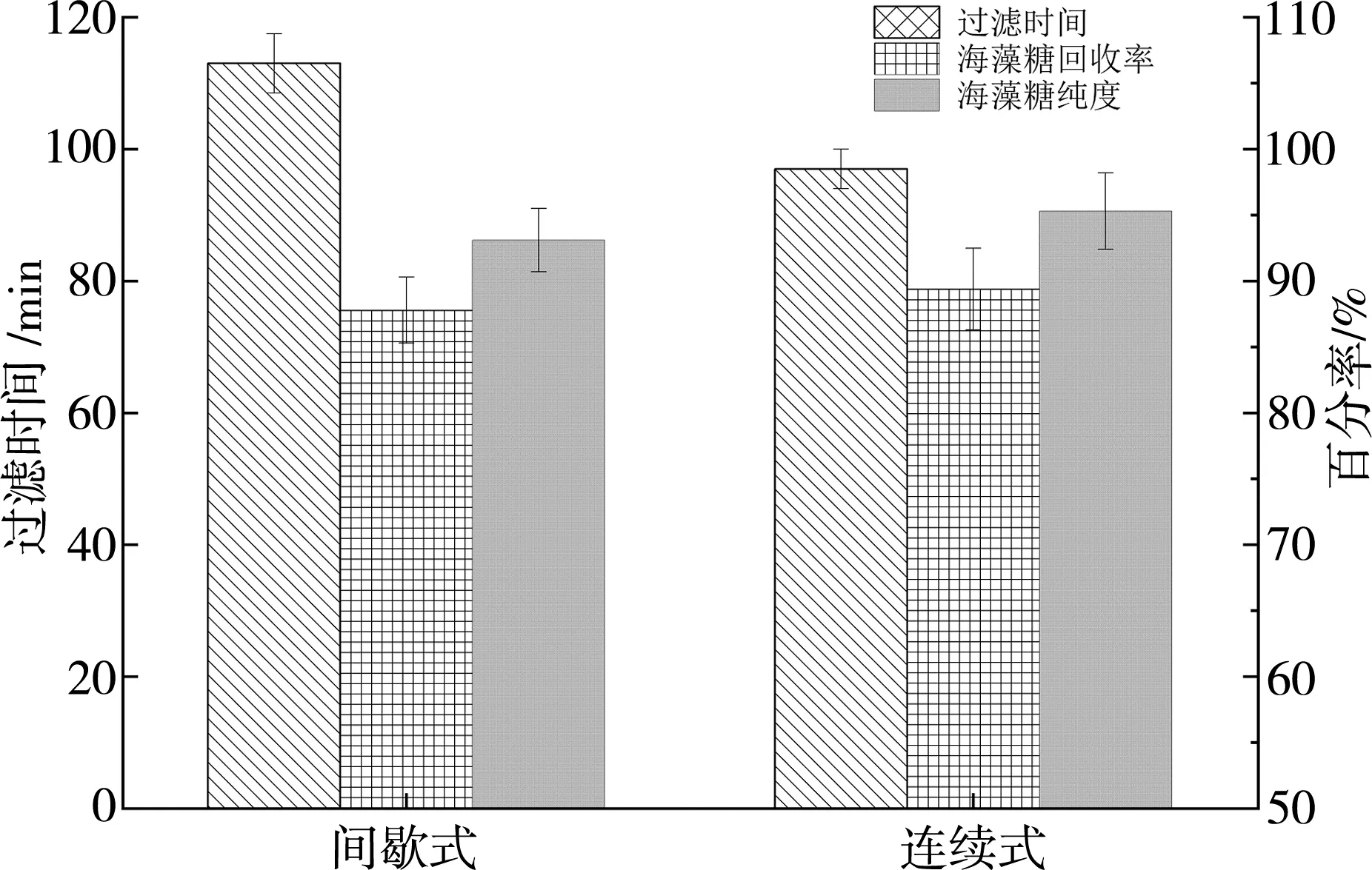
图11 操作方式对海藻糖分离的影响
3 结 论
通过研究发现,以200 g/L麦芽糊精为底物,添加普鲁兰酶5 U/g、麦芽糊精、MTSase 95 U/g麦芽糊精、MTHase 35 U/g麦芽糊精,转化温度60 ℃,pH 6.0,转化48 h,海藻糖转化率由47.8%提高到72.4%。海藻糖粗糖液经过糖化、微滤、超滤、脱色后去除蛋白、寡糖、色素等大分子物质进行纳滤分离,结果表明连续式复合卷式纳滤膜分离海藻糖的最佳浓缩体积和加水倍数分别为2倍和5倍,海藻糖的回收率为87.8%和海藻糖糖液纯度为93.1%。
