棘胸蛙染色体核型分析
2021-06-22龙嘉航侯金亮周文向建国潘望城
龙嘉航 侯金亮 周文 向建国 潘望城

摘要 [目的]为棘胸蛙的细胞遗传学研究奠定基础,并为棘胸蛙的遗传组成分析提供理论参考。[方法]以湖南省石门棘胸蛙为试验材料,腹腔注射秋水仙素,取其骨髓细胞,进行低渗、固定,采用空气干燥法制片,吉姆萨染液染色,观察棘胸蛙染色体核型和特征。[结果]棘胸蛙染色体数目为2n=26,占所观察分裂相总数的88.33%;核型公式为2n=26(4sm+9m),没有发现随体和次缢痕。[结论]湖南石门棘胸蛙没有异形性染色体。棘胸蛙染色体核型存在地域差异(种间差异)。
关键词 棘胸蛙;染色体;核型
中图分类号 S917.4 文献标识码 A 文章编号 0517-6611(2021)09-0095-03
doi:10.3969/j.issn.0517-6611.2021.09.024
Abstract [Objective] To lay the foundation for the cytogenetic research of Quasipaa spinosa and provide theoretical references for the genetic composition analysis of Q. spinosa.[Method] Q. spinosa in Shimen of Hunan Province was used as test materials to make intraperitoneal injection of colchicine. The bone marrow cells were collected to make hypotonic treatment and fixation. The slices were prepared by using air-drying method and stained by Giemsa staining method.The chromosome karyotype and characteristics of Q. spinosa were observed. [Result] The chromosome number of Q. spinosa was 2n=26,which took 88.33% of all observed mitotic metaphases.The karyotypic formula of Q. spinosa was 2n=26(4sm+9m).No satellite or subconstriction was found. [Conclusion] There was no heteromorphic sex chromosome in Q. spinosa in Shimen of Hunan Province. The karyotype of Q. spinosa had regional differences(interspecies differences).
Key words Quasipaa spinosa;Chromosome;Karyotype
棘胸蛙(Quasipaa spinosa)隶属两栖纲无尾目新蛙亚目叉舌蛙科棘蛙属,其中大多数种确认分布在中国和越南[1]。棘胸蛙是流水穴居生活型蛙类,喜静怕噪,常昼伏夜出[2]。棘胸蛙自然资源日益减少,目前被世界自然保护联盟(International Union for the Conservation of Nature,IUCN)红色名录和中国物种红色名录定为易危物种[3-4]。棘胸蛙肉质鲜嫩,必需氨基酸含量高,具有强壮滋补的药用价值,其市场前景广阔。
染色体是遗传信息的载体,研究两栖类的染色体,对于探讨两栖类的遗传、变异及进化具有一定的意义[5-6]。目前,国内外对棘胸蛙的研究主要围绕种质资源调查[7-8]、功能基因克隆[9-10]、疾病[11-12]等方面。许多学者对不同地理居群的棘胸蛙进行了染色体核型分析,未发现雌雄间存在核型差异[13-15]。
笔者采用骨髓细胞冷滴片法,比较了湖南石门县棘胸蛙雌雄个体的染色体核型,以期丰富棘胸蛙细胞遗传学信息,并为棘蛙属系统演化提供基础数据。
1 材料与方法
1.1 试验材料
试验所用棘胸蛙均于2019年12月13日在湖南渔欣味农业科技有限公司石门县石蛙养殖场采集。选取体形匀称、健康、活力好、性成熟的雌、雄棘胸蛙各5只,成熟雄蛙胸部具有黑色刺疣,成熟雌蛙腹部光滑,体重为70~100 g。
1.2 染色体标本的制备
将棘胸蛙在试验前停止投喂,在20 ℃左右环境下暂养3 d。于蛙腹腔注射秋水仙素,剂量为10 μg/g(蛙体重)。注射秋水仙素4 h后采用双毁髓法(延髓和脊髓)处死棘胸蛙。将股骨和腿肌肉分离,取股骨,剪去骨头两端,使用0.65%生理盐水反复冲洗骨髓至烧杯中。用镊子夹碎骨髓,吸取烧杯中的上清液至1.5 mL离心管中(注意不要吸取杂质),离心并弃去上清液,加入1.5 mL的0.34%KCl,混匀。37 ℃下水浴低渗30 min。离心得到沉淀物后加入0.3 mL固定液,轻轻弹散打匀沉淀,37 ℃下放置10 min,离心后弃去上清液。往离心管中加入1.5 mL卡诺氏固定液(甲醇∶乙醇=3∶1,现配现用)固定3次(10、15、15 min),固定后離心,弃去固定液。4 000 r/min,离心5 min。
往离心管中加入少量固定液,用200 μL移液枪将离心管内的细胞沉淀吹散打匀,直至呈白色云雾状,在预冷载玻片滴片。玻片自然晾干后,用吉姆萨染液染色30 min后取出,用超纯水冲去浮色。
1.3 核型分析
通過显微镜观察,并选取分散良好的分裂相进行拍照保存(1 000倍)。雌雄个体各选55个良好的中期分裂相进行观察计数,统计染色体数目。对分裂相中各染色体的长臂、短臂进行测量,计算染色体的相对长度和臂比值,结果均以平均值±标准差表示。参照Levan等[16]的标准对染色体进行命名和划分,大型染色体的相对长度大于8%,小型染色体的相对长度小于7%。相对长度=单个染色体长度/染色体组总长×100%,臂比值=长臂长/短臂长。
2 结果与分析
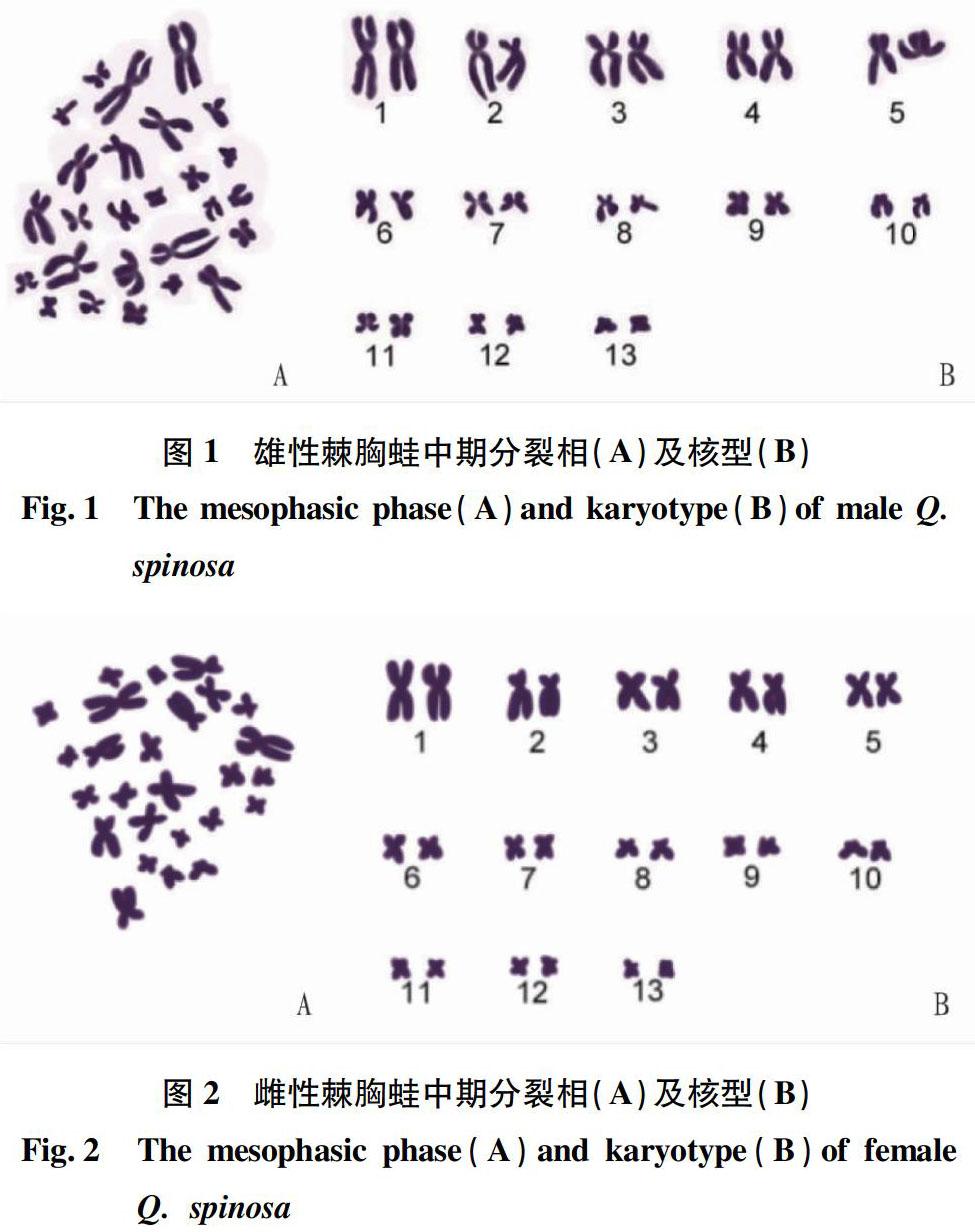
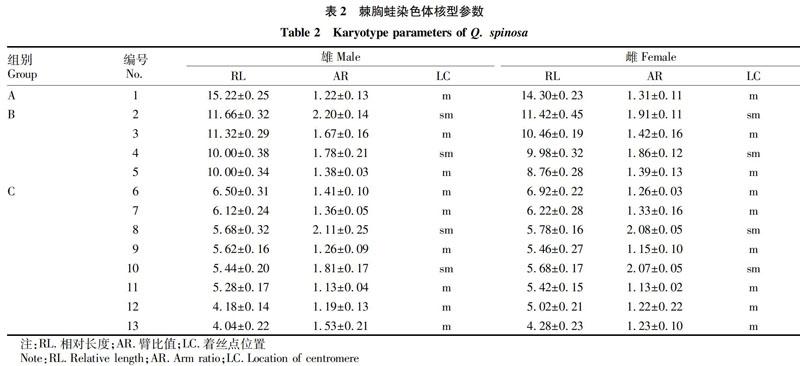
经镜检共发现60个染色体分散良好的分裂相,并进行统计。结果显示,染色体数目为26的有55个,占比88.33%,故确定棘胸蛙染色体数目2n=26(表1)。石门县棘胸蛙个体体细胞的染色体众数均为26,有13对染色体,分别由5对大染色体和8对小染色体组成,无随体和次缢痕。将它们按大小排序,见图1~2。
雌雄各选取10个数目完整、形态清晰的中期分裂相进行观察和测量,并计算其相对长度和臂比,结果见表2。根据计算结果,可将棘胸蛙核型分为3组:①A组(No.1)。No.1为棘胸蛙染色体中最大的一对中部着丝粒染色体。②B组(No.2~5)。No.2、4为亚中部着丝粒染色体,No.3为中部着丝粒染色体。③C组(No.6~13)。此8对染色体相对长度较小,No.8、10为亚中部着丝粒染色体,其余为中部着丝粒染色体,No.13为相对长度最小的一对染色体。No.1~5为大型染色体,No.6~13为中小型染色体。湖南石门县棘胸蛙核型公式为2n=26(4sm+9m);未发现异形性染色体、随体和次缢痕(图1)。
3 讨论
两栖动物在脊椎动物中具有“承上启下”的进化地位。据报道,我国已有100多种两栖类染色体核型的研究资料[17];国外有1 000多种两栖类的染色体核型被研究分析,且超过96%的两栖动物未发现异形性染色体[18]。不适当的秋水仙素浓度和处理时间会导致染色体标本效果差[19]。该研究通过参考一些无尾目物种的染色体标本制备方法[20-21],确定合适的秋水仙素的处理时间与浓度等试验条件。
石门县棘胸蛙核型公式为2n=26(4sm+9m),这与吴昌谋等[15]报道的广西资源县棘胸蛙的核型公式相一致,但与其3、6、9号染色体为亚中部着丝粒染色体类型不一致;这与郑秀梅等[14]报道的福建省福州市郊区棘胸蛙核型中的3、6、9、12号染色体为亚中部着丝粒染色体不一致;这与李炳华等[13]报道的安徽黄山及九华山棘胸蛙核型中3、9号染色体为亚中部着丝粒染色体不一致。
迄今为止,棘属中已进行核型分析并进行雌雄核型比较的约20种,且并未发现异形性染色体。两栖动物性染色体同形性可能是由高频转换、偶然重组、染色体重排等机制维持[22]。棘蛙属物种间核型数目变化较大,以2n=26为主(表3)。棘蛙属分支内物种染色体数目增多,可能是由着丝点分离所致。染色体数目多,具有较多端部着丝粒和小染色体的核型是两栖类原始核型状态,2n=26可能是高等无尾类的原始核型[23]。无声囊棘蛙和双团棘胸蛙拥有特殊的2n=64,且全部为t型染色体。此核型是否为迄今发现最原始的核型,还是次生分离导致并未确定。从现有资料来看,棘肛蛙2n=40很可能是棘蛙属次生分离过程中2n=26到2n=64的过渡物种,具有2条t型染色体。棘蛙属可能存在更多的过渡核型尚未发现。
通过比较湖南、广西、福建、安徽等地的棘胸蛙核型结果发现,棘胸蛙核型存在地理差异。导致核型地理差异的原因有3种:①种内核型多态化现象,可能是由遗传多样性所致;②棘胸蛙活动空间小,由于地理纬度的不同,出现地理隔离之后种群间基因交流减少,加上不同环境条件的影响,使得不同地区的棘胸蛙核型出现差异分化;③目前研究的技术水平局限和差别所致。通过对棘蛙属不同物种以及不同地理类群间的分析比较,探究其染色体分化因素,对于完善两栖类核型进化理论上具有重要意义。
参考文献
[1] XIANG J G,HE T Y,WANG P P,et al.Opportunistic pathogens are abundant in the gut of cultured giant spiny frog(Paa spinosa)[J].Aquaculture research,2018,49(5):2033-2041.
[2] 彭英海,周先文,熊钢,等.棘胸蛙的繁殖及生物学特性研究进展[J].江西水产科技,2017(1):47-48.
[3] CHAN H K,SHOEMAKER K T,KARRAKER N E.Demography of Quasipaa frogs in China reveals high vulnerability to widespread harvest pressure[J].Biological conservation,2014,170:3-9.
[4] LONG J H,XIANG J G,HE T Y,et al.Gut microbiota differences during metamorphosis in sick and healthy giant spiny frogs(Paa spinosa)tadpoles[J].Letters in applied microbiology,2020,70(2):109-117.
[5] FLAMENT S.Sex reversal in Amphibians[J].Sexual development,2016,10(5/6):267-278.
[6] JEFFRIES D L,LAVANCHY G,SERMIER R,et al.A rapid rate of sex-chromosome turnover and non-random transitions in true frogs[J].Nature communications,2018,9(1):1-11.
[7] 詹忠根,刘悦,黄伟素,等.棘胸蛙种质资源研究进展[J].中国农学通报,2016,32(2):77-81.
[8] 张小伟,周昌和.龙泉市野生棘胸蛙资源现状调查与保护对策[J].华东森林经理,2016,30(2):38-41.
[9] 徐学清,刘文君.双团棘胸蛙皮肤胸腺肽-β4的基因克隆及活性检测[J].中国药理学通报,2015,31(2):237-241.
[10] HU W F,DONG B J,KONG S S,et al.Pathogen resistance and gene frequency stability of major histocompatibility complex class IIB alleles in the giant spiny frog Quasipaa spinosa[J].Aquaculture,2017,468:410-416.
[11] LEI X P,YI G,WANG K Y,et al.Elizabethkingia miricola infection in Chinese spiny frog(Quasipaa spinosa)[J].Transboundary and emerging diseases,2019,66(2):1049-1053.
[12] 李明,宋婷婷,郑荣泉,等.棘胸蛙歪头病病原分离·鉴定与药敏试验[J].安徽农业科学,2016,44(3):64-66,98.
[13] 李炳华,汪尊德.棘胸蛙的染色体组型分析[J].遗传,1983,5(5):39-41.
[14] 郑秀梅,洪怡莎.虎纹蛙(Rana tigrinarugulosa Wiegmann)棘胸蛙(Rana spinosa David)的染色体组型[J].四川动物,1984,3(2):33-36.
[15] 吴昌谋,陈志坚,王秉新.桂林棘胸蛙染色体的组型[J].广西师范大学学报(自然科学版),1990,8(1):73-77.
[16] LEVAN A,FREDGA K,SANDBERG A A.Nomenclature for centromeric position on chromosomes[J].Hereditas,1964,52(2):201-220.
[17] 庞启平,叶英,温业棠.中国两栖动物染色体研究名录[J].动物学杂志,2002,37(4):49-62.
[18] EGGERT C.Sex determination:The amphibian models[J].Reproduction,nutrition,development,2004,44(6):539-549.
[19] 梁述章,宋炜,蒋科技,等.棘头梅童鱼染色体核型分析[J].渔业科学进展,2019,40(4):172-177.
[20] 高文,林芳.福建宁德泽陆蛙染色体组型与银染的研究[J].宁德师范学院学报(自然科学版),2014,26(3):259-262.
[21] CHANG S P,MA G C,CHEN M,et al.Species and sex comparisons of karyotype and genome size in two Kurixalus tree frogs(Anura,Rhacophoridae)[J].Acta herpetologica,2017,12(2):139-150.
[22] 龍嘉航,张浓,谢新民,等.两栖动物性染色体的多样性及其进化机制的研究进展[J].动物学杂志,2020,55(4):532-539.
[23] 李树深.两栖动物的染色体及其演化[J].动物学杂志,1991,26(2):47-52.
[24] 陈文元,王子淑,王喜忠,等.四川六种蛙染色体组型的比较研究[J].动物学研究,1983,4(1):83-88.
[25] 李树深,胡健生.中国几种棘蛙的核型C-带和Ag-NORs研究[J].动物学研究,1996,17(1):84-88.
[26] 张加一,谷晓明.水城棘腹蛙的核型和Ag-NORs研究[J].贵州师范大学学报(自然科学版),1997,15(2):48-51.
[27] 李树深,胡健生.福建九龙棘蛙和小棘蛙的核型和Ag-NORs研究[J].动物学杂志,1995,30(5):11-14.
[28] 高建民,叶冰莹,蔡明章.九龙棘蛙和棘胸蛙的染色体比较研究[J].福建师范大学学报(自然科学版),1991,7(4):84-89.
[29] 李树深,胡健生.云南三种同域分布的棘蛙(蛙科Ranidae:无尾目Anura)的核型和银带研究[J].动物学报,1994,40(3):317-323.
[30] 谭安鸣,吴贯夫.棘蛙群三种的核型及其染色体演化的初步探讨[J].两栖爬行动物学报,1987,6(4):38-39.
[31] 陈晓虹,夏中荣,陶立奎,等.3种隆肛蛙的核型分析[J].河南师范大学学报(自然科学版),2006,34(4):151-153.
[32] 杨玉华,赵尔亦,高正发.隆肛蛙的染色体组型[J].两栖爬行动物学报,1986,5(4):251-253.
[33] 刘万国,昝瑞光.蛙属中的一个特殊核型——双团棘胸蛙的核型及其C带和银带的研究[J].遗传学报,1984,11(1):61-64.
[34] 吴贯夫,赵尔必.无尾类中一种罕见的核型-双团棘胸蛙Rana Phrynoides的染色体组型[J] .两栖爬行动物学报,1984,3(1):29-32.
