犬细小病毒CPV-JL19株分离鉴定及遗传进化分析
2021-06-17由海波王全凯朱翔宇张海玲
由海波,胡 博,王全凯,刘 昊,朱翔宇,张海玲,白 雪,徐 超*
(1.中国农业科学院 特产研究所 农业农村部经济动物疫病重点实验室,吉林 长春 130112;2.吉林农业大学,吉林 长春 130118;3.佛山科学技术学院,广东 佛山 528000)
犬细小病毒(canine parvovirus,CPV)属于细小病毒科、细小病毒属,是家犬和多种野生食肉动物的常见病原[1]。CPV基因组由约5 200个核苷酸DNA分子组成,其中包含2个开放阅读框(ORF)。其中一个ORF通过选择性剪接相同的mRNA编码2个结构蛋白(VP1和VP2),另一个ORF编码2个非结构蛋白(NS1和NS2)。病毒衣壳为一个直径约为25 nm的二十面体,由6个VP1和54个VP2组成[2]。构成衣壳的主要蛋白是VP2,VP2中几个关键碱基和氨基酸的变化能够改变抗原特征和宿主范围。因此,目前大量研究均集中在VP2基因的进化,对非结构蛋白基因的研究有限[3]。并且与VP2基因序列相比,GenBank中可用的全基因序列相对较少。
1900年前后猫细小病毒(FPV)最早被发现,随后经过多年环境变化与病毒进化,1978年前后演化出可以感染犬的CPV。CPV和FPV之间的氨基酸变化影响VP2蛋白与宿主细胞转铁蛋白受体(TfR)的相互作用,可能有助于CPV与家犬TfR结合的能力,因此被认为是犬类宿主转移的决定因素[4-5]。在其出现不久后很快产生了两种不同的抗原变体。其中CPV-2a于1979年出现,在VP2中共出现5个氨基酸取代(Met87Leu,Ile101Thr,Ala300Gly,Asp305Tyr,Asn375Asp);另一个是在1984年出现的CPV-2b,在VP2中增加了一个单独的替代(Asn426Asp)[6]。随后,新的变体出现在世界各地,包括New CPV-2a和New CPV-2b,每个都有多种氨基酸取代[7]。2000年,在意大利发现了另一种新的抗原变异,其特征是Asp426Glu取代,称为CPV-2c[8]。相对于原始的CPV-2,CPV-2a、CPV-2b和CPV-2c的抗原变异型在犬中具有更高的致病性,并且宿主范围扩大[9]。CPV原始型(CPV-2)迅速被其抗原变异体所取代,其进化速度接近RNA病毒[10],对疾病诊断和流行病学有很大的影响。
由于CPV的遗传变异较快,目前的疫苗可能不能够提供全面的保护。因此,进一步探究当前分离鉴定的CPV流行株的遗传变异特性,为下一步制备有效的CPV疫苗提供适宜的疫苗株,这些对CPV的预防具有重要理论意义。本研究对吉林省长春市某动物医院分离到的1株CPV进行鉴定,解析其遗传变异规律及流行特性,为该地区CPV的预防、治疗及疫苗研究提供理论依据。
1 材料与方法
1.1 临床样品及细胞株临床样品为吉林省长春市某动物医院临床表现为细小病毒病的犬肛拭子,并在中国农业科学院特产研究所进行分析。猫肾传代细胞系(F81)由农业农村部经济动物疫病重点实验室保存。
1.2 主要试剂CPV单克隆抗体由农业农村部经济动物疫病重点实验室制备保存;荧光二抗购自Abcam公司;ExTaq聚合酶、dNTP、pMD18-T载体均购自TaKaRa公司;DNA提取试剂盒、胶回收试剂盒、DNA Marker均购自北京全式金生物技术有限公司。
1.3 病毒DNA提取与PCR鉴定取肛拭子浸泡液作为样品,参照基因组提取试剂盒说明书提取病毒DNA,采用CPV鉴定引物进行PCR检测。其引物序列P1:5′-GGATTTCTACGGGTACTTTC-3′;P2:5′-GGTGTGCCACTAGTTCCAGTAT-3′。P-CR扩增体系20 μL:模板1 μL,Ex Taq 1 μL,10×Ex Taq Buffer 2 μL,上、下游引物各1 μL,dNTP 1 μL,加ddH2O至20 μL。PCR扩增程序:94℃预变性4 min;94℃变性30 s,56℃退火30 s,72℃延伸90 s,共30个循环;72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳鉴定。
1.4 病毒分离与培养无菌取肛拭子置1.5 mL EP管中于灭菌PBS(pH 7.2)内浸泡48 h,反复冻融3次,4℃、10 000 r/min离心10 min,取上清,经0.22 μm 滤膜过滤后,采用同步接毒的方式,在含5%胎牛血清的MEM培养液培养的F81细胞中接入全部处理后的病料上清,同时设正常细胞对照,于35℃、5% CO2培养箱中培养,每日观察记录细胞是否出现拉丝、脱落等典型病变(CPE),继续盲传3~5代,-80℃保存。
1.5 病毒形态学鉴定取分离毒株第5代细胞培养物10 mL于超滤管内,8 000 r/min离心20 min,取10 μL浓缩病毒液用0.1%磷钨酸溶液进行电镜负染观察病毒的形态学特征。
1.6 血凝试验在96孔V型血凝板上,每孔加pH 7.2的PBS 25 μL;第1排孔加入25 μL病毒液,依次进行倍比稀释至11排孔并弃去25 μL,第12排孔为红细胞对照;向各孔补加PBS 25 μL,每孔加入1%猪红细胞悬液50 μL;将反应板轻轻振荡摇匀1 min,置4℃ 60 min,以100%凝集(完全无泪珠样流淌)的最高稀释倍数为血凝效价。
1.7 间接免疫荧光试验将F81细胞悬液铺在6孔板中,同步接毒分离株病毒,36 h后弃上清液,用PBS洗3次;加入4%多聚甲醛固定30 min,PBS洗3次;加入0.5% Tristone,室温10 min,PBS洗3次;加入5% BSA,37℃封闭1 h;加入1∶100稀释的CPV单抗,37℃孵育1 h,PBS 洗3次;加入1∶100稀释的FITC羊抗鼠IgG二抗,37℃避光孵育1 h,PBS清洗后加入终浓度0.1% DAPI,37℃避光感作5 min,在荧光显微镜下观察。同时设未接种病毒的细胞做为阴性对照。
1.8 序列扩增及遗传进化分析
1.8.1序列扩增 参考GenBank中CPV全基因组序列设计引物,分6个片段扩增CPV全基因组,引物序列见表1。PCR反应体系40 μL:模板 2 μL,Ex Taq Buffer 4 μL,dNTPs 2 μL,上、下游引物各2 μL,Ex Taq 聚合酶2 μL,加ddH2O至40 μL。PCR 反应程序:94℃预变性5 min;94C°变性30 s,55℃退火30 s,72℃延伸1 min,共30个循环;72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳进行鉴定。

表1 引物信息
1.8.2测序及序列分析 PCR产物经胶回收后克隆入pMD18-T载体中,转化至Trans5α感受态细胞后涂布于LB(Amp)固体培养基,37℃过夜培养,挑取平板上单克隆菌落于液体LB培养基中,经菌液PCR鉴定后,送生工生物工程(上海)股份有限公司测序。将所有片段利用DNAStar软件进行序列拼接并上传至GenBank。于NCBI网站在线Blast,将序列与GenBank数据库中的序列进行比较,并通过DNAStar程序包的MegAlign程序对分离株序列与GenBank 发表的典型参考株进行氨基酸序列比对分析。利用Mega 5.0软件,通过邻接法构建完整编码区的系统发育树,分析分离株与其他毒株及疫苗株的进化关系。
1.9 动物回归试验选取4只3月龄健康比格犬,CPV抗体阴性,试验组2只分别灌服第5代细胞培养液(TCID50为103/mL)30 mL,同时对照组2只灌服30 mL F81细胞培养液,隔离饲养,每日检测动物体温、体质量同时观察实验动物的临床症状,每隔1 d采血进行血常规检测。
2 结果
2.1 PCR鉴定结果对分离毒株的DNA进行PCR扩增反应,通过1%琼脂糖凝胶电泳检测,结果显示在573 bp左右出现特异性条带,与预期目的条带大小一致(图1)。
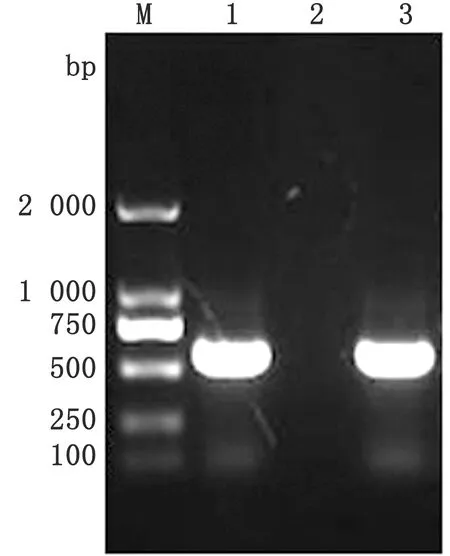
M.DL2000 DNA Marker;1.样品;2.阴性对照;3.阳性对照
2.2 病毒分离采用F81细胞同步接毒的方法,从采集的肛拭子中分离到1株CPV,命名为CPV-JL19,与对照组F81细胞相比较(图2A),接种CPV后的F81细胞出现拉网、变形及脱落等典型CPE(图2B),而对照组细胞生长良好。
2.3 病毒形态学鉴定分离毒株第5代细胞培养物用0.1%磷钨酸溶液进行电镜负染观察,可见圆形二十面体结构、直径约20 nm、无囊膜的典型病毒样粒子,与CPV的形态相符(图3)。

A.接毒后的F81细胞;B.正常F81细胞

图3 CPV-JL19 电镜观察病毒粒子形态
2.4 血凝试验血凝试验结果测得分离株第5代细胞培养物血凝特性稳定,其血凝效价为1∶29~1∶210(图4)。
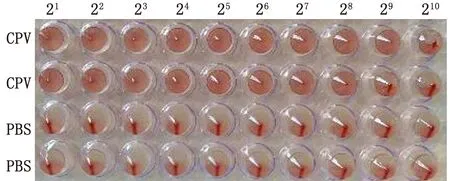
CPV和PBS,每个样品2个重复
2.5 间接免疫荧光试验接毒后36 h,F81细胞在荧光显微镜下可观察到明显的绿色荧光,对照组未接毒细胞在荧光显微镜下未观察到荧光(图5)。

A.CPV感染F81细胞;B.正常细胞
2.6 全基因组序列扩增及遗传进化分析用分离株CPV-JL19的细胞培养物提取DNA,PCR扩增全基因组序列经琼脂糖凝胶电泳鉴定,获得与预期片段大小一致的目的基因(图6)。对获得的目的片段进行测序,将测序结果进行序列拼接,最终得到一段总长4 727 bp的序列,上传至GenBank(登录号:MN519258)。
使用DNAStar软件SeqMan工具将测序结果与GenBank中已收录的CPV全基因组序列进行对比,结果显示,CPV-JL19株碱基序列与蒙古(5 MGL)、中国四川(SC/23/2017)和上海(CPV-SH1516)等地的分离株核苷酸同源性均较高,为99.9%,与CPV-2的同源性相对较低,为98.3%,与意大利(CPV_IZSSI)、巴西(CPV/Brazil)、中国北京(CPV-BJL3)和四川(CPV/SC)毒株的同源性分别为98.9%,98.4%,99.2%和99.8%(图7),可以看出CPV-JL19株主要与国外分离株同源性较低,与国内四川、上海、北京等地的分离株同源性相对国外分离株较高。采用Mega 5.0软件将此分离株序列与GenBank中部分CPV序列构建系统进化树,分离株CPV-JL19主要位于国内分离株的分支群,与蒙古分离株处于一个小分支群,与中国四川、上海分离株亲缘关系较近,与北京分离株相对较远(图8)。
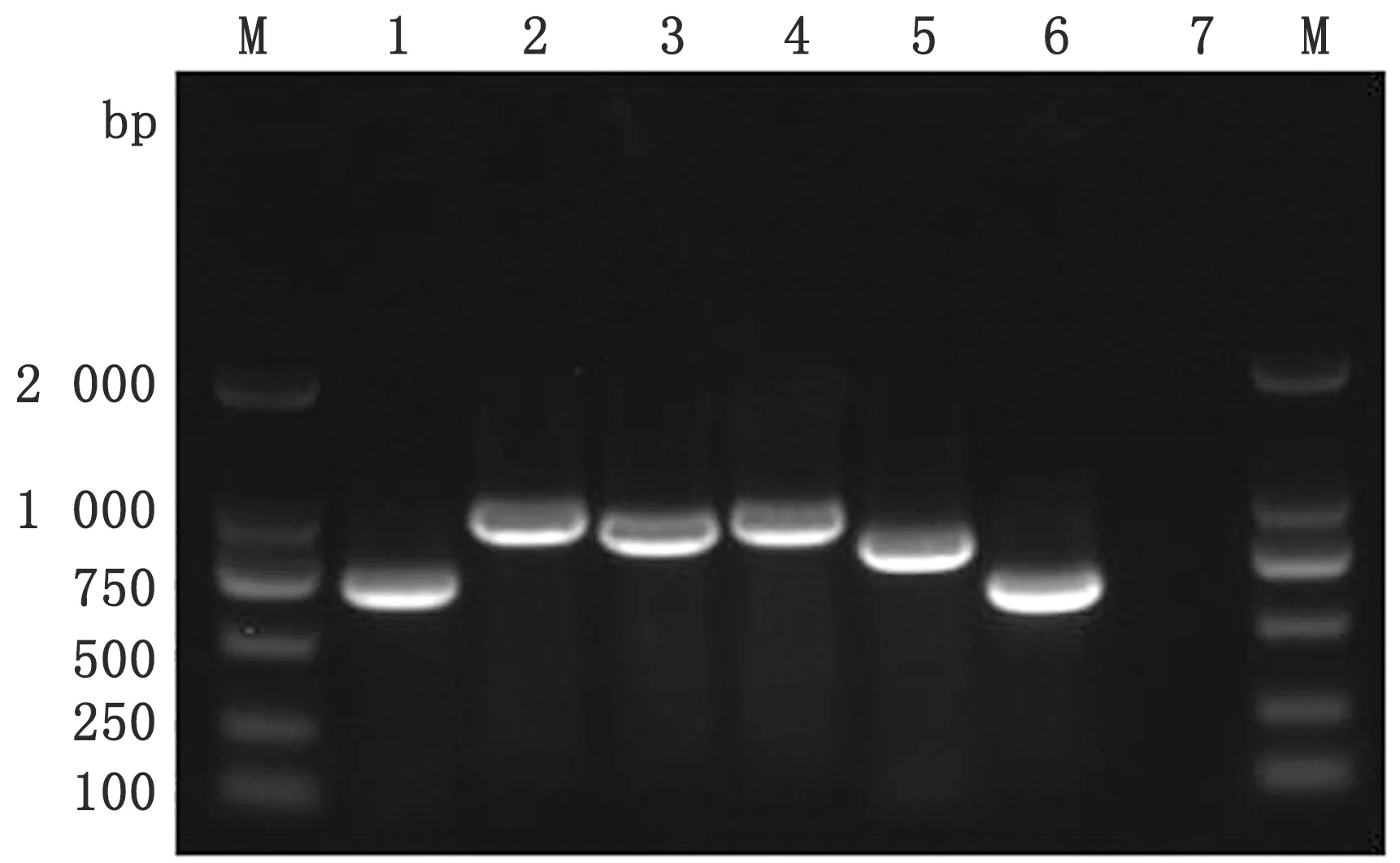
M.DL2000 DNA Marker;1.P1;2.P2;3.P3;4.P4;5.P5;6.P6;7.阴性对照

图7 CPV-JL19分离株基因组同源性分析

图8 CPV-JL19全基因组系统进化树
2.7 VP2全基因氨基酸序列分析采用Mega 5.0软件对分离株CPV-JL19 VP2基因的氨基酸序列与GenBank登录的CPV VP2氨基酸序列进行比对,确定CPV-JL19为CPV-2c型。与北京CPV-2c型参考毒株(CPV-BJL3)相比第370位氨基酸由Gln→Arg,第440位氨基酸由Ala→Thr;与深圳分离株(Shenzhen-H1)相比,第48位氨基酸由His→Gln,第119位氨基酸由Asn→Val,第370位氨基酸由Gln→Arg;与国外分离株EC-08-2017(厄瓜多尔)相比,第139位氨基酸由Ile→Val,第267位氨基酸由Phe→Tyr,第324位氨基酸由Tyr→Ile,第370位氨基酸由Gln→Arg;与蒙古(5 MGL)、新加坡(M31-6)、中国四川(SC/18/2017)、中国上海(3-2-1-2016)等国内其他地区分离毒株无氨基酸位点变化(表2)。
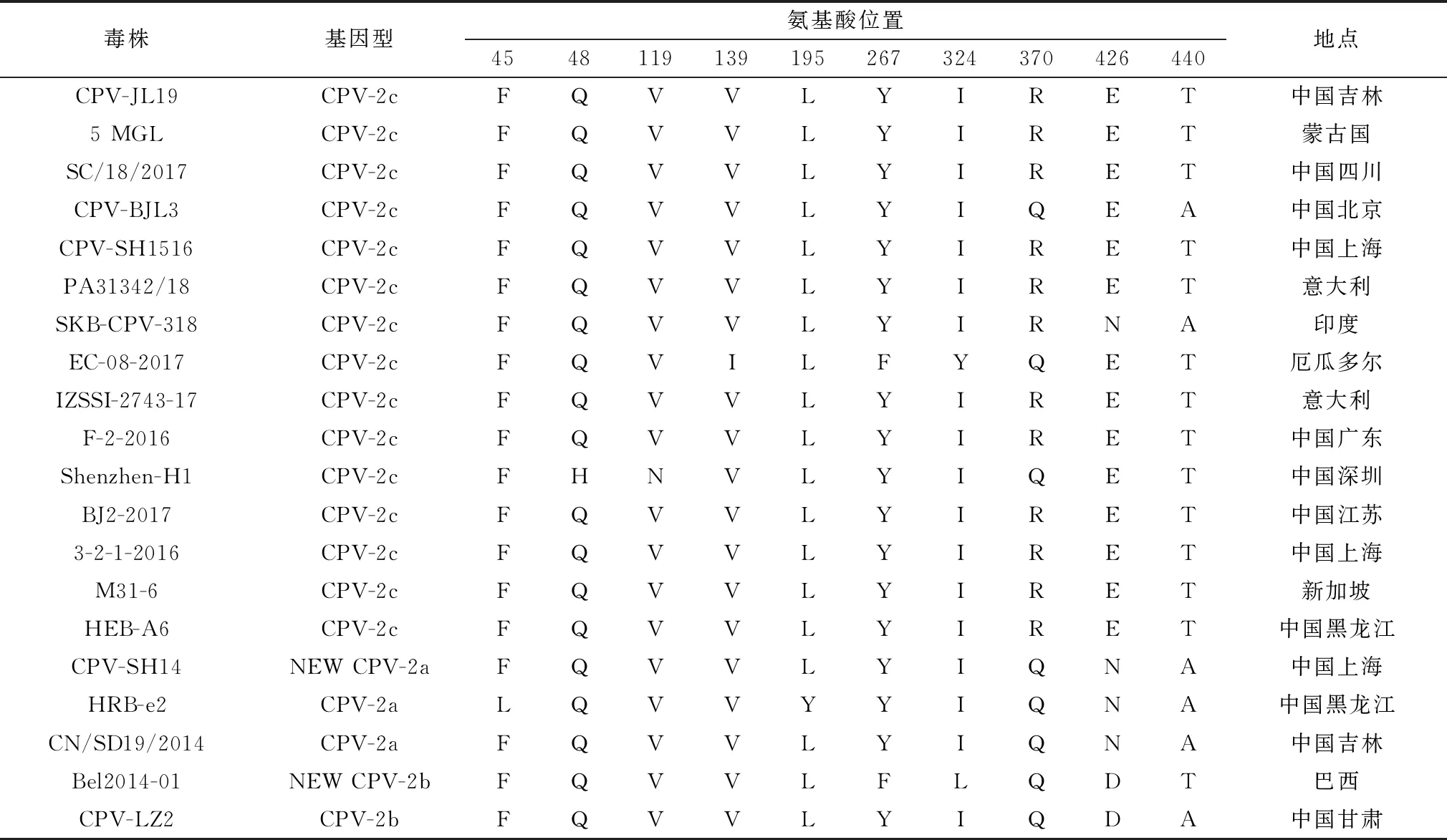
表2 VP2蛋白氨基酸序列的变异情况
2.8 动物回归试验用CPV-JL19分离株的第5代细胞培养物接种幼犬,6 d后开始发病,出现厌食、呕吐、排稀便、体温升高、体质量下降、白细胞数下降等典型临床症状,随后便血、脱水、绝食,最后攻毒组的2只犬全部死亡。病理剖检发现尸体严重脱水,胃中无内容物,胃底黏膜出血,空肠和回肠局部充血、黏膜脱落,肠腔内有血样粪便,肠系膜淋巴结肿胀等病理变化。而空白对照组无上述症状和病理变化。取血液样品DNA进行PCR检测,攻毒组核酸均为CPV阳性。
3 讨论
本试验成功分离得到1株CPV,通过PCR鉴定、电镜观察、间接免疫荧光、动物回归试验等鉴定方法及序列分析确定分离毒株为1株CPV-2c型强毒株,命名为CPV-JL19株,基因组全长4 727 bp,GenBank登录号:MN519258。序列对比显示,CPV-JL19株碱基序列与蒙古(5 MGL)、中国四川(SC/23/2017)和上海(CPV-SH1516)等地的分离株核苷酸同源性均较高,为99.9%。系统进化树显示,CPV-JL19株与蒙古分离株(5 MGL)处于一个小的进化分支。与蒙古国(5 MGL)、中国黑龙江(HEB-A6)等近期分离株无氨基酸位点变化。
目前,CPV-2c广泛分布于欧洲(意大利、保加利亚、英国、德国、希腊、葡萄牙、瑞典和西班牙)、非洲(突尼斯)、亚洲(印度、越南)、大洋洲(澳大利亚)和美洲(美国、阿根廷和乌拉圭)[11-13]。2010年测序首次证实我国存在CPV-2c病毒[14],但2012年,亚洲才检测到CPV-2c病毒[15],直到2014年我国分离并鉴定出CPV-2c病毒[9]。此后,南亚也检测到CPV-2c病毒[16-18]。自2018年以来,在蒙古犬中CPV-2c亚型取代2b在抗原型中占据主导地位。并且在蒙古国的CPV-2c阳性样本中检测到3种不同的位点突变。而在相似的时间跨度内,从蒙古国和我国分离到的毒株序列也有惊人的相似性[19]。
我国目前CPV-2c主要在南方流行,在北方相对较少,在东北地区New CPV-2a占主导地位[9]。由于在未接种疫苗和接种疫苗的犬中均存在CPV的感染,这促使我们对目前我国流行的病毒变种进行描述和分离。CPV在我国的继续发展,表明疫苗株可能需要调整以获得最佳的抗感染保护,适当改变目前疫苗接种策略是十分必要的,因为田间株和疫苗株之间的毒株差异可能导致免疫失败[20]。目前在世界范围内现有的商业疫苗是基于CPV-2和CPV-2b的,虽然有几项研究表明它们能够交叉保护所有抗原类型[21-23]。但在接种CPV疫苗的犬只中,仍然存在出现临床症状的犬[19]。我国目前可用的商业疫苗是基于CPV-2型的[9],而使用CPV-2型弱毒活疫苗的犬可能无法抵抗我国目前流行的CPV-2c病毒的感染。这也许可以解释从未接种疫苗和接种疫苗的犬均能分离出CPV-2c病毒的原因。因此,在进一步检测CPV-2疫苗对CPV-2c的有效性显得非常重要。本研究为我国调整CPV疫苗株提供了依据。
