鸡巨噬细胞CCL4抗禽白血病病毒作用及其机制初探
2021-06-17陈绪靖赵宗仪吉紫荆豆春峰陈世豪耿拓宇胡序明崔恒宓
陈绪靖,赵宗仪,吉紫荆,豆春峰,吴 挺,陈世豪,耿拓宇,胡序明*,崔恒宓*
(1.扬州大学 动物科学与技术学院/表观遗传学及表观基因组学研究所,江苏 扬州 225009;2.扬州大学 教育部农业与农产品安全国际合作联合实验室,江苏 扬州 225009)
病毒感染后其免疫应答反应的差异性与家禽遗传抗性有关,特别是天然免疫基因在禽类病毒感染后的差异表达与宿主对病毒的易感性密切相关[1]。因此,抗病毒天然免疫也成为家禽病毒与宿主相互作用的研究热点。其中,趋化因子(chemokines)在炎症反应中的重要作用及其在病毒感染后的异常表达已逐渐引起科学家们的研究兴趣。
趋化因子配体4(chemokine CC motif ligand 4,CCL4)属于CC类趋化因子亚家族,又称巨噬细胞炎症蛋白1β(macrophage inflammatory protein-1β,MIP-1β),通过特异性结合免疫细胞表面的CCR5受体以发挥相应的生物学功能[2]。研究表明,CCL4是一个关键的促炎细胞因子,在天然免疫应答和病毒清除过程中起到重要作用。近年来,CCL4在家禽病毒感染过程中的表达规律已逐渐被认识。传染性法氏囊病病毒(infectious bursal disease virus,IBDV)感染早期,CCL4基因在法氏囊组织中的表达明显升高[3],但是在J亚群禽白血病病毒(avian leukosis virus subgroup J,ALV-J)感染的18胚龄中并未检测到CCL4基因的差异表达。随后检测10日龄和30日龄鸡法氏囊组织,发现CCL4基因在前者中表达显著上调,而在后者中其表达上调趋势明显下降[4]。另外,CCL4基因在易感品系鸡中差异表达,并影响鸡对新城疫病毒(Newcastle disease virus,NDV)感染的敏感性[5]。目前,对CCL4基因特别是在禽类肿瘤病毒感染过程中具体作用和机制的研究甚少。
本试验选择鸡CCL4基因作为研究对象,探索CCL4在禽类肿瘤病毒ALV-J感染巨噬细胞(HD11)过程中的动态表达规律,发现ALV-J感染HD11细胞后主要抑制CCL4表达;同时发现CCL4的下调与ALV-J病毒编码的env蛋白有关。此外,还发现CCL4可能通过激活抗病毒基因S100A9相关的上、下游通路来抑制ALV-J的增殖。本试验为今后深入研究CCL4的功能及其宿主遗传抗性奠定基础。
1 材料与方法
1.1 试剂与材料DMEM basic(1×)高糖培养基、RPMI Medium 1640 basic(1×)培养基和胎牛血清FBS(美国Gibco公司);XfectTMTransfection Reagent(日本TaKaRa公司);RNA-easy Isolation Reagent、反转录试剂盒HiScript Q RT SuperMIX for qPCR(+gDNA wiper)、荧光染料ChamQ SYBR qPCR、Taq酶和胶回收试剂盒(南京诺唯赞生物科技有限公司);胰蛋白酶、DH5α感受态细胞(苏州新赛美生物科技有限公司);限制性核酸内切酶 Hind Ⅲ、BamHⅠ和T4DNA连接酶(美国NEB公司);质粒抽提试剂盒和DNA纯化试剂盒(美国Omega Bio-tek公司);pGEM-T-easy Vector(美国Promega公司);化学发光试剂盒(美国Thermo Fisher公司);其他试剂均为国产分析纯。ALV-J JS09GY3和ALV单抗JE9均由扬州大学秦爱建教授馈赠。
1.2 引物设计与合成PCR及qPCR引物根据NCBI的已知序列,采用Primer Premier 6.0软件设计引物,由苏州金唯智生物科技有限公司合成,引物序列如表1所示。

表1 PCR及qPCR引物序列
1.2 RT-qPCR检测目的基因表达水平参照Vazyme总RNA提取试剂盒说明书操作步骤进行总RNA的提取;用反转录试剂盒HiScript Q RT SuperMIX for qPCR(+gDNA wiper)将1 μg总RNA反转录成cDNA产物;cDNA产物稀释后通过CFX ConnectTM实时定量PCR仪进行定量分析。以CCL4、S100A9、IFN-α、TLR7为检测基因,GAPDH作为内参基因。20 μL反应体系:ChamQ SYBR qPCR 10 μL,上、下游引物各2 μL,cDNA模板1 μL,无酶水5 μL。反应条件:95℃ 3 min;95℃ 10 s,60℃ 30 s,共40个循环。反应结束后分析结果。
1.3 获得鸡CCL4基因CDS区全长序列根据NCBI数据库中公布的鸡CCL4基因(登录号:NM_001030360.2)的mRNA编码蛋白区序列,设计可以扩增出全长产物的引物。其中,5′端含有Hind Ⅲ的酶切位点,3′端含有BamHⅠ的酶切位点,两端分别加上3个保护碱基。使用20 μL PCR扩增体系:2×Taq酶10 μL,cDNA模板1 μL,上、下游引物各1 μL,RNase-free water 7 μL。反应条件:94℃ 5 min;94℃ 30 s,56℃ 30 s,72℃ 30 s,共35个循环;最后72℃ 7 min,4℃保存PCR产物。进行1.5% 琼脂糖凝胶电泳,用胶回收试剂盒回收目的片段后,参照Promega公司pGEM-T载体系统说明书将其与pGEM-T Vector室温连接1 h。连接产物转化感受态细胞DH5α后涂板,用Amp抗性筛选法挑选阳性菌落进行菌检PCR,最后挑选5个阳性菌,由苏州金唯智生物公司测序。
1.4 构建CCL4、ALV-J env、ALV-J GP85和ALV-J GP37真核表达载体及鉴定取正确序列的重组质粒进行大量扩增。用Hind Ⅲ和BamHⅠ自pGEM-T载体上切下目的基因,16℃过夜正向连接至pcDNA3.1表达载体对应酶切位点上,重组成鸡CCL4基因真核表达载体pcDNA3.1-CCL4转化感受态细胞DH5α,后续试验方法同上。测序所得正确结果的重组质粒采用双酶切法鉴定。50 μL酶切体系:2 μg 重组质粒,Hind Ⅲ内切酶1 μL,BamHⅠ内切酶1 μL,Cutsmart 5 μL,RNase-free water补足至50 μL。置于37℃水浴中反应3~6 h,酶切产物经1.5%琼脂糖凝胶电泳分别获得了与目的条带相符的片段和pcDNA3.1表达载体大小的片段,说明pcDNA3.1-CCL4真核表达载体构建成功,可以大量扩增重组质粒后抽提,制备好的重组真核表达载体用于细胞转染。按照上述步骤构建其他3个基因真核表达载体。
1.5 细胞培养37℃水浴复苏鸡巨噬细胞系HD11后,使用含有10%胎牛血清和1%双抗的DMEM培养基,置于41℃、5% CO2培养箱中培养。定时给细胞传代,避免细胞状态不佳从而影响试验结果。
1.6 病毒感染先将HD11细胞接种至6孔板,待孔中细胞密度达到约50%时将 ALV-J(MOI=5)接种于细胞孔中,用病毒分别感染细胞6,12,24,36,48 h 后收集细胞检测病毒复制水平,同时设置每个感染病毒时间点的空白对照组。
1.7 转染转染前1 d,处理HD11细胞接种至6孔板(每个孔接种约4×105个细胞)。当细胞密度达到50%时,使用ALV-J感染细胞,6~8 h 后进行重组质粒转染;当每个孔细胞密度达到70%~90%时,使用XfectTMTransfection Reagent纳米颗粒转染试剂盒,将室温下静置10 min的重组质粒与纳米颗粒混合物加入细胞培养板中,同时设置pcDNA3.1-GFP真核表达质粒作为对照组,41℃、5% CO2培养箱中培养24 h,在倒置荧光显微镜下观察转染pcDNA3.1-GFP真核表达质粒细胞的荧光亮度,以此判断细胞的转染情况。
1.8 Western blot将SDS-PAGE胶置于电泳槽,每孔上样20 ng总蛋白,90 V电泳20 min后电压改为120 V 2 h。膜转移按照黑色面—滤纸—海绵—胶—膜—海绵—滤纸—白色面的顺序,置于膜转移液中,200 mA转移2 h。将转移膜放入含5%脱脂乳的TBST封闭1 h。将ALV-J囊膜糖蛋白的特异性单抗JE9和内参GAPDH抗体用含5%脱脂乳的TBST进行稀释,4℃过夜孵育。TBST洗涤3次,每次5 min,加入用含5%脱脂乳的TBST稀释HRP标记的山羊抗鼠IgG,室温孵育1 h。TBST洗涤3次,每次5 min,用化学发光试剂盒显色并拍照。

2 结果
2.1 CCL4基因在ALV-J感染HD11细胞不同时间后的表达规律首先分析ALV-J感染对鸡CCL4基因转录表达的影响。荧光定量PCR结果显示,在ALV-J感染早期的HD11细胞中,CCL4基因表达量在病毒感染后6 h上调(图1A)。随着ALV-J不断增殖(图1B),CCL4基因在病毒感染的巨噬细胞中持续性下调表达。如图1A所示,ALV-J感染后24,36,48 h,CCL4基因转录表达均极显著下调(P<0.01)。结果表明,ALV-J感染HD11细胞后主要抑制CCL4基因表达。

A.CCL4基因在ALV-J感染的HD11细胞中的表达情况;B.不同时间ALV-J增殖情况
2.2 CCL4、ALV-J env、ALV-J GP85和ALV-J GP37真核表达载体的成功构建pGEM-T-CCL4载体用通用引物M13进行Sanger测序,测序结果与GenBank数据库中的CCL4 mRNA序列同源性达100%,说明已经成功扩增出CCL4基因编码蛋白区域。按上述步骤将ALV-J env、ALV-J GP85和ALV-J GP37连入pGEM-T载体中测序,结果显示,3个基因的序列同源性分别达99%。如图2所示,分别对4个重组质粒进行Hind Ⅲ和BamHⅠ双酶切处理,将酶切产物进行1.5%琼脂糖凝胶电泳,结果显示,在5 000,270,1 700,1 000,600 bp左右处可见明显条带,测序结果同上,说明4个目的片段已经成功连接入表达载体中,pcDNA3.1-CCL4、pcDNA3.1-ALV-J env、pcDNA3.1-ALV-J GP85、pcDNA3.1-ALV-J GP37这4个重组真核表达载体构建正确,可用于下一步试验。

M.DL5000 DNA Marker;1.pcDNA3.1-CCL4双酶切产物;2.pcDNA3.1-ALV-J env双酶切产物;3.pcDNA3.1-ALV-J GP85双酶切产物;4.pcDNA3.1-ALV-J GP37双酶切产物
2.3 ALV-J的env基因抑制CCL4基因表达进一步分析ALV-J的env基因是否抑制CCL4基因表达。用上述构建的pcDNA3.1-ALV-J env、pcDNA3.1-ALV-J GP85和pcDNA3.1-ALV-J GP37共3个过表达载体分别转染HD11巨噬细胞,通过荧光定量PCR分析CCL4基因的表达情况。结果如图3所示,ALV-J env、ALV-J GP85和GP37均能极显著抑制CCL4基因表达(P<0.01),表明ALV-J可以通过其编码env基因抑制CCL4的表达,也进一步证实了ALV-J感染巨噬细胞后主要抑制CCL4基因表达。

图3 ALV-J env过表达对CCL4基因的影响
2.4 CCL4基因过表达抑制ALV-J增殖既然ALV-J可以通过其编码env基因抑制天然免疫基因CCL4的表达,那么是否意味着CCL4具有抵抗ALV-J增殖的能力呢?为此构建了CCL4真核表达载体(图2)。通过过表达CCL4基因来观察其对ALV-J增殖的影响。如图4所示,在mRNA水平检测,过表达CCL4极显著抑制了ALV-J的增殖(P<0.01);在蛋白水平检测,结果相同。
2.5 CCL4基因过表达激活巨噬细胞天然免疫相关基因和S100A9表达上述研究表明CCL4具有抑制ALV-J增殖的功能。那么CCL4通过何种途径抑制ALV-J增殖呢?为此检测CCL4受体CCR5及其下游相关天然免疫基因和其他抗病毒基因的表达情况。结果如图5所示,与对照组相比,在CCL4过表达48 h后,CCR5和TLR7表达显著上调(P<0.05),IFN-α表达极显著上调(P<0.01),钙卫蛋白S100A9亦极显著上调(升高约6倍,P<0.01)。这说明CCL4可能不是通过激活细胞抗病毒天然免疫的途径抑制ALV-J增殖,而是通过激活抗病毒基因S100A9及其上、下游通路抑制ALV-J增殖的。
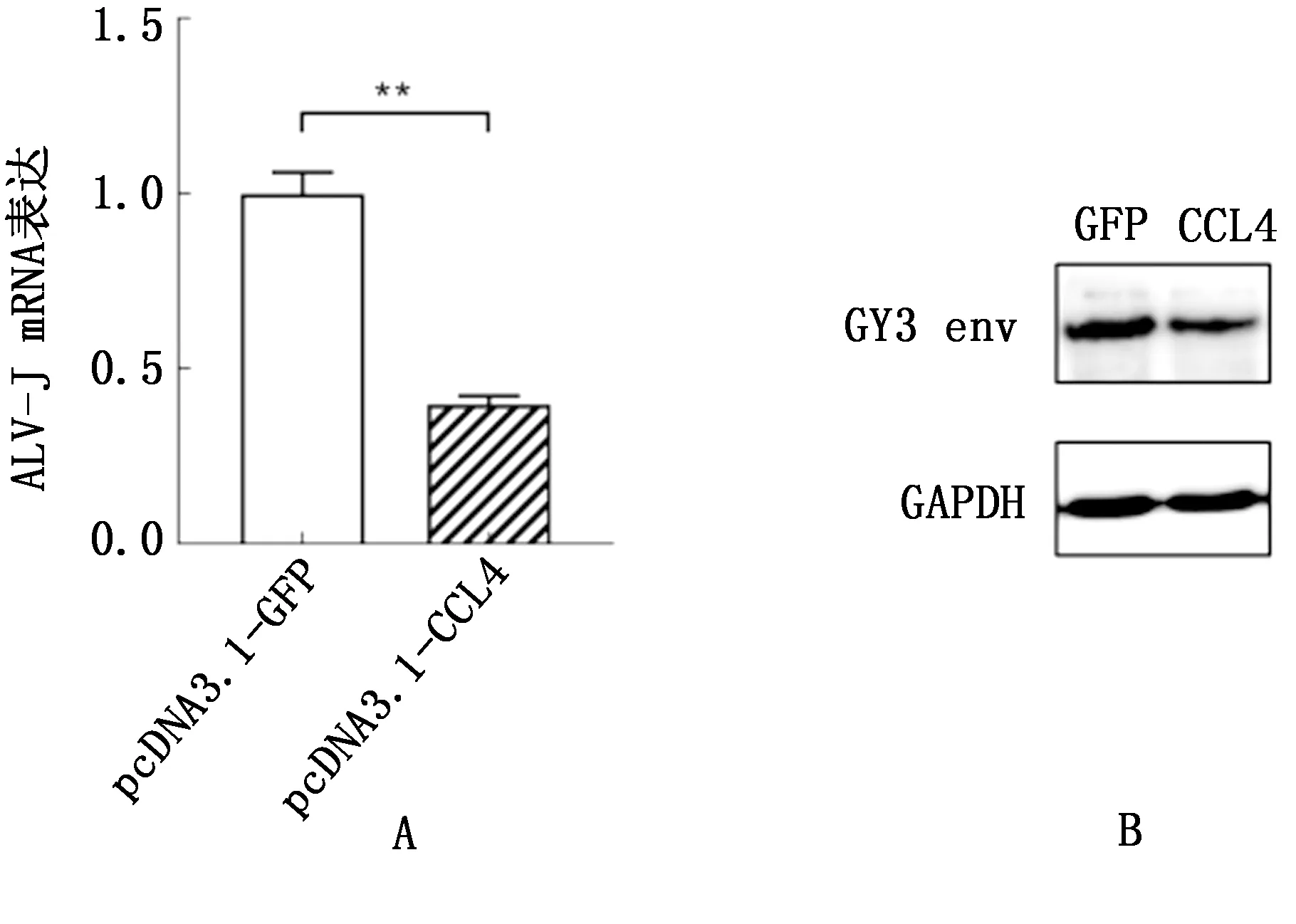
A.mRNA水平检测ALV-J被抑制;B.蛋白水平检测ALV-J被抑制
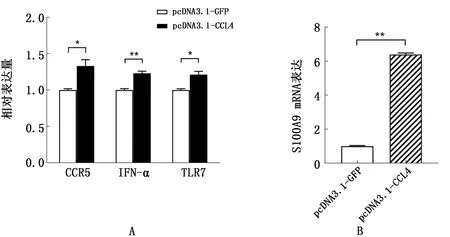
A.过表达CCL4上调天然免疫基因;B.过表达CCL4上调S100A9
3 讨论
CCL4是一个关键的促炎细胞因子,在抗病毒天然免疫应答中扮演着重要的角色,而巨噬细胞作为一类关键的天然免疫细胞,在非特异性免疫和特异性免疫应答中也同样重要。研究表明,病毒感染或外界因素刺激鸡巨噬细胞可以诱导CCL4的表达。例如,cNK-2诱导CCL4在鸡HD11细胞和原代单核细胞中表达[6];热应激和脂多糖(LPS)刺激使得CCL4在鸡巨噬细胞中表达[7-8]。本研究发现只有ALV-J感染巨噬细胞早期(感染后6 h),CCL4在病毒感染的HD11细胞中显著上调,从感染12 h后CCL4开始下调。这一动态表达规律与CCL4在ALV-J感染鸡法氏囊组织中的表达趋势类似[4],暗示CCL4表达可能具有抑制ALV-J病毒复制的功能,因而在病毒感染晚期被抑制。为了证实这一推测,通过分别过表达ALV-J env、GP85和GP37,发现它们均可以显著抑制CCL4表达,但env蛋白抑制作用更加明显,说明ALV-J编码的env基因对在病毒感染过程中抑制CCL4的表达起着重要作用。
再者,探索了CCL4的抗病毒作用。在HD11细胞中,CCL4过表达可以显著抑制ALV-J增殖水平。进一步通过基因表达分析发现CCL4过表达可以上调其受体CCR5表达[2],还可以上调天然免疫相关基因如TLR7和IFN-α的表达,结果与TLR7的配体可以诱导IFN-α表达相符[9];同时显著上调了抗病毒基因钙卫蛋白S100A9的表达。S100A9蛋白通常通过与CD85j受体相互作用激活NK细胞控制人类免疫缺陷病毒1型(HIV-1)的复制[10]。S100A9可以与TLR4高特异性结合[11],而CCL4可以通过TLR4信号通路被激活[12],说明CCL4上调S100A9表达可能是通过TLR4这个通路来实现的。
在病毒感染早期,ALV-J可能利用上调CCL4促进病毒在感染细胞中的增殖,但随着CCL4上调激活宿主免疫应答后,ALV-J又通过其编码的env蛋白下调CCL4表达。研究表明,许多致癌病毒能操纵趋化因子家族以达到逃避细胞免疫系统攻击从而增殖的目的[13]。更加惊奇的是,一些病毒也能编码人类趋化因子同源物。例如,人巨细胞病毒(HCMV)编码CXCL-2;卡波西氏肉瘤相关疱疹病毒(KSHV)编码CCL1、CCL2和CCL3。人疱疹病毒6(HHV-6)可以编码CCL4[14],并且趋化因子由肿瘤细胞通过自分泌和旁分泌产生与其相应配体结合支配着肿瘤的微环境,有助于肿瘤细胞生长增殖、血管生成和激活免疫抑制反应[15]。因此,深入研究趋化因子在病毒感染过程中的作用及其机制,将有助于破解禽类肿瘤病毒的致病或致癌机制。
综上所述,本研究揭示了CCL4在巨噬细胞中的动态表达规律及其抗ALV-J作用,为今后深入研究CCL4的功能及其宿主遗传抗性奠定基础。
