EPO和CEPO对心肌梗死大鼠梗死面积和血管新生的作用的比较△
2021-06-17冮洪生李文华
黄 妍 冮洪生 李 鸣 徐 标 李文华
(1.武汉市第四医院,华中科技大学同济医学院附属普爱医院急诊内科 武汉 430033;2.武汉市第四医院,华中科技大学同济医学院附属普爱医院心血管内科 武汉 430033)
心肌梗死是冠状动脉急性、持续性缺氧或缺血引起的心肌梗死,发病后能出现心肌重塑,并在数小时到发生变化,能引起大量中性粒细胞、巨噬细胞浸润,能造成梗死区心肌局部变薄、分化,从而加重心肌缺血[1]。血管新生最早由1971年在肿瘤生长中提出,逐步被应用于严重缺血性疾病的研究中。既往研究表明[2],血管新生具有两种模式,即芽生式、分割式两种,而血管内皮生长因子(VEGF)是一种选择作用血管内皮细胞的细胞因子,主要由垂体滤泡星状细胞核平滑肌细胞分泌、产生,能增加血管通透性、促进血管新生最强烈的因子之一[3]。血管新生在心肌梗死的发生、发展中发挥了重要的作用,但是其具体机制尚未阐明。氨甲酰促红细胞生成素(CEPO)属于是人体内源性糖蛋白激素,能刺激红细胞生成,广泛用于获得性免疫缺陷、贫血、恶性肿瘤中,并发挥了重要作用[4]。同时,CEPO在心脏缺血再灌注损伤时对心脏发挥保护作用[5],但是对心肌梗死新生血管的影响研究较少。本研究以SD大鼠为研究对象,探讨CEPO和EPO对心肌梗死大鼠梗死面积和新生血管的作用,现报道如下。
1 资料与方法
1.1 动物资料
购置SD大鼠40只为研究对象,随机取SD大鼠10只设为空白对照组,剩余30只SD大鼠,采用左冠状动脉结扎诱导大鼠发生急性心肌梗死动物模型,建模后随机分为模型对照组、EPO组和CEPO组各10只。40只SD大鼠,雄性,体质量200~250g,平均(230.00±10.00)g。动物合格证号:SCXX-2005-0001,所选动物均购置于实验动物房,完成大鼠的常规喂养、光照。
1.2 仪器与设备(表1)

表1 仪器与设备
1.3 方法
1.3.1动物处理
(1)建模方法:40只SD大鼠随机取10只设为空白对照组,剩余30只SD大鼠采用左冠状动脉结扎诱导大鼠发生急性心肌梗死动物模型。具体方法如下:术前给予75%酒精消毒,并于左胸4~5肋骨部位作横切口,从左侧肋间钝性分离并将胸腔打开,轻轻挤压胸腔,并暴露心脏,将心包剪开,在肺动脉圆锥与左心耳交界部位略低处给予无创性缝线完成左侧冠状动脉前降支的结扎,并记录II导联心电图,对于结扎部位以下心肌变白、搏动减弱,且心电图下可见ST段弓背明显向上视为建模成功。建模后随机分为模型对照组、EPO组和CEPO组。(2)处理方法:空白对照组和模型对照组在相同时期给予相同剂量的生理盐水耳缘静脉注射;CEPO在冠脉结扎后即刻耳缘静脉注射CEPO(每周2次),单次注射剂量为50ug/kg;EPO组在冠脉结扎后即刻耳缘静脉注射EPO,注射剂量为0.3mg/kg。各组大鼠均完成1个月干预。
1.4 观察指标
(1)血流动力学参数:各组完成1个月干预后经颈动脉插管从BL-410生物技能实验系统的血流动力学模式下测大鼠血流动力学参数,包括:左心室收缩压(LVSP)、心室收缩期室内压上升的最大速率(+dp/dtmax)、左心室舒张压(LVDP)、心室舒张期室内压下降的最大速率(-dp/dtmax)水平[6~7];(2)梗死面积:4组大鼠完成1个月干预后以断颈方式处死大鼠,并取大鼠心脏,将左心室给予生理盐水漂洗后储存、备用。常规放置-20℃病学中冻融10min,沿着与心脏长轴垂直方向从心尖向心底做2~3mm切片,并将其放置在37℃温箱中完成20min染色;取出组织可见梗死心肌为白色,存活心肌为砖红色,利用剪刀分离梗死区与非梗死区,常规称重后完成梗死面积计算(梗死面积=左室梗死心肌质量/左室结扎线下心肌质量)[8];(3)血管新生:采用免疫组织化学法测定各组血管新生情况,取上述制备的切片,常规水化后完成组织的修复,经3%过氧化氢阻断内源性过氧化氢酶的生物学活性,加入单克隆抗体CD34,常温下15min孵育;向每张切片中加入DAB溶液100uL,冲洗后苏木素复染;对于染成棕黄色血管内皮细胞计为一个血管计数,每张切片随机取视野5个,计数梗死边缘区新生血管数(MVD),取平均值[9~10]。
1.5 统计分析

2 结果
2.1 4组血流动力学参数比较
CEPO组干预后1个月LVSP、+dp/dtmax、-dp/dtmax水平均高于模型对照组和EPO组(P<0.05),LVDP水平低于模型对照组和EPO组(P<0.05);EPO组干预后1个月LVSP、+dp/dtmax、-dp/dtmax水平均高于模型对照组(P<0.05),LVDP水平低于模型对照组(P<0.05),见表2。

表2 4组血流动力学比较
2.2 4组梗死面积比较
CEPO组干预后1个月梗死面积均小于模型对照组和EPO组(P<0.05);EPO组干预后1个月梗死面积小于模型对照组(P<0.05),见表3。
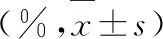
表3 4组梗死面积比较
2.3 4组血管新生比较
免疫组化结果表明:EPO组干预后1个月血管新生数多于模型对照组,但少于CEPO组(P<0.05),免疫组化下染色颜色相对较淡;CEPO组干预后1个月血管新生数量多于其余各组(P<0.05),见图1。

图1 4组免疫组化结果(×200)
3 讨论
心力衰竭是由于各种心血管疾病发展的终末阶段,且临床已经认识到慢性心力衰竭发生、发展的病理基础为心室重构。心肌梗死患者发病后心室重构能影响慢性心力衰竭发病率、死亡率[11],因此积极采取措施阻断心室重构对预防心力衰竭的发生具有重要的意义。本研究以大鼠作为对象,建立心肌梗死动物模型,并给予不同的措施干预,结果表明:CEPO组干预后1个月LVSP、+dp/dtmax、-dp/dtmax水平均高于模型对照组和EPO组(P<0.05),LVDP水平低于模型对照组和EPO组(P<0.05),说明CEPO干预后能改善大鼠血流动力学水平,利于大鼠恢复。CEPO在心肌细胞的凋亡、炎性反应及心肌重构等方面能发挥良好的抑制作用,有助于改善机体的心脏功能[12]。既往研究表明[13]:EPO除了能促进红细胞生成外,亦可发挥抗凋亡、促进血管新生、调节炎症反应等作用,对于脑组织、肝脏、肾脏等多个器官具有良好的保护作用。国外学者[14]进行了一项离体心脏模型,结果表明:CEPO的使用能减轻心肌缺血再灌注损伤,能减轻心肌梗死面积;同时,CEPO亦可持续刺激血管新生,能维持心肌所需的营养与血供。本研究中,CEPO组干预后1个月梗死面积均小于模型对照组和EPO(P<0.05);EPO组干预后1个月梗死面积小于模型对照组(P<0.05),提示CEPO和EPO均缩小心肌梗死大鼠梗死面积。此外,国内外实验证实CEPO能抑制心室重构,而改善心功能,亦可降低血浆内皮素水平,抑制左心室重构,且药物安全性较高[15]。本研究中,免疫组化结果表明:CEPO组干预后1个月血管新生数量多于模型对照组和EPO组(P<0.05),说明CEPO通过增加梗死部位血管新生数量,能保护心肌功能。
综上所述,EPO和CEPO均能减少心肌梗死大鼠面积,但是后者效果更佳,能改善病灶部位血流动力学水平,可能与血管新生有关,能为临床治疗提供参考依据。
