全自动核酸提取仪联合真空浓缩仪在法医学中的应用
2021-06-17李淑侠沈金建曹佩军李志超
李淑侠,沈金建,曹佩军,李志超
1.平湖市公安局,浙江 平湖 314200;2.上海市公安局奉贤分局,上海201499
目前,应用聚合酶链反应(polymerase chain reaction,PCR)和短串联重复(short tandem repeat,STR)序列分型已经成为法医DNA 分析的常规方法,并且在各类案件的侦破中发挥越来越显著的作用。但随着犯罪分子作案手段的不断提高,在实际检案中经常需要对难以得到理想实验结果的疑难检材进行检测,主要包括微量检材、降解检材、抑制剂含量超高的检材或者混合检材[1]。常用的DNA 提取方法包括酚氯仿抽提法、煮沸裂解法、离心柱提取法、磁(硅)珠分离法等,但这些方法操作繁琐、耗时长,易出现样本间交叉污染,且提取效率较低,经常不能成功检验[2]。因此,寻找一种能够获得高质量DNA 模板的提取方法对于现场检材的有效检测具有重要意义[3]。
本研究通过自行制备梯度样本,并对样本进行不同抑制剂的添加处理,旨在模拟日常检案中可能出现的微量及含有抑制剂的样本情况,探讨联合使用磁珠法全自动核酸提取仪和真空浓缩仪提取样本DNA 的效果,为实验室DNA 提取提供参考。
1 材料与方法
1.1 实验样本
在知情同意的情况下,采集1名健康女性(实验室人员)的外周静脉血,乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)抗凝处理。
1.2 主要仪器和试剂
BK-TQ-001F 全自动24 道微量DNA 提取工作站(长春市博坤生物科技有限公司,以下简称“提取仪”),MC-2 真空浓缩仪(北京吉艾姆科技有限公司,以下简称“浓缩仪”),ProFlexTMPCR 系统、3500xL 基因分析仪(美国Applied Biosystems 公司),5417R 离心机(德国Eppendorf 公司)。
WD-超微量磁珠法DNA 提取试剂盒(长春市博坤生物科技有限公司),Investigator 24plex QS 试剂盒(德国Qiagen 公司),去离子甲酰胺(美国Invitrogen公司)。
1.3 实验方法
1.3.1 样本准备
取20 μL 静脉血分别稀释40、80、120、160、200、240、280、320 倍,共8 个梯度,每个梯度的血液样本取5 μL 置于提取仪配套的样本板中,每个梯度血样放置6个孔位,分别进行如下6种操作:不做任何处理,加黑机油(2.0 cm×2.0 cm 浸满机油的滤纸),加铁锈(3 颗铁锈粒),加果酸(新鲜橘汁数滴),加锡纸(2.0 cm×2.0 cm锡纸),加靛蓝(2.5 cm×2.5 cm 深色牛仔裤布料)。共48 份样本。
1.3.2 DNA提取及浓缩
使用提取仪自动提取所有检材DNA。按照提取仪操作说明书摆放样本板、裂解液、洗涤液、洗脱液及洗脱管,模板DNA 洗脱体系设置为30 μL,开机运行“试剂盒标准纯化程序”,约90 min 得到DNA 洗脱液,每个样本取6 μL DNA 洗脱液直接进行PCR 扩增及STR 分型检测,剩余的DNA 洗脱液用于浓缩处理。
浓缩处理:将上述梯度样本DNA 洗脱液从洗脱管转移至1.5 mL 离心管中,放进浓缩仪进行浓缩。设置条件:温度45 ℃,转速1 200 r/min,离心管管盖开启浓缩至干燥。浓缩后向离心管中加入6 μL 去离子水,振荡离心后进行PCR 扩增。
1.3.3 PCR扩增和STR分型
样本浓缩前后的DNA 模板均采用相同条件进行PCR 扩增和STR 分型检测。PCR 扩增采用Investigator 24plex QS 试剂盒(包含21 个常染色体基因座)。扩增体系为10 μL,包含3 μL 快速反应混合液2.0、1 μL引物混合液以及6 μL DNA 模板。扩增条件及分型方法按照Investigator 24plex QS 试剂盒操作说明书进行。扩增产物在3500xL 基因分析仪上进行毛细管电泳。所有样本重复3次分型检测,取均值进行计算,减小操作误差
1.3.4 质量传感器性能分析
Investigator 24plex QS 试剂盒中含有质量传感器(quality sensor,QS),包括小片段QS1(74 bp)和大片段QS2(435 bp),作为试剂盒的内部质控与样本STR 基因座同时进行扩增,可帮助判断STR 分型图谱可能出现的4 种情况:(1)QS1 和QS2 均扩增成功且峰高相当,则样本扩增正常;(2)QS1 和QS2 均扩增失败,则样本扩增失败;(3)样本大片段丢失甚至扩增失败,QS1 扩增成功,而QS2 峰高下降到QS1 峰高的20%以下,表明DNA 含有抑制剂;(4)样本大片段丢失,而QS1 和QS2 均扩增成功且峰高相当,表明DNA降解。
本研究对象为模拟使用不同抑制剂处理的不同梯度样本,当出现STR 分型不全时,可以通过QS 来判断分型不全的原因是DNA 太少还是抑制剂所致。
1.3.5 数据分析
采用GeneMapperTMID-Xv1.5 软件(美国Applied Biosystems 公司)分析数据,分析阈值设置为50 相对荧光单位(relative fluorescence units,RFU)。基因座成功检出的标准为:(1)峰值>50 RFU;(2)杂合子等位基因分型均衡,同一基因座不同等位基因的峰面积差异在30%以内[4]。采用计数法统计样本的STR 基因座检出个数,将重复3次分型的样本取平均值,根据平均基因座检出个数与试剂盒包含基因座个数的比值获得平均基因座检出率,统计分型结果时去除DYS391和性别基因座(Amelogenin)。根据检测等位基因RFU总和与检测等位基因个数获得平均RFU 值。
2 结果
2.1 梯度样本的DNA分型结果
8 个稀释梯度的血液样本,分别进行6 种处理,经PCR 扩增和STR 分型,获得样本的STR 基因座平均检出率和峰高平均RFU 值,详见表1。以无抑制剂的样本检测结果作为参照,加靛蓝处理的样本检测得到的效果最好,即抑制剂未对检测产生影响;加黑机油的结果次之;加铁锈和锡纸的结果相当,仅在280 和320 倍稀释的样本中未得到检测结果。加果酸处理的样本的检测结果最差,仅在40 倍稀释的样本中获得完整的STR 分型。排除抑制剂的干扰,使用该提取仪对40~160 倍稀释的样本提取得到的DNA 模板均可通过扩增检测得到完整的STR 分型,200~320 倍稀释的样本也有部分基因座检出。

表1 6种方式处理的梯度样本的STR基因座平均检出率和平均RFU值Tab.1 Average STR loci detection rate and RFU of gradient samples in 6 ways
2.2 梯度样本DNA浓缩后的分型结果
梯度样本DNA 洗脱液经过浓缩后,再进行PCR扩增和STR 分型,STR 基因座平均检出率和峰高平均RFU 值详见表2。其中,200~320 倍稀释样本的DNA经浓缩后,STR 基因座检出率有不同程度的提高,但从整体结果看,浓缩处理对检出率的提升效果并不明显。如加黑机油处理的样本,在320 倍稀释时,基因座检出率仅由浓缩前的0 提高到19.05%,约4 个基因座检出;加铁锈处理的样本,在280 倍稀释时,基因座检出率仅由浓缩前的0 提高到14.29%,约3 个基因座检出。
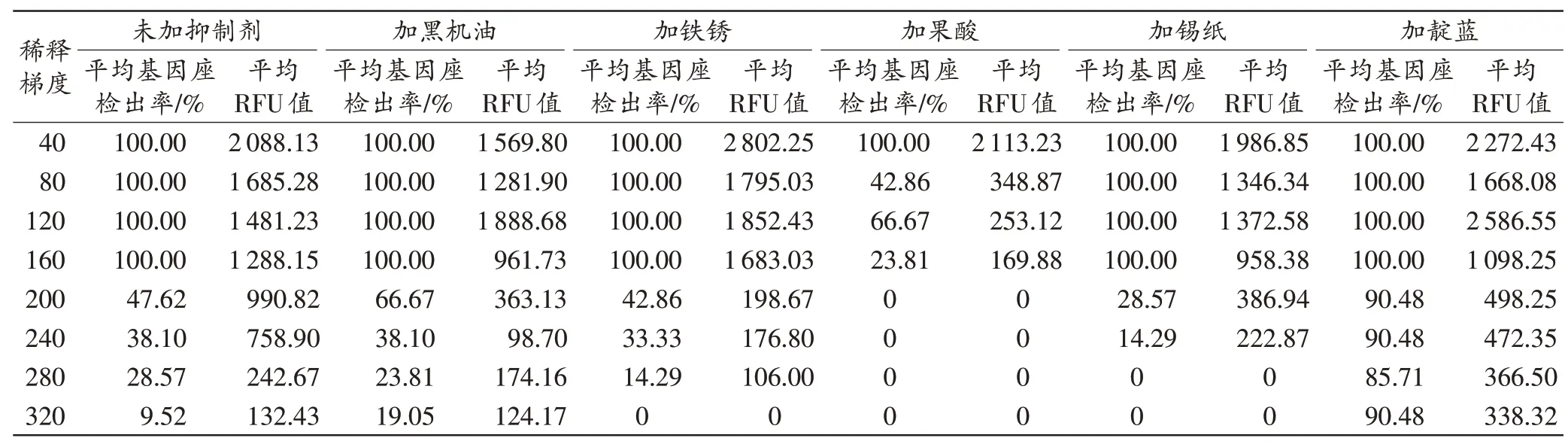
表2 6种方式处理的梯度样本DNA浓缩后的STR基因座平均检出率和平均RFU值Tab.2 Average STR loci detection rate and RFU of gradient samples after DNA concentration in 6 ways
2.3 QS分型图谱对提取仪提取效果的判断
除加果酸处理的样本外,其他5 种处理方法的样本经过提取仪纯化后,检测得到的STR 分型图谱中QS 均成功扩增,且峰高相当,表现出未被抑制剂影响的分型结果。加果酸处理的样本的STR 分型出现大片段丢失,且QS2 峰高已下降至QS1 的20%以下,说明样本被抑制,未能成功检验。详见图1。

图1 160倍稀释的梯度样本QS分型图谱Fig.1 QS genetype map of 160 fold diluted gradient samples
3 讨论
根据罗卡定律(Locard exchange principle),凡是两个物体接触,必然会产生转移[5]。所以,案发现场会存在大量由接触而留下的脱落细胞。据报道[6],接触性脱落细胞DNA 含量多为100~1 500 pg,由于DNA 含量低、现场情况复杂等因素造成该类样本提取难度大。本研究通过对单一来源的人外周血进行40、80、120、160、200、240、280、320 倍稀释,模拟DNA 含量低的接触性样本。理论上,样本的DNA 含量计算,按照正常成年人血液中用于核酸提取的部分主要是白细胞,而正常成年人每微升血液中白细胞总数为4 000~10 000 个[7-8],即本研究中20 μL 的起始样本中理论上含有白细胞80 000~200 000 个,梯度稀释后每个样本取5 μL 进入提取仪进行DNA 提取,即160、200、240 倍稀释时置于提取仪中进行DNA 提取的样本白细胞数量分别约为125~313、100~250、83~208,根据单个细胞所含DNA 量约为6.6 pg[9],上述3 个稀释梯度的样本投入提取仪中的DNA 分别为825~2 066 pg、660~1 650 pg、548~1 373 pg,大部分处于脱落细胞DNA 含量的范围。本研究以未加抑制剂的样本检测结果作为参照,排除抑制剂的干扰,对40~160 倍稀释的样本(DNA 约825~8 250 pg)均可以得到完整的STR 分型结果。对于大部分抑制剂存在的情况,该提取仪也能对200~240倍稀释的样本(DNA约548~1650pg)有4.80%~85.71%的基因座检出。综上所述,该提取仪可以成功检测部分DNA 含量较低的脱落细胞检材。另外,考虑本研究样本来源单一,且本实验中仅靠理论计算进行样本稀释,未精确定量,所以会在后续研究中考虑使用精确定量样本,并结合实际案件样本继续验证该提取仪的DNA 提取效率和回收率。
目前疑难检材DNA 检验的方法主要是硅珠(膜)法和磁珠法,其原理是利用DNA 在一定的盐离子浓度和pH 值下能实现与硅(磁)珠特异性结合,通过洗涤液去除残留在DNA 表面的脂类、蛋白质和盐离子等,最后通过改变条件,将干净的DNA 从硅(磁)珠上洗脱下来[10-12]。影响其提取效率的因素主要有与硅(磁)珠结合的DNA 量,DNA 在洗涤过程中的损失程度以及最后洗脱步骤中DNA 的回收率。目前大部分DNA自动化纯化仪主要根据该原理进行设计,提取效率的高低在于不同的优化步骤。充足的硅(磁)珠量,样本与其结合的时间,以及洗涤试剂和洗涤次数的优化,可以有效降低DNA 损失,充分去除样本中的抑制剂成分。本研究使用的提取仪是根据磁珠法的原理设计,DNA 提取过程中采用转移磁珠的方式进行样本的结合、洗涤和洗脱,最大程度减少了提取过程中的试剂残留对后续检测的影响。在时间上,该提取仪单次运行最大样本量为24 份,无需上机前的预处理操作,仪器运行时间约90 min,操作简单、高效,可有效去除抑制剂,减少人为干扰[13]。
实际案件现场往往具有高度的复杂性,提取到的生物检材种类较为多样,且生物检材中通常都会包含一些抑制剂,这些抑制剂将会影响DNA 的提取及检验。本研究挑选了5 种在日常检案中可能会碰到的抑制剂,如门锁或机动车上的黑机油、盗窃案中使用的锡纸、牛仔裤上的靛蓝、铁锈和果酸。根据Investigator 24plex QS 试剂盒的QS 质控结果可以看出,提取仪可以有效去除黑机油、锡纸、铁锈和靛蓝这些抑制剂,不影响DNA 的检测结果,但对于较新鲜的果酸去除效果较差,只在样本DNA 含量较高的情况下才可以得到完整的STR 分型结果。因此,本研究中使用的提取仪可以解决大部分生物检材中包含的抑制剂问题,进行DNA 的有效检验。
浓缩作为微量疑难检材提取中常用的方法,目前常用的有Amicon 离心超滤管、DNA Clean &Concentrator-5 试剂盒、Microcon-100 法等,需在不同的管柱间转移DNA 模板,容易造成DNA 损耗,同时增加了污染的风险。本研究使用的浓缩仪采用的是改良的物理浓缩法,主要利用离心、加热和真空作用挥发液体,达到快速浓缩、干燥DNA 的目的。在达到固定转速后启动真空抽吸,将挥发的液体回收至密闭容器,有效避免了样品交叉污染和实验室污染[14]。由于本研究为单一样本来源,所以无法判断真空浓缩操作是否会导致样本间污染。同时,对比DNA 浓缩处理前后同一份样本的STR 分型结果,可见RFU 值有所提高,样本DNA 的浓缩处理也提高了部分样本的基因座检出率,但效果并不明显。杨静开等[14]研究发现,抑制剂含量低的DNA 经浓缩7.7 倍后,对样本的检出率以及图谱分型的峰高、峰均衡性等均有明显改善,所以真空离心浓缩技术更适用于纯化后模板体积较大、抑制剂少、原检测图谱分型不理想的DNA 样本浓缩,可以提高微量检材的检验成功率。而本研究中所使用的的提取仪,原本就为小体积(30 μL)洗脱,其中6 μL的DNA 洗脱液直接进行扩增检测,剩余部分则置于真空浓缩仪浓缩后进行扩增检测,DNA 浓缩的空间有限,所以最终体现出来的效果也并不明显,需要进一步的测试验证效果。
综上所述,本研究使用的磁珠法全自动核酸提取仪具有操作简单、灵活高效、抑制剂去除效果好等特点,全自动的操作方式能有效减少人为因素对实验的影响,减少DNA 损失,结果的准确性更有保障。另外,本研究发现真空浓缩仪可在一定程度上提高微量样本的检测效果,两者相结合,可为含有抑制剂的微量生物检材的提取提供一个可行的解决方案。
