麦麸阿魏酸糖酯微生物发酵工艺优化及体外抗氧化和益生活性评价
2021-06-16陈秋燕郝希然安晓萍齐景伟
陈秋燕,郝希然,王 园,杜 涓,安晓萍,齐景伟
(内蒙古农业大学动物科学学院,内蒙古自治区草食家畜饲料 工程技术研究中心,内蒙古呼和浩特 010018)
全谷物是由种皮、胚乳和胚等组成且组成部分的相对比例与天然谷物籽粒构成相同的谷物原料,常见的全谷物有全小麦、燕麦、黑米、荞麦等。食用全谷物可有效降低肥胖病、高血压病、糖尿病和某些胃肠疾病的发病率[1],因此,全谷物的食用价值受到越来越多的关注。研究证实,全谷物的保健功效与其含量丰富的维生素、矿物质、类胡萝卜素和酚酸等活性物质有关,特别是其中的酚酸类物质,可通过激活Nrf2-ARE信号通路,上调下游抗氧化酶和谷胱甘肽的表达,起到抗氧化作用[2]。
阿魏酸(Ferulic acid,FA)是全谷物中含量最为丰富的酚酸类物质,通常以酯键与细胞壁多糖或以醚键与木质素相连[3]。体内、外研究表明,FA具有较强的抗氧化活性,可有效清除自由基[4-5],提高机体抗氧化功能[6]。阿魏酸糖酯(Feruloylated glycosides,FGs)是阿魏酸羧基与糖中不同位置上的糖羟基酯化而形成的一类化合物[7]。全谷物进入消化道后,可经由后肠道微生物发酵产生FGs。研究发现FGs具有比游离FA更强的抗氧化能力[8-9],并且具有促进双歧杆菌增殖[10]、抑制红细胞溶血[11]和抵抗糖尿病[12]的作用。
麦麸作为小麦加工副产品,富含膳食纤维、酚酸等对人体有益的生物活性物质,为整个谷物籽粒功能性营养价值的核心[13]。FA在麦麸酚酸类物质中占主导地位,含量高达2677.4~3401.8 μg/g[14]。因此,麦麸是制备FGs的良好资源[9,15-16]。目前,FGs的制备方法有物理法[17-18]、化学法[15,19]以及酶解法[9,20],但存在FGs易被分解,化学物质残留,成本高昂等问题。固态发酵是一种控制营养物质释放的可行方法,可直接利用微生物发酵生产酶来制备FGs。解春艳[21]利用食药用真菌茶薪菇发酵麦麸,制备了具有抗氧化、益生和抗肿瘤作用的FGs。余晓红[22]利用选育出的出芽短梗霉发酵麦麸,其制备的FGs具有免疫调节和抗肿瘤活性。卜雯丽等[23]利用出芽短梗霉固态发酵啤酒糟制备出了FGs。然而,固态发酵制备FGs所使用的发酵菌种多为霉菌,非常见的食品级微生物。因此,本研究以植物乳杆菌、酿酒酵母、地衣芽孢杆菌以及枯草芽孢杆菌为发酵菌种,固态发酵麦麸制备FGs,在优化最佳发酵工艺参数的同时,评价FGs体外抗氧化和益生活性,以期为麦麸的合理利用及FGs的工业化生产提供帮助。
1 材料与方法
1.1 材料与仪器
麦麸 市场;低聚果糖(纯度≥90%) 美国Sigma公司;菊粉(纯度≥90%) 北京酷来搏科技有限公司;营养肉汤培养基、MRS肉汤培养基、麦芽汁培养基 广东环凯微生物科技有限公司;硼砂、甘氨酸、DPPH、无水乙醇、FeSO4、H2O2、水杨酸、三氯乙酸、K3Fe(CN)6、FeCl3国药集团化学试剂有限公司;植物乳杆菌(Lactobacillusplantarum,L)CGMCC1.2437、枯草芽孢杆菌(Bacillussubtilis,B1)CGMCC 1.0892、地衣芽孢杆菌(Bacilluslicheniformis,B2)CGMCC1.813、酿酒酵母(Saccharomycescerevisiae,S)CGMCC 2.119、嗜热链球菌(Streptococcusthermophilus)CGMCC 1.2471 均为本实验室保存。
HVA-85型压力灭菌器 日本Hirayama公司;SW-CJ超净工作台 上海新苗医疗器械;QYC-200恒温培养摇床 上海福玛实验设备有限公司;LRH-250F生化培养箱 上海一恒科学仪器有限公司;TDL-5-A型台式高速离心机 上海安亭科学仪器厂;微孔板分光光度计 美国Bio-Rad公司。
1.2 实验方法
1.2.1 种子液制备 枯草芽孢杆菌和地衣芽孢杆菌使用营养肉汤培养基,植物乳杆菌使用MRS肉汤培养基,酿酒酵母使用麦芽汁培养基,将各菌种所需培养基灭菌(121 ℃,0.1 MPa)备用。枯草芽孢杆菌和地衣芽孢杆菌培养温度为37 ℃,摇床转速为120 r/min,培养24 h;植物乳杆菌温度为37 ℃,静置培养24 h;酿酒酵母培养温度为28 ℃,摇床转速为120 r/min,培养24 h;分别使菌体浓度达到108CFU/mL。
1.2.2 菌种筛选
1.2.2.1 单菌种发酵 灭菌后的麦麸按10%接种量分别接入单一菌种,料水比1∶1,搅拌均匀,置于37 ℃生化培养箱中静置发酵培养48 h。测定发酵产物中FGs产量,对比单菌发酵效果。
1.2.2.2 混菌发酵 灭菌后的麦麸按10%总接种量分别接入双菌组合(接种比例为1∶1)、三菌(接种比例为1∶1∶1)和四菌(接种比例为1∶1∶1∶1)混合发酵,料水比1∶1,搅拌均匀,置于37 ℃生化培养箱中静置发酵培养48 h。测定发酵产物中FGs产量,对比混菌发酵效果。
1.2.3 发酵条件优化
1.2.3.1 单因素实验设计 根据FGs的发酵制备工艺,以枯草芽孢杆菌∶地衣芽孢杆菌∶酿酒酵母=1∶1∶1为发酵菌种,设定接种量10%、发酵温度37 ℃、发酵时间48 h、料水比1∶1为固定条件,分别研究接种量(5%、7.5%、10%、12.5%、15%)、发酵温度(32、37、42、47 ℃)、发酵时间(24、36、48、60、72 h)、料水比(1∶0.5、1∶1、1∶1.5、1∶2、1∶2.5 g/mL)对发酵产物中FGs产量的影响。
1.2.3.2 响应面优化试验 根据单因素试验结果,选取最优的接种量(12.5%)、发酵温度(42 ℃)、发酵时间(60 h)、料水比(1∶1)为中心点,以发酵产物中FGs产量为响应值,采用Box-Behnken实验设计4因素3水平的响应面优化试验。响应面优化试验因素设计如下表1。

表1 响应面试验设计各因素水平Table 1 Code and level of independent variables used for Box-Behnken design
1.2.4 FGs的提取 发酵结束后,取发酵样品置于鼓风干燥箱中45 ℃烘干48 h,将烘干样品粉碎,取干燥发酵麦麸以料水比为1∶10加入蒸馏水中,在水浴锅中80 ℃浸提30 min,冷却离心(5000 r/min,10 min),取上清备用[24]。
1.2.5 FGs浓度的测定 利用双波长法[16]测定FGs浓度,发酵麦麸水提液:硼砂-甘氨酸缓冲溶液(0.1 mL/L,pH=10)按1∶9比例混合,分别于345和375 nm处测定吸光度(OD)。根据FA的摩尔吸光系数(M-1cm-1):ε′345=19662,ε′375=7630和FGs的摩尔吸光系数(M-1cm-1):ε345=23064,ε375=31430,计算FGs浓度。
C=[(ε′345×A375-ε′375×A345)b/(ε′345×ε375-ε345×ε′375)]/C0
式中:C为发酵麦麸中FGs浓度(nmol/g);b为比色皿厚度(cm);A345为波长345 nm处OD值;A375为波长375 nm处OD值;C0为发酵麦麸水溶液浓度(mg/mL)。
1.2.6 FGs体外抗氧化活性评价
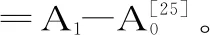
1.2.6.2 DPPH自由基清除率的测定 准确吸取2 mL浓度为(0、0.5、1、2、4 mg/mL)的发酵麦麸FGs于试管中,加入2 mL DPPH乙醇溶液(0.5 mmol/L)混匀,静止30 min后在517 nm处测定吸光度(A0),同时测定只加95%乙醇的DPPH溶液吸光度(A1)以及对照组吸光度(A2),以BHA为阳性对照,其中DPPH自由基的清除率(%)=[1-(A0-A1)/A2]×100[26]。
1.2.6.3 羟基自由基清除率的测定 准确吸取0.5 mL浓度为(0、0.5、1、2、4 mg/mL)的发酵麦麸FGs于试管中,加入0.5 mL FeSO4溶液(9.0 mmol/L)与0.5 mL H2O2(8.8 mmol/L),室温反应10 min,加入0.5 mL水杨酸乙醇溶液(9.0 mmol/L),室温反应30 min,与510 nm处测定吸光度(A1),同时测定蒸馏水代替FeSO4溶液吸光度(A2)以及对照组吸光度(A0);计算羟基自由基的清除力[26],其中羟基自由基的清除率(%)=[1-(A1-A2)/A0]×100。
1.2.7 FGs的益生活性评价 将植物乳杆菌和嗜热链球菌接种到MRS肉汤液体培养基中,(37±0.1) ℃静置厌氧培养24 h,取菌悬液备用。以无碳水化合物的MRS培养基作为基础培养基(阴性对照),分别添加10 mg/mL的低聚果糖、菊粉和发酵麦麸FGs。所有培养基均灭菌(121 ℃,0.1 MPa)30 min,冷却后分别接种0.5%植物乳杆菌或嗜热链球菌菌悬液,37 ℃静置厌氧培养,每4 h在600 nm处测定OD值,以相对培养0 h OD 值的增长量绘制植物乳杆菌和嗜热链球菌的生长曲线[27]。
1.3 数据处理
采用Minitab 17软件进行响应面试验设计及结果分析;SAS 9.2统计软件ANOVA模型进行单因素方差分析,用Duncan’s检验进行多重比较,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 菌种筛选
2.1.1 不同单菌种对发酵麦麸FGs产量的影响 不同单菌种发酵对FGs产量的影响见图1。由图1可以看出,枯草芽孢杆菌发酵麦麸获得的FGs产量显著高于其他发酵菌种(P<0.05),经过单菌种固态发酵,发酵麦麸FGs产量最高的菌种是枯草芽孢杆菌,其次是植物乳杆菌和酿酒酵母,最低是地衣芽孢杆菌。
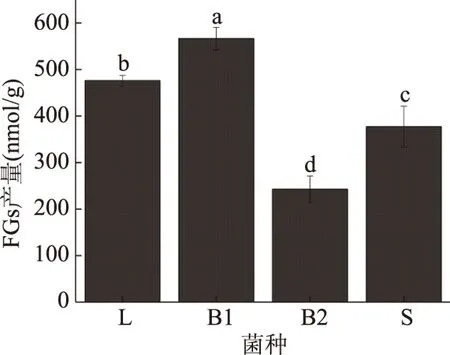
图1 不同单菌种对FGs产量的影响Fig.1 Effects of single starter strain on FGs yield注:不同小写字母表示差异显著(P<0.05); 相同字母表示差异不显著(P>0.05); L表示植物乳杆菌,B1表示枯草芽孢杆菌, B2表示地衣芽孢杆菌,S表示酿酒酵母;图2~图6同。
2.1.2 混合种菌发酵对发酵麦麸FGs产量的影响 混合菌种发酵对FGs产量的影响见图2。由图2可以看出,枯草芽孢杆菌+地衣芽孢杆菌+酿酒酵母菌组合发酵得到的FGs产量最高,FGs产量为655.90±30.61 nmol/g,显著高于其他组合(P<0.05)。另外,混合菌种发酵获得的FGs产量高于单菌种发酵,表明混合菌种发酵可以利用不同菌种间的互补性和协同性,降低单菌发酵的劣势,提高FGs的产量[28-30]。因此选择枯草芽孢杆菌+地衣芽孢杆菌+酿酒酵母组合固态发酵麦麸制备FGs。

图2 混合种菌发酵对FGs产量的影响Fig.2 Effects of different starter strain combination on FGs yield
2.2 发酵条件优化
2.2.1 接种量对FGs产量的影响 由图3可知,接种量在5%~15%的范围内,FGs产量呈现先增加后减少的趋势。随着接种量的增加,发酵所产生的麦麸FGs含量逐渐增加,接种量达到12.5%之后,FGs产量出现逐渐下降的趋势,由于接种量过多,菌种需要的营养物质增加,导致溶氧含量不足[31],影响FGs的合成。虽然接种量15%与接种量12.5%时的FGs产量差异不显著(P>0.05)。但考虑到生产成本,选择12.5%作为响应面优化试验的接种量中心点。
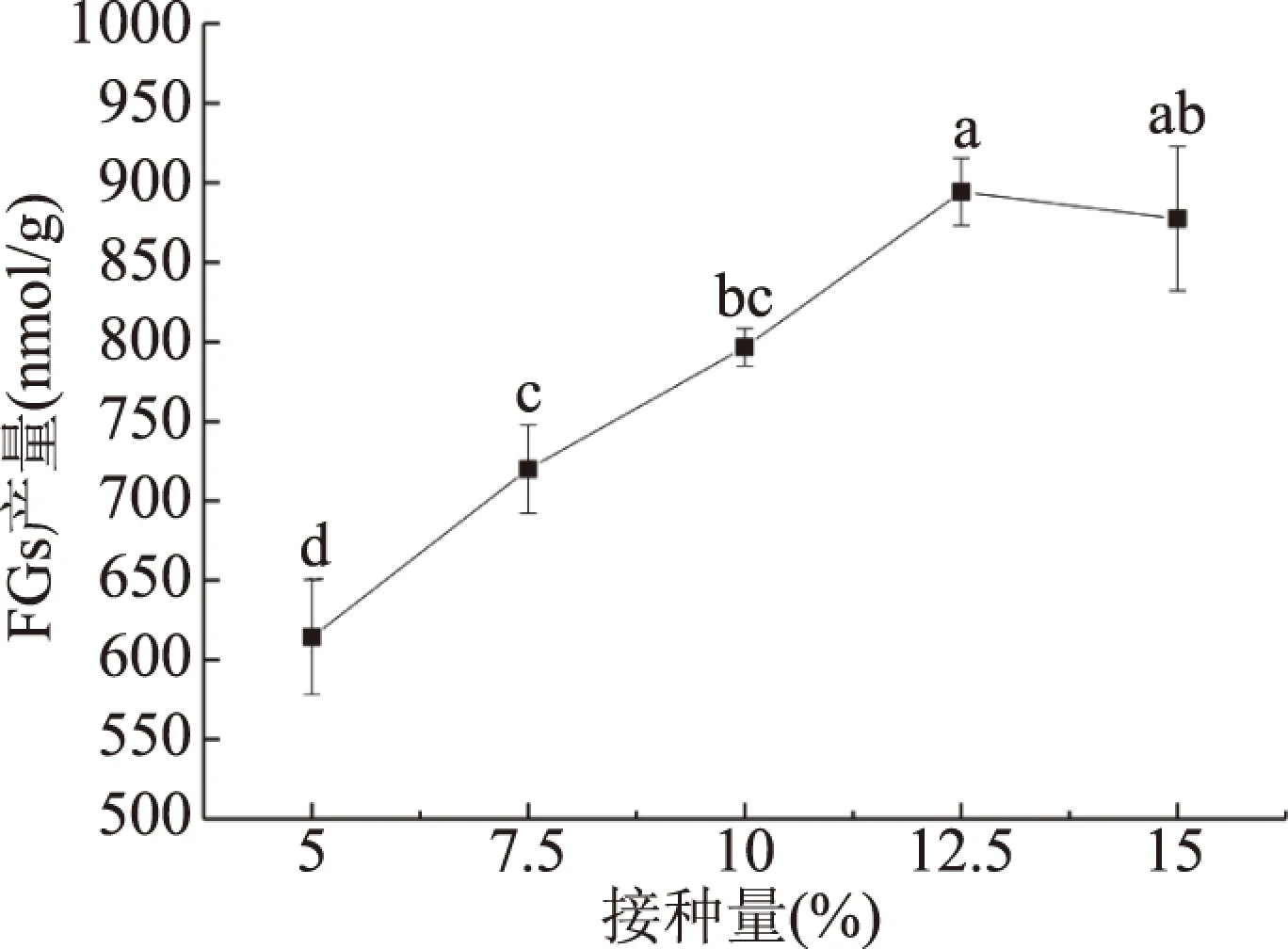
图 3 接种量对FGs产量的影响Fig.3 Effects of level of inoculum on FGs yield
2.2.2 发酵温度对FGs产量的影响 由图4可知,随着发酵温度的增加,FGs产量逐渐升高。在发酵温度为42 ℃时,FGs产量最高,显著高于其他发酵温度(P<0.05)。可能是因为混合菌种的生长对温度要求较高,只有在适宜温度范围内,菌种才能发挥最大的作用,温度过低,不利于菌种生长,FGs产量低;而温度太高,菌种快速生长,大量孢子出现老化,菌种活力降低[30,32],FGs产量下降。因此,选择42 ℃作为响应面优化试验的发酵温度中心点。
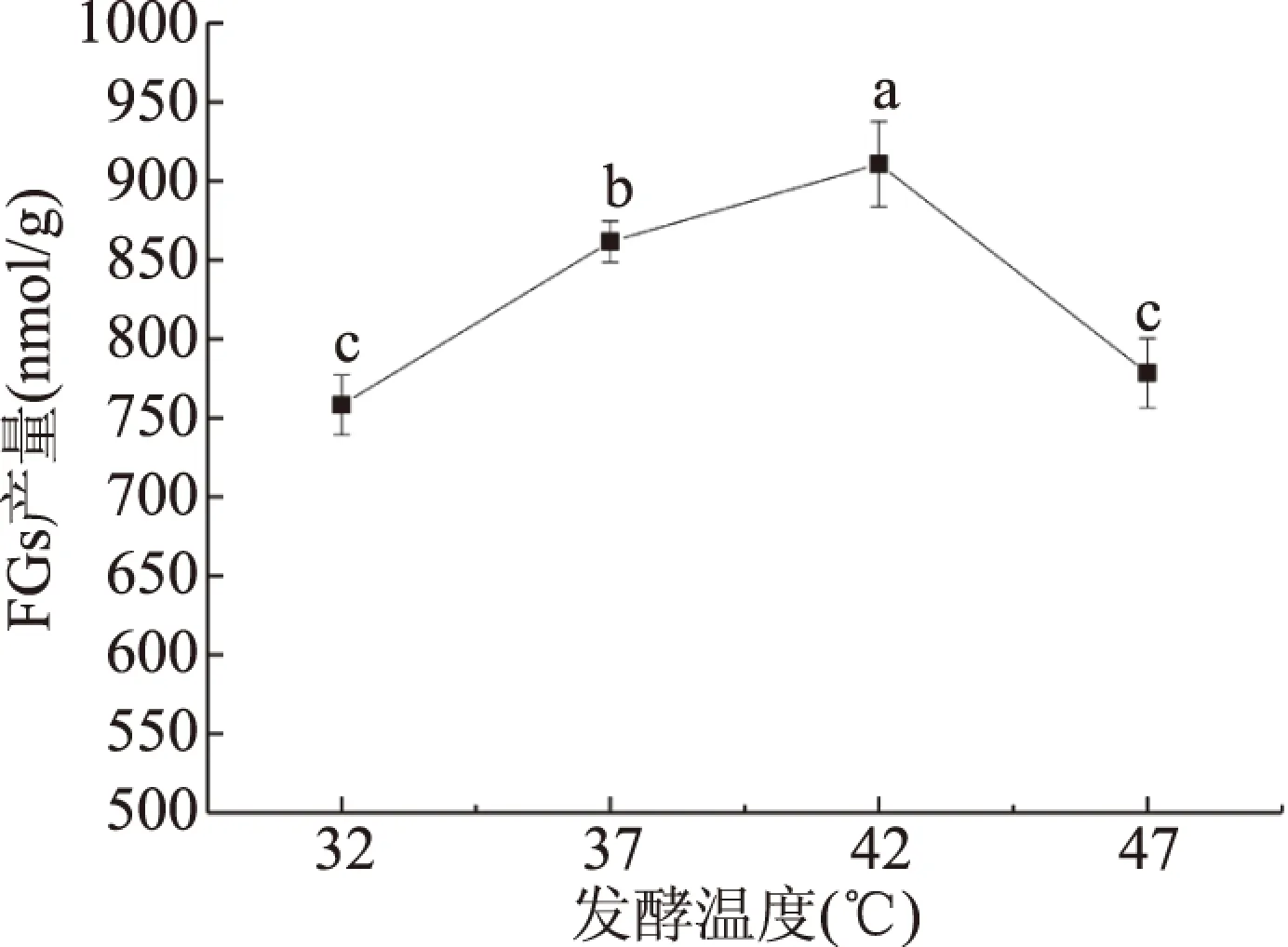
图4 发酵温度对FGs产量的影响Fig.4 Effects of incubation temperature on FGs yield
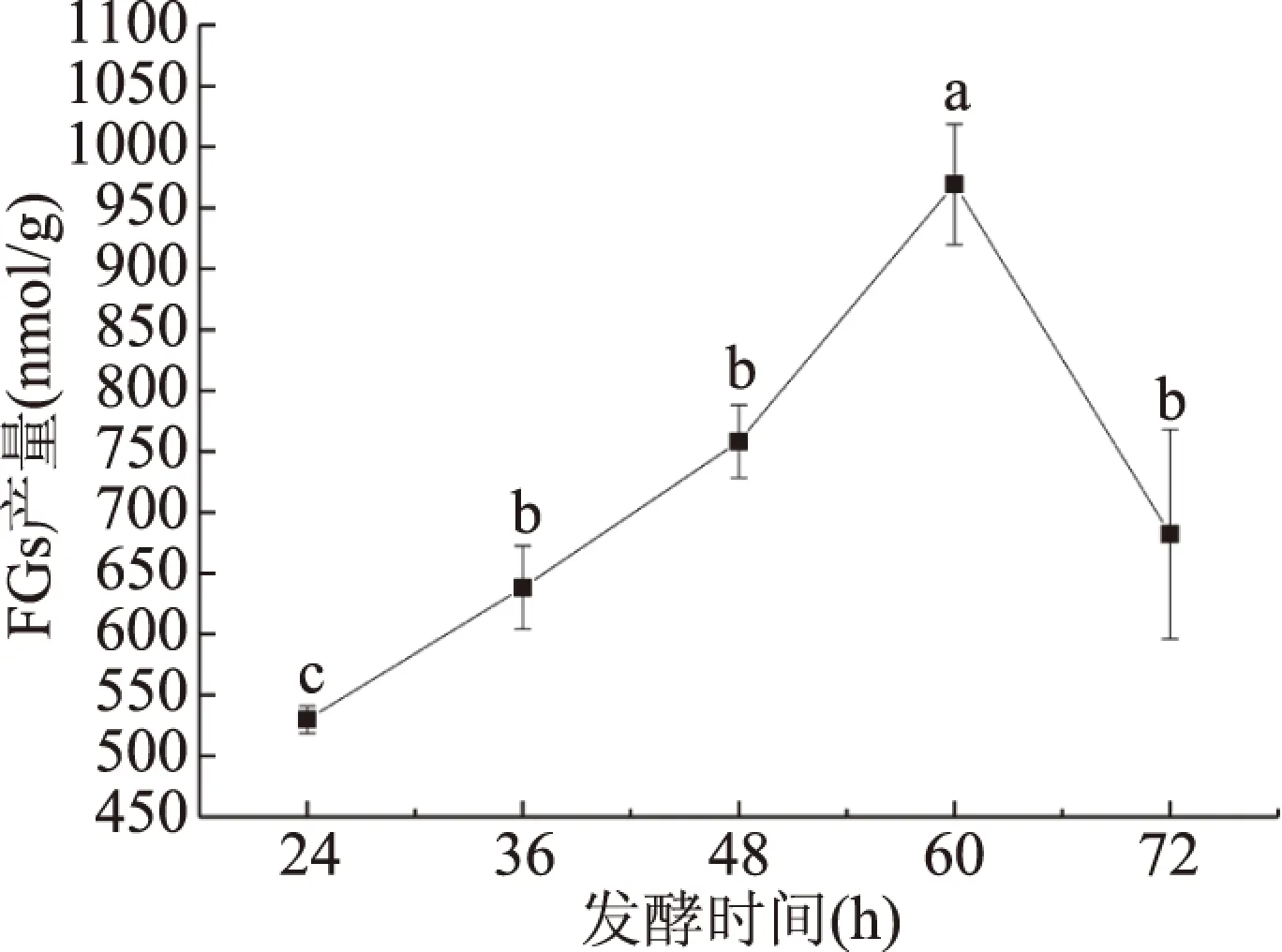
图5 发酵时间对FGs产量的影响Fig.5 Effects of incubation duration on FGs yield
2.2.3 发酵时间对FGs产量的影响 由图5可知,发酵时间为24~60 h,发酵麦麸FGs产量逐渐升高,发酵60 h时FGs产量最高,显著高于其他发酵时间(P<0.05),继续延长发酵时间,FGs产量反而降低。可能是由于在发酵开始阶段,麦麸中可用营养物质较多,能满足菌种快速生长的需要,随发酵时间延长,菌种开始逐渐老化[33],麦麸中营养物质被消耗所剩不多,FGs产量降低。因此,选择60 h作为响应面优化试验的发酵时间中心点。
2.2.4 料水比对FGs产量的影响 由图6可知,随着料水比的增加,发酵麦麸FGs产量先增加后下降。其中,当料水比为1∶1时,FGs产量达到最高,与1∶1.5和1∶2组差异不显著(P>0.05),显著高于1∶0.5和1∶2.5组(P<0.05)。当料水比增加到1∶2.5时,FGs产量显著下降(P<0.05)。由于发酵料中水分太多会产生黏稠结块现象[31],不利于麦麸大分子物质的降解。因此,选择1∶1作为响应面优化试验的料水比中心点。

图6 料水比对FGs产量的影响Fig.6 Effects of material to water ratio on FGs yield
2.2.5 响应面试验结果与分析 利用Design-Expert 8.0.6分析,通过对表2中的FGs产量试验数据进行多元回归拟合,选择对响应值显著的各项,可得接种量、发酵温度、发酵时间、料水比对发酵产物中FGs产量的二次回归方程为:FGs产量(nmol/g)=1289.31+9.11A+34.26B-4.13C+121.68D-23.21AB+19.27AC-129.10AD-66.04BC+6.50BD-23.98CD-54.56A2-245.70B2-104.76C2-263.02D2。
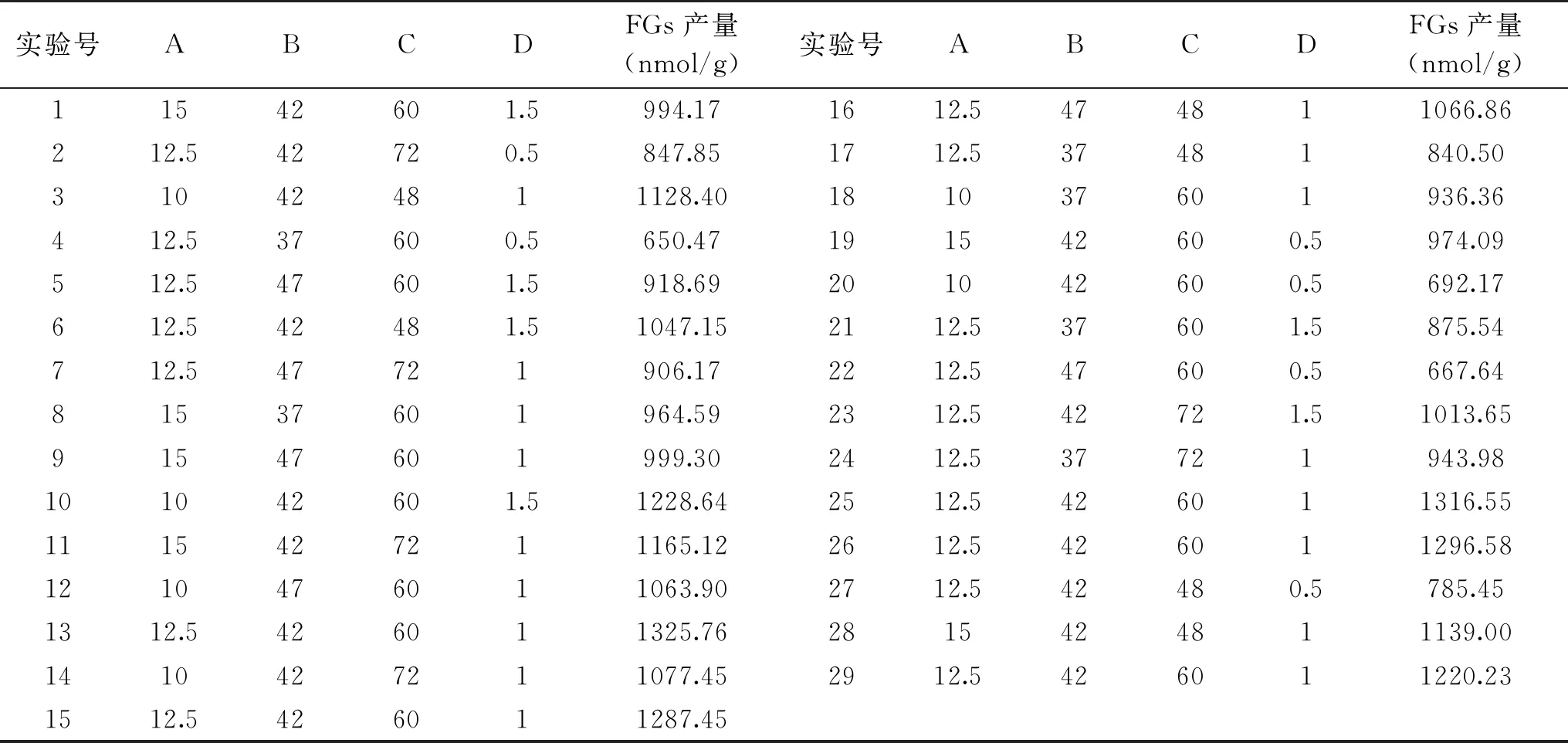
表2 响应面优化试验设计与结果Table 2 Experimental design and results for response surface analysis
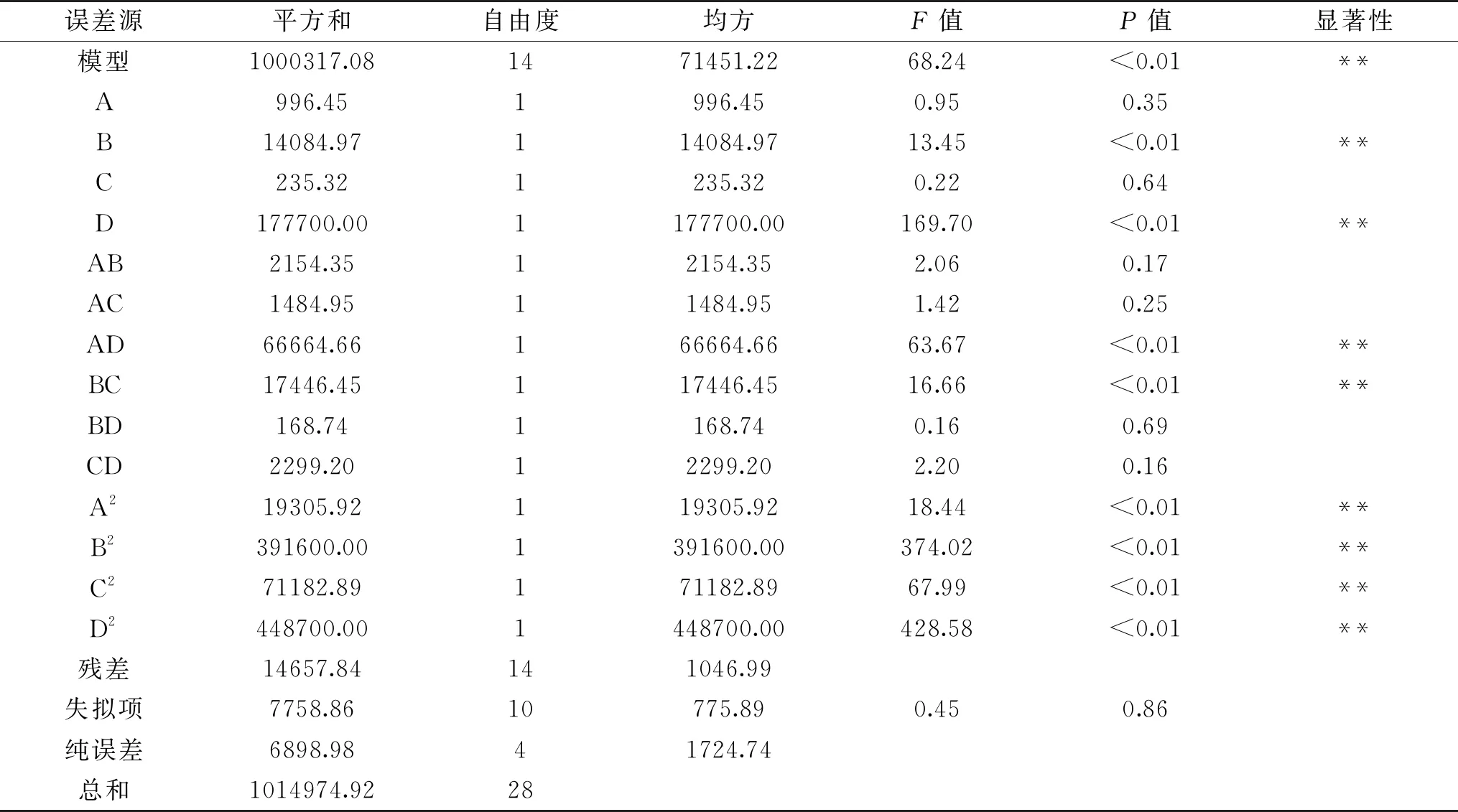
表3 响应面方差分析结果Table 3 Analysis of variance for response surface regression model
模型方程显著性检验结果见表3。从表3可知,该模型P值小于0.01,表明回归模型极显著;失拟项P值为0.86,大于0.05,失拟项不显著,试验设计可靠。其中复相关系数的平方98.56%(R2=98.56%),表明98.56%的FGs产量变化可以用这个模型进行解释。线性系数(B发酵温度、D料水比)、二次项系数(A2、B2、C2、D2)和双因子交互作用系数(AD和BC)对FGs产量的影响都差异显著(P<0.05),而其他线性系数和双因子交互作用系数对FGs产量的影响差异不显著(P>0.05)。
四个发酵条件(A接种量、B发酵温度、C发酵时间、D料水比)之间交互作用对FGs产量的影响如图7所示。由图7可知:B发酵温度和D料水比对FGs产量的影响为显著(P<0.05),表现为曲线较陡;A接种量和C发酵时间对FGs产量的影响不显著,表现为曲线平滑。

图7 两因素交互作用对FGs产量的响应面图Fig.7 Response surface plots showing the interactive effects of fermentation parameters on FGs yield
2.2.6 最优条件及验证试验 由Design-Expert 8.0.6统计分析软件中响应面优化器并为了方便实际操作,确定最佳发酵条件为:接种量为10.7%,发酵温度为42.5 ℃,发酵时间为58.5 h,料水比为1∶1.16,发酵产物中FGs产量的理论值为1309.46 nmol/g。用得到的最佳发酵条件进行验证试验,6次平行试验得到发酵产物中实际FGs产量为1273.18±113.25 nmol/g,与理论值相差2%,差值小于3%。
2.3 体外抗氧化活性结果
2.3.1 还原力 还原力为活性物质提供电子的能力,单电子氧化还原电位越低的活性物质其还原力越强,因此,还原力可以作为评价天然化合物潜在抗氧化活性的一个重要指标[34-35]。发酵麦麸FGs还原力大小如图8所示,还原力与发酵麦麸FGs溶液浓度呈剂量依赖性增加;发酵麦麸FGs溶液浓度在4 mg/mL时,虽然其还原力仍显著低于标准品BHA(P<0.05),但可达到1.078,可能是FGs结构中具有阿魏酰基和亲水性的低聚糖基团,这些基团的存在降低了氧化还原电位[36],因此发酵麦麸FGs具有较强的还原能力。
2.3.2 DPPH自由基清除率 DPPH自由基可以接受一个电子或一个氢自由基成为稳定的抗磁分子[37],被广泛用于检测各种天然产物清除自由基的能力,一种物质清除DPPH自由基的能力强弱可以反应其抗氧化活性大小[35,38]。发酵麦麸FGs对DPPH自由基的清除率如图8所示,DPPH自由基清除率随着发酵麦麸FGs溶液浓度增加呈显著先增加后趋于平缓的趋势,虽然不同浓度的发酵麦麸FGs溶液对DPPH自由基清除率低于标准品BHA(P<0.05),但DPPH自由基清除率在发酵麦麸FGs浓度为1 mg/mL时可达高到87.42%,且与标准品BHA差异不显著(P>0.05),可能是因为FGs具有阿魏酰基的酚羟基,DPPH自由基更容易与酚羟基上的氢原子反应[36],因此发酵麦麸FGs具有较高DPPH自由基清除能力。
2.3.3 羟基自由基清除率 羟基自由基具有极强的氧化活性,能够直接损伤细胞中核酸、蛋白质、脂质等生物大分子,已被认为是一种对生物体非常有害的氧化剂[34]。发酵麦麸FGs对羟基自由基的清除能力由图8可得,发酵麦麸FGs对羟基自由基清除效果与发酵麦麸FGs溶液浓度呈正相关,浓度在0.5~4 mg/mL之间时,同一浓度下发酵麦麸FGs溶液对羟基自由基清除效果显著低于标准品BHA(P<0.05);当浓度为4 mg/mL时,虽然其羟基自由基清除率仍显著低于标准品BHA(P<0.05),但可达到33.68%。由于FGs结构中有阿魏酸和低聚糖基团的存在,使其更容易和羟基自由基反应,因此发酵麦麸FGs具有较高羟基自由基清除能力。
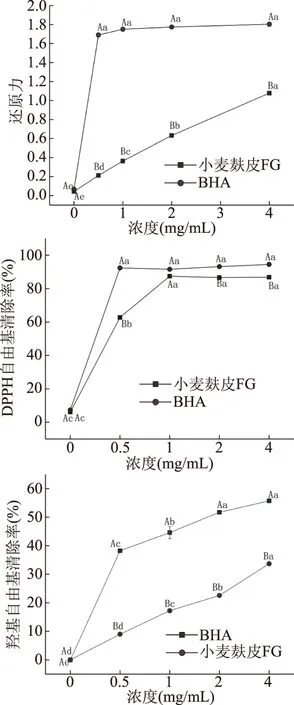
图8 不同浓度发酵麦麸FGs体外抗氧化活性 Fig.8 In vitro antioxidant activity of fermented wheat bran FGs注:大写字母不同表示组间差异显著(P<0.05); 小写字母不同表示组内差异显著(P<0.05)。
2.4 体外益生活性结果
发酵麦麸FGs对植物乳杆菌和嗜热链球菌增殖的结果见图9。如图所示,四个处理组中菌液OD值均随着培养时间的延长而增加,表明低聚果糖、菊粉和发酵麦麸FGs对植物乳杆菌和嗜热链球菌的生长均有一定促进作用。分子量是影响碳水化合物益生元对益生菌增殖的重要因素之一,低分子量不易消化的碳水化合物具有较好的促增殖作用,分枝度对益生菌增殖也有影响[39-40]。如图9A所示,发酵麦麸FGs对植物乳杆菌增殖的促进作用显著低于菊粉(P<0.05),在整个生长过程都显著高于阴性对照组和低聚果糖组(P<0.05),可能是FGs比低聚果糖多了酯键的存在,其分子量比低聚果糖低,所以对植物乳杆菌的增殖作用更好。如图9B所示,低聚果糖、菊粉和发酵麦麸FGs对嗜热链球菌的增殖影响存在时间差异,在0~8 h之间,发酵麦麸FGs对嗜热链球菌增殖的促进作用显著优于阴性对照与低聚果糖(P<0.05),而在8 h之后,低聚果糖对嗜热链球菌增殖的促进作用更为显著(P<0.05)。这是由于麦麸FGs含有阿魏酰基和亲水性的糖体部分[36],提高了其溶解度,水溶性好的发酵麦麸FGs可被嗜热链球菌更方便、快速和完全地利用[40],因此,前期发酵麦麸FGs对嗜热链球菌增殖具有较强的促进作用,而后期的促进增殖作用降低。Yuan等[10]研究发现FGs 对双歧杆菌的增殖作用显著高于低聚木糖,与本研究结果相似。由以上结果可得,发酵麦麸FGs具有一定的促进益生菌增殖作用,在一定发酵麦麸FGs浓度下,其增殖作用与所作用益生菌种类有关。
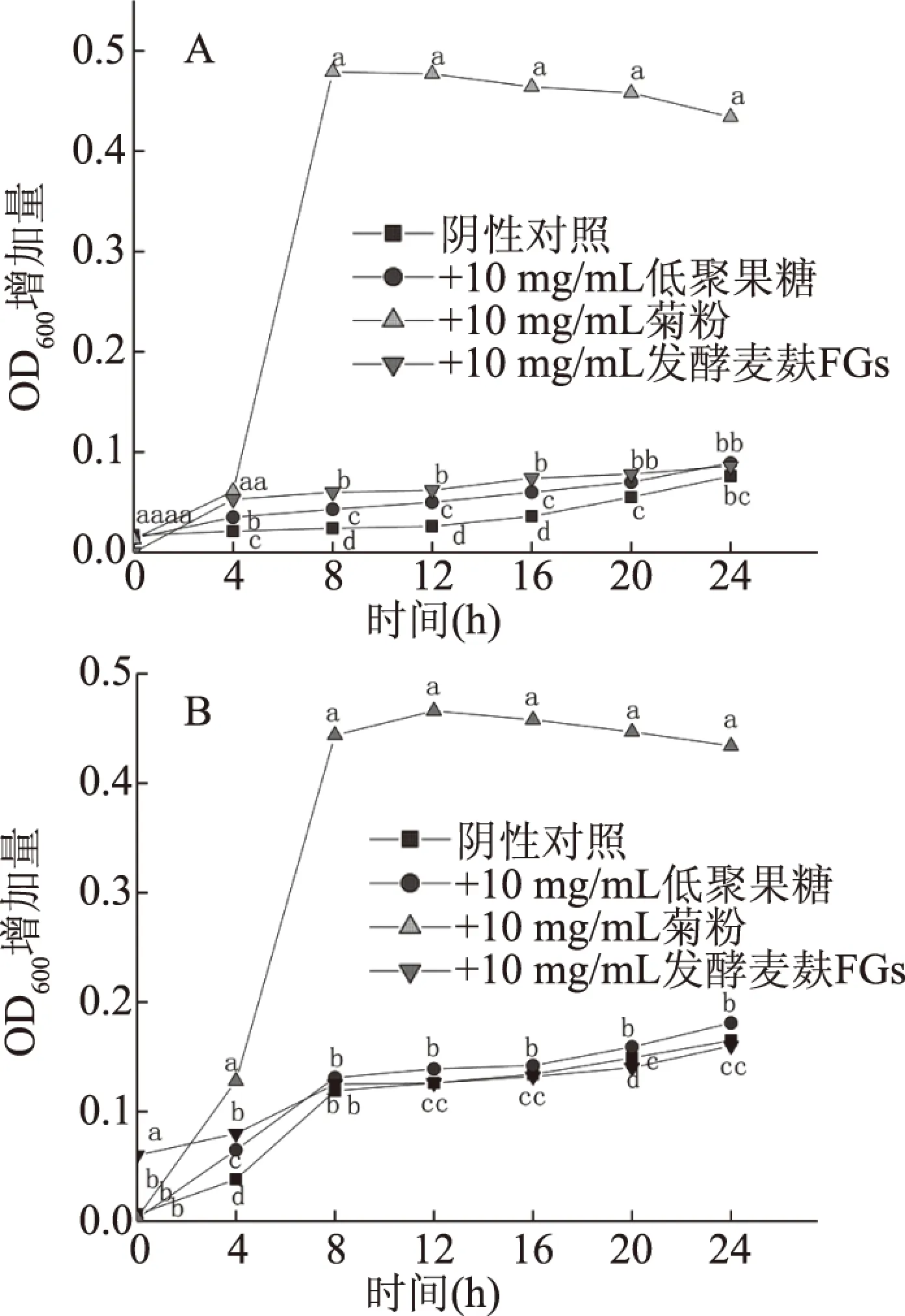
图9 发酵麦麸FGs对植物乳杆菌和嗜热链球菌生长的影响Fig.9 Effects of fermented wheat bran FGs on the growth of Lactobacillus plantarum and Streptococcus thermophiles注:A发酵麦麸FGs对植物乳杆菌生长的影响; B发酵麦麸FGs对嗜热链球菌生长的影响; 小写字母不同表示组间差异显著(P<0.05)。
3 结论
本试验以发酵麸皮FGs产量为指标,通过单菌发酵及混菌发酵筛选出最优菌种组合为枯草芽孢杆菌+地衣芽孢杆菌+酿酒酵母,以该菌种组合发酵小麦麸皮获得的FGs产量为655.9 nmol/g,较原料中FGs产量207.5 nmol/g提高了316%。进一步对制备小麦麸皮FGs的发酵工艺条件进行优化,最佳发酵工艺参数为:接种量为10.7%,发酵时间为58.5 h,发酵温度为42.5 ℃,料水比为1∶1.6,在此发酵条件下得到的小麦麸皮FGs产量为1273.18 nmol/g,发酵效果较为明显。此外,对其体外抗氧化和益生活性评价发现,发酵麦麸FGs对羟自由基清除率为33.68%(4 mg/mL),对DPPH自由基清除率为87.42%(1 mg/mL),还原力为1.078 (4 mg/mL),说明发酵麦麸FGs具有一定的抗氧化能力;发酵麦麸FGs对嗜热链球菌和植物乳杆菌增殖均有一定的促进作用。
利用枯草芽孢杆菌、地衣芽孢杆菌和酿酒酵母混菌发酵小麦麸皮,获得了产量较高且具有体外抗氧化和益生活性的FGs,提高了小麦麸皮的附加值,为提高小麦麸皮的综合利用率提供了有效的途径。
